磁共振成像弥散张量成像在胶质瘤分级诊断中的应用
2019-12-04丁丹卉
丁丹卉
(河南省许昌市中心医院 医学影像科,河南 许昌 461000)
胶质瘤又称为神经胶质瘤,源于神经上皮细胞,其主要来源是神经胶质细胞肿瘤,也是原发性中枢神经系统肿瘤中最常见的一种肿瘤。胶质瘤的浸润能力很强,能沿着血管周围间隙、神经纤维束生长,其生物学的特性与肿瘤的恶性程度有密切联系[1]。不同级别的胶质瘤血管内皮细胞增生情况不尽相同,且同正常的血管组织比较,此类血管通透性较高,因此可以通过观察胶质瘤微血管成像情况来判断胶质瘤及其分级[2]。磁共振成像(magnetic resonance imaging, MRI)的弥散张量成像(diffusion tensor imaging,DTI)对组织内水分子的运动及白质纤维束结构较为敏感,其成像可以直观、清晰地观察胶质瘤同周围组织的生长情况,因此常作为胶质瘤的诊断方法[3]。本研究通过分析胶质瘤患者DWI 成像特点,为医师进行疾病诊断提供参考依据。
1 资料与方法
1.1 一般资料
回顾性收集2015 年3 月至2018 年10 月本院收治的78 例胶质瘤患者为研究对象,患者均经组织病理学证实为脑胶质瘤患者,且均为首次诊断脑肿瘤,入组前未进行脱水及放化疗处理。本研究经院伦理委员会审批,所有患者及其家属均知情同意。78 例患者资料中,男48 例,女30 例;年龄8~72 岁,平均(52.3±10.5)岁。低级别胶质瘤为Ⅰ级、Ⅱ级,高级别胶质瘤为Ⅲ级、Ⅳ级。
1.2 方法
患者入院后均常规进行MRI、T1WI、T2WI 检查和DTI 检查。选择美国GE 公司生产的3.0T 超导磁共振扫描仪,8 通道头颈部联合线圈。扫描前嘱患者排空膀胱,取下金属物品,避免金属造成伪影干扰成像。患者先进行常规扫描。常规定位后,对患者进行矢状位的T1WI-FLAIR 序列扫描;采用轴位的T2WI-FSE 序列、T2WI-FLAIR 序列进行扫描。DWI 序列则采用SE-EPI 序列,扫描范围为全脑。
1.3 图像处理
将扫描数据导入Siemens Syngo 工作站进行分析,首先进行图像校正,消除图像噪声,提升图像分辨率,然后进行阈值设定。经工作站计算自动生成表观弥散系数(apparent diffusion coefficient,ADC)图、各向异性分数(fractional anisotropy,FA)图、弥散加权成像(diffusion weighted image, DWI)图,以肿瘤实质区、瘤周水肿区(距肿瘤2 cm)、水肿旁白质区作为3 个感兴趣区(region of interest,ROI)测得FA 值,取平均值,计算肿瘤实质区、瘤周水肿区、正常白质区的ADC 值。所有图均由两名高年资的影像学医师进行阅片比较,并根据WHO 制定的分级标准将肿瘤进行分级,为便于研究,本文将Ⅰ级、Ⅱ级患者归纳为低级别胶质瘤,共26 例;将Ⅲ级、Ⅳ级患者归纳为高级别胶质瘤,共52 例。
1.4 统计学方法
成像结果的FA 值及rFA 值、ADC 值均采用均数±标准差()表示,两组间比较采用两独立样本t检验,组内比较采用配对样本t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 不同级别的胶质瘤3个ROI区的FA值比较
78 例胶质瘤患者的FA 值、相对各向异性分数(rFA)值如表1 所示,在同一级别胶质瘤中,FA 值随着肿瘤实质至瘤周水肿区、水肿旁白质区等依次向外递增。相同部位,高级别胶质瘤的FA值、rFA 值均显著低于低级别胶质瘤,差异具有统计学意义(P<0.05)。
2.2 不同级别的胶质瘤ADC值比较
同一级别胶质瘤中,肿瘤实质区的ADC 值显著低于瘤周水肿区、正常白质区(P<0.05);且同一部位的ADC 值比较,高级别胶质瘤的ADC 值均显著高于低级别胶质瘤 ADC 值(P<0.05)。见表2。
2.3 图片对比观察
此例患者男,左额叶转移性乳头状腺癌,图1为T1WI 显示左额叶囊实性肿块,囊性部位为低信号,实性部分为等信号;图2 为T2WI 显示病灶囊性部分高信号,瘤周可见稍高信号水肿带,实性部分等信号;图3 为FA 显示病灶呈低信号。FA 图与常规MRI 图比较,可显示肿瘤侵犯脑组织程度,并显示肿瘤与周围蛋白质纤维的空间关系。
表1 不同级别的胶质瘤3 个ROI 区的FA 值及rFA 值比较 ()

表1 不同级别的胶质瘤3 个ROI 区的FA 值及rFA 值比较 ()
注:†与同级别胶质瘤内水肿旁白质区参数比较,P <0.05。
级别低级别胶质瘤高级别胶质瘤t值P值FA值rFA值例数26 52水肿旁白质区0.765±0.067 0.731±0.072 2.011 0.047肿瘤实质区0.143±0.048†0.123±0.025†2.427 0.018瘤周水肿区0.246±0.049†0.177±0.035†7.155 0.000水肿旁白质区0.364±0.051 0.311±0.046 4.627 0.000肿瘤实质区0.433±0.027†0.361±0.038†8.622 0.000瘤周水肿区0.685±0.037†0.468±0.072†14.413 0.000
表2 不同级别的胶质瘤ADC 值比较 ()

表2 不同级别的胶质瘤ADC 值比较 ()
注:†同一级别胶质瘤内,与正常白质区比较,P <0.05。
级别低级别胶质瘤高级别胶质瘤t值P值正常白质区0.781±0.231 0.847±0.108 0.718 0.021例数26 52肿瘤实质区1.195±0.129†1.012±0.085†7.498 0.000瘤周水肿区1.198±0.127†1.014±0.153†5.284 0.000
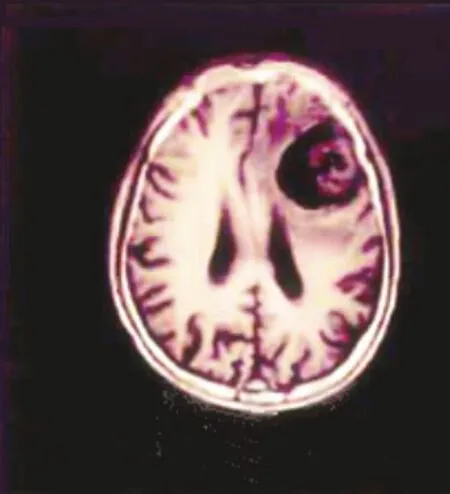
图1 同一患者T1WI 成像图

图2 同一患者T2WI 成像图
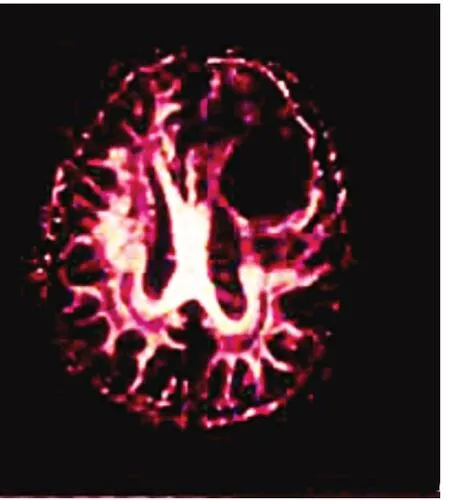
图3 同一患者FA 成像图
3 讨论
DTI 技术由Basser 在1992 年提出,其成像原理是依据水分子的弥散运动,即布朗运动,通过从三维角度定量描绘水分子大小、运动方向,因此根据成像的定量参数值如FA、ADC 值来判断分子运动,从而判断肿瘤的生长情况[4]。布朗运动分为2 类,第1 类为各向同性弥散,是指在完全均质的溶液中,分子朝向各个方向的运动都是等距的,例如脑脊液、大脑灰质中的水分子运动;第2 类为各向异性弥散运动,是指分子运动具有方向依赖性,分子朝向各个方向弥散的距离不等,例如神经纤维组织内的水分子运动,其弥散的各向异性与脑白质内神经纤维方向和结构有关,因此当脑组织发生病理变化时,相应部位的水分子弥散运动也会发生改变,通过DTI 成像判断组织病理变化[5-6]。局部组织的ADC 值主要与细胞结构有关,胶质增生程度、肿瘤纤维化等组织结构均会影响ADC 值,故在DTI 引起人体磁共振扩散成像时,ADC 是常用的评价整体弥散效应的指标之一。FA 则是反映体内弥散各向异性的指标,指水分子各向异性成分在整个扩散张量的比例,如各向异性弥散程度降低,其FA 图信号亦降低。胶质瘤患者预后较差与胶质瘤的生长特性—侵袭性生长方式紧密相关,这为临床治疗及肿瘤分级带来较大的困难,即使执行外科手术,外科医师很难精准地判断肿瘤浸润情况,无法做到肿瘤完全切除,因此患者术后复发率增加,预后差[7]。常规的MRI 成像技术能有效显示病灶大小、形态,但对肿瘤侵犯正常白质区的判断并不精准,DTI 技术通过水分子运动的速率、方向,而胶质瘤在生长过程中破坏局部正常蛋白质的生理结构,因此通过DTI 成像的FA 值、ADC 值能有效显示胶质瘤浸润生长情况,继而判断胶质瘤分级。理论上,随着肿瘤浸润的加重,FA 值会降低,ADC 值则越大,从本研究显示,高级别的胶质瘤的FA、rFA值均显著低于低级别胶质瘤,可能是高级别胶质瘤恶性程度高,肿瘤代谢旺盛,大量异常血管及内皮细胞增生,其细胞结构完整性遭到破坏,自由水浸润至神经纤维轴突间隙,故表现为FA 值降低。另外,转移瘤细胞形态各异,无正常神经纤维轴向上的一致性,因此rFA 值降低,因此FA值、rFA 值的变化说明肿瘤血管增殖越迅速,该数值降低越明显。本组的高级别胶质瘤患者的ADC值较低,可能是有些高级别胶质瘤肿瘤增殖迅速,细胞体积增大,排列疏松,细胞外间隙减少,水分子扩散程度减小,可见ADC 值越低,胶质瘤肿瘤恶性程度越高。但高级别胶质瘤细胞多数合并水肿,包括细胞内水肿和细胞外水肿,对FA 值影响较大,对ADC 无较大影响,所以FA 较ADC 值为更能反映胶质瘤级别的一个指标。
综上所述,FA 值、ADC 值均能有效评价胶质瘤分级,尤其是FA 值,能区分低级别胶质瘤和高级别胶质瘤的实质成分,且rFA 值在瘤周水肿区亦能有效鉴别胶质瘤级别。本研究不足之处在于瘤周水肿区的对照,且样本量较小,未与其他肿瘤进行对比分析,但DTI 能大大提高胶质瘤诊断分级水平,值得临床推广。
