MOFs材料研究进展
2019-12-03屈静李秦伟
屈静 李秦伟
摘 要:金属有机框架化合物MOFs材料,由金属中心与桥连配体构成。构成框架的金属中心及有机配体同简单的配合物、高分子聚合物相比,有着非常显著的差异,因此,MOFs材料的物理化学性质根据金属中心和有机配体的变化而具有明显的多样性。概述了MOFs材料的产生过程,总结了MOFs材料的多孔性、大的比表面积、结构的多样性及具有不饱和金属配位点的特点,综述了其在燃气存储、荧光性能方面的研究进展,并概述了其在其他领域的研究进展。
关 键 词:MOFs; 多孔; 燃气; 荧光性能
中图分类号:TB383 文献标识码: A 文章编号: 1671-0460(2019)04-0819-06
Abstract: Metal-organic frameworks, MOFs materials are composed of metal centers and bridged ligands. The metal centers and organic ligands in the frameworks are significantly different from those of simple inorganic complexes or organic polymers, therefore, the physical and chemical properties of MOFs materials have obvious diversity according to the change of metal centers and organic ligands. In this paper, the production process of MOFs materials was outlined. Characteristics of MOFs materials were summarized, such as porous property, large specific surface area, the diversity of structure and unsaturated metal coordination sites. The research progress of MOFs materials in gas storage, fluorescence property and other application areas was reviewed.
Key words:MOFs; porous; fuel gas storage; fluorescence property
金屬有机框架化合物(Metal-Organic Frame- works) ,简称MOFs材料。它是由金属离子或金属簇构成的金属中心与桥连配体通过自组装方式相连接,形成的拥有周期性结构的一类多孔晶态材料。构成框架的金属中心及有机配体同简单配合物、高分子聚合物相比,有着非常显著的差异,因此,MOFs材料的物理化学性质根据金属中心和有机配体的变化而具有明显的多样性。近年来,化学合成方法如水(溶剂)热、微波法等的使用,使得MOFs材料迅速发展,已由设计金属有机框架合成向实用性研究转变。
1 MOFs材料的产生
MOFs材料是由配位聚合物发展而来的,合成色素普鲁士蓝是早期发现的一种配位聚合物, 1977年由X-射线衍射确定了它是混合价态Fe(II)/Fe(III)的网状结构[1]。随后,由Hoffman等发现,Powell等通过X-射线研究,得出了与普鲁士蓝的结构因子相似的配位聚合物Ni(CN)2(NH3)·C6H6[2]。Iwamoto等使用联二苯替换Ni(CN)2(NH3)·C6H6的客体分子苯,在一定范围内拓宽了配位聚合物的范围[3]。Robson等[4]发现的金属中心Cu(I)与四氰基四苯基甲烷连接形成的配合物材料,表明配位聚合物除了与氰根外还可与有机配体桥连。之后,配体的多样性不断增加,从氰化物到有机腈再到基于吡啶的供体。20世纪90年代中期,在Kitagawa等[5]使用4,4′-bpy构筑了具有稳定结构的多微孔材料之后,多孔材料的合成研究便获得了很大的关注,Yaghi等[6]使用多羧酸合成的多孔结构就是一个典型的例子。相较于之前的配位聚合物,这些多孔材料配合物具有周期性网络结构,可以可逆的吸收-释放气体,被称为金属-有机框架材料(MOFs材料)。
2 MOFs材料的特点
2.1 多孔性
研究表明,MOFs材料一般均具有多孔性和永久性孔隙,孔径范围较小的MOFs材料与典型的沸石的直径相当,多数大孔直径MOFs材料的最低骨架自由体积大于50%[7-11]。MOFs材料是通过连接体作为支架构筑内部空间,相比于传统多孔材料并没有器壁结构。另一方面,采用连接体作为支架构筑内部空间会提高孔体积及比表面积,且孔结构根据骨架结构的不同而变化。
2.2 大的比表面积
在气体吸附分离和存储中比表面积具有重要意义,高比表面积的物质在多孔材料研究领域具有重要的应用价值。
研究表明,相比于具有有序结构的沸石,一些MOFs材料的比表面积较大。Yaghi等[10]设计的MOFs材料由金属和具有多齿型的羧基配体配合而成,Zn4O(BDC)3(MOF-5)的Langmuir比表面积为2 900 m2·g-1, Zn4O(BTB)2·(DEF)15·(H2O)3 (MOF-177)的Langmuir比表面积可达到4 500 m2·g-1,有超大空隙可键合多环有机大分子[11]。
2010 年,Yaghi等[12]对多齿型羧基有机配体进行了拓展,合成出了BET比表面积为6 240 m2·g-1,Langmuir比表面积达到10 400 m2·g-1的具有清晰孔道的三维晶体结构MOF-210。
2.3 结构的多样性
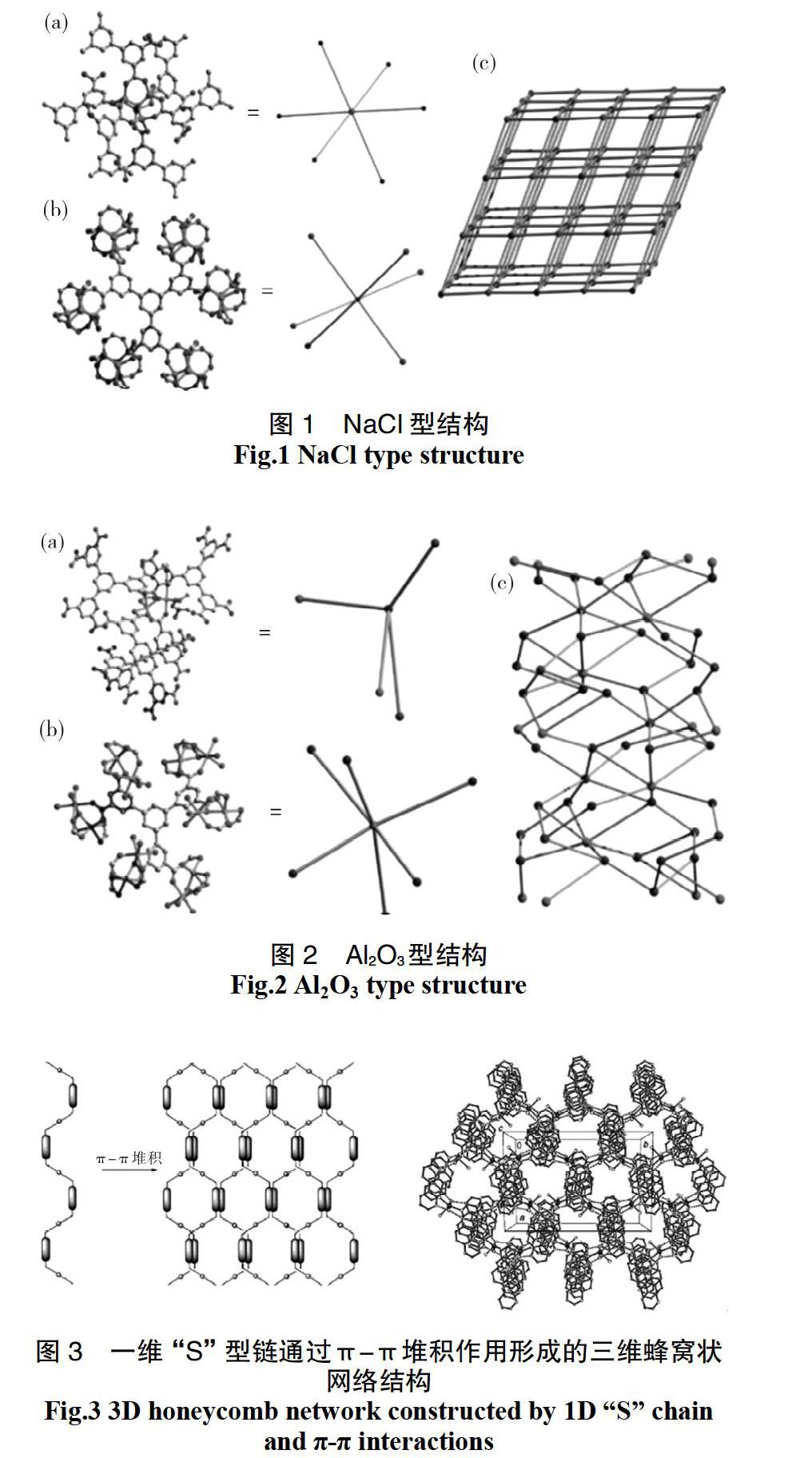
MOFs材料结构的多样性取决于金属离子和有机配体的配位能力多样性,也与配体环境和金属离子的配位方式有关,因此配位模式多种多样。而一些基团如羧基基团本身配位模式较多,且根据不同程度的去质子化其配位模式更加多样化。2011年Crystal Growth&Design上报道的使用3,3',3'',5,5',5''-苯基-1,3,5-三-苯六甲酸合成出的NaCl型、Al2O3型MOFs材料就是MOFs结构多样性的很好的例子(见图1、图2)[13]。
MOFs一般具有一维、二维和三维结构,而氢键、π-π堆积等弱相互作用力会使MOFs的维度结构发生由低向高的转变[6,14,15]。1998年Yaghi等[6]使用对苯二甲酸合成的MOFs结构就是Zn2+与有机配体构成的二维结构在O—H…O氢键作用下形成的三维结构。图3为Mingliang Tong等报道过的一个由π-π堆积构筑的三维蜂窝状网络结构,[Cu(4,7-phen)(H2O)3]n2n+阳离子和游离的邻菲啰啉(4,7-phen)分子通过不同方向的π-π堆积作用,组装成三维蜂窝状网络结构[14]。
2.4 具有不饱和金属配位点
在合成MOFs材料时,金属中心受空间位阻等原因的影响,除与有机配体配位外还会结合一些不稳定配体。
大部分情况下,不稳定配体为溶剂分子(如水、乙醇、甲醇、DMF等),它们通过与金属离子的Lewis酸碱作用配合在一起,这些不稳定配体稳定性较低,在外界条件如温度发生改变时,形成中性客体分子从MOFs结构中脱落,这些中性客体分子的脱落在较多情况下并不会对材料的骨架结构造成影响,反而会在材料的结构中形成开放的金属点。这些金属点在一定条件下形成的不饱和配位点会增强材料的吸附及存储气体性能,同时促进和底物间的相互作用,是材料催化性能的主要影响因素[16,17]。
3 MOFs材料在燃气储存方面的研究进展
随着对新型燃料气体的开发与利用,能源储备材料的需求日益扩大,因而具有超低密度的多孔材料—MOFs材料在气体吸附、燃气储存等方面引起了研究者的广泛关注,目前,国内外研究者在MOFs材料储存H2、CH4方面进行了大量的实验和理论计算方面的研究工作。
3.1 MOFs材料在储氢方面的研究进展
氢气是一种理想能源,以其燃烧热高及燃烧后主要产物是水的特点,赢得了人们的青睐。氢能安全性是影响其整个生产、存储和使用过程以及实现工业化应用的重要条件。储氢方式有压缩储氢、金属氢化物储氢、液化储氢等。压缩储氢耗能高且对容器材质要求高。液氢存储在能耗较大的前提下对容器要求较高且存储过程伴随一定的蒸发损失。金属氢化物在存储过程中易受储氢密度低和放氢速度慢等问题的限制。近几年,MOFs材料因具有较大的比表面积和孔体积,成为了一种新型的储氢材料,其储氢性能得到了普遍的关注及探索[18]。
相比于一般MOFs材料,储氢MOFs材料的比表面积更大,1999年,Yaghi等[10]报道了Zn2+与对苯二甲酸合成了具有储氢功能的MOF-5:Zn4O(BDC)3,并在之后报道了其在77K、1bar下的氢气储存量为1.3%(wt)[19]。MOF-5的储氢量虽然较低但具有一定的指导意义,研究表明,当MOF-5的有机配体或有机配体和金属离子同时改变,可合成新的、具有类似结构的MOFs材料,如使用1,3,5-三对羧苯基苯(BTB)、2,5-二羟基苯-1,4-二羧酸(DHBDC)、均苯三甲酸(H3BTC)替换MOF-5的有机配体,或向有机配体的苯环上引入-Br、-C2H4-等官能团。通过储氢性能的对比,研究者们发现大的有机配体对氢具有更强的亲和力,但配体的存在对基体材料的储氢性能无明显作用,而对储氢性能主要表现为有机配体分子连锁效应的作用(骨架结构通过物理作用贯穿或交织在一起形成一个分子整体的现象)及其引起的孔直径及孔体积的变化[19,20]。
Yildirim等[21]研究了不同的金属离子对有机配体为2,5-二羟基-1,4-苯二甲酸二甲脂(DHTP)的MOFs材料M2(DHTP)(M= Mg, Co, Ni, Mn, Zn)储氢性能的影响。结果表明在77K、1bar的条件下,此类MOFs材料储氢量的大小顺序为(以金属离子表示):Ni2+ > Co2+ > Mg2+> Mn2+ > Zn2+。将理论计算的各金属与氢之间结合键长、键能以及库仑力与实验测得的吸附能进行了比较分析,结果表明骨架内的八面体金属结构的储氢性能主要受金属与氢之间的库仑作用力影响。
研究者们还通过向MOFs结构中引入桥联溢出结构、将碱金属离子掺杂到MOFs材料中等方法,在一定程度上提高了原MOFs材料的储氢能力[22,23]。此外,国内外研究者从理论计算的角度对MOFs材料的儲氢性能也进行了大量的研究工作,有很多预测、模拟结果都得到了实验结果的验证[24]。
目前,MOFs 材料在储氢领域的研究进展迅速,但仍存在较多的关键性问题尚需解决,研究MOFs材料的储氢机理及结构对储氢性能的影响以及如何改善并提高对储能材料的发展具有重要意义。
3.2 MOFs材料在储存CH4方面的研究进展
甲烷作为一种清洁能源由于具有较高的碳氢比因此能释放出较大能量的同时产生的二氧化碳较少。甲烷是有机物分解腐烂时形成的,比石油分布更广也更容易获取,因此在交通领域有巨大的潜在应用。而目前的使用现状基本为采用压缩天然气的方法,这种高压条件存储的 (>200 atm)甲烷具有潜在的危险。美国 DOE为更好的发展甲烷存储工业,把甲烷的存储目标设定为室温35 bar 压力的条件下180 v/v[25],尽管一些碳材料符合要求但由于有限的填充密度而限制了在储气方面的进一步应用,因此发展具有高比表面积的多孔材料对气体存储的发展具有较大的应用价值。
虽然MOFs材料比表面积较大,但内部孔径较小,难以容纳甲烷分子,所以用于吸附CH4的MOFs材料需要有大的孔径。近年来,Hongcai Zhou等[26]致力于研究合成拥有高储甲烷性能的MOFs,他们为克服MOFs材料孔径小不能容纳甲烷分子的问题,用更多的苯环来增大MOFs材料的孔径,合成出了具有纳米级的孔洞的PCN-14,在 290 K和35 bar下,绝对吸附量为230 v/v(过剩吸附量为220 v/v),高出美国 DOE 目标的 28%。2016年,中山大学张杰鹏等[27]合成的MAF-38,此材料为八面体、类立方八面体笼状结构,在298 K和65 bar条件下,它的体系吸附量为263 v/v。此材料与MOF-5和PCN-14具有相似的笼状结构、孔隙体积和比表面积,但具有不同孔隙形状和尺寸。通过计算、模拟,该材料的笼状结构有非常合适的形状、尺寸和吸附点,使得甲烷高效吸附与堆积。
各种多孔MOFs对甲烷的存储数据表明,高的比表面积是甲烷存储的必要条件但不是决定性因素。例如,上面提到的具有220 v/v 过剩吸附量的PCN-14的Langmuir 表面积为2176 m2/g,而 Langmuir 表面积为5 900 m2/g的MIL-101的甲烷过剩吸附容量仅为110 v/v,远远小于 PCN-14储存性能[28]。为了进一步说明结构与甲烷储存性能的关系,还需要系统性地研究孔洞尺寸、功能化配体等其它一些因素。
4 MOFs材料在荧光性能方面的研究进展
MOFs材料的金属中心和有机配体均可为荧光的产生提供平台,并且金属和配体之间的电荷转移也能导致荧光的产生,因此,利用金属中心与有机配体自组装形成的光功能MOFs材料成为了当下的一个研究热点。目前构筑光功能金属有机骨架结构的方法主要有引入荧光配体、引入有荧光发射功能的金属离子、引入荧光客体、表面修饰荧光基团四种[29]。研究者们对前两者的研究较多,但后两种构筑方法是未来光功能MOFs材料的发展趋势。
4.1 引入荧光配体的MOFs材料
由于刚性稠环大共轭有机分子如含氮杂环类、吡啶类及羧酸类等有利于增加分子的共平面性和电子的流动性以及减弱分子内振动,使得吸收和发射率较强,因此一般作为连接配体来设计具有荧光的MOFs结构。
当MOFs结构组装时,荧光配体之间距离较小,相互之间的电子作用(包含MLCT(金属到配体的电荷转移)、LMCT(配体到金属的电荷转移)及LLMT(配体到配体的电荷跃迁))增强,使得MOFs的发光行为与组成该结构的配体的发光行为有所不同,具体表现在光谱的位移、发射光谱谱带的变宽及荧光寿命的增强[28]。
前面提到的MOF-5的配體是典型的羧酸类荧光配体,MOF-5是由Zn(CH3COO)2结构单元和1,4苯二甲酸相连接构成的网络立方体结构,有机配体1,4苯二甲酸的发射峰位于紫外区,而配合物MOF-5的发射峰位于525 nm处,发射出荧光,这是由于LMCT机理,即配体到金属的电荷转移机理产生的[29,30]。Qiangrong Fang等[31]合成了两个含羧酸类荧光配体的MOFs结构Zn3(BTC)2(DMF)3 (H2O)·(DMF)(H2O)和Cd4(BTC)3 (DMF)2 (H2O)2·6H2O,它们分别在410和405 nm处显示荧光发射,与单独配体在370 nm处的荧光发射相比略有偏移,这是由于金属离子微扰产生的。
基于含氮杂环类以及吡啶类等配位基团的配体也是常见的荧光配体, Yongqin Wei等[32]使用1-氢-苯并咪唑-5,6-二甲酸(H3BIDC)合成的Mn(HBIDC),它的最强荧光发射为在726 nm处的红色荧光发射,单独荧光配体1-氢-苯并咪唑-5,6-二甲酸的荧光发射在440 nm附近,此MOFs的荧光发射是基于Mn2+到荧光配体HBIDC2-的MLCT电荷转移。Ming-Xing Li等[33]基于2,4,6-三(4-吡啶)-1,3,5-三唑(TPT)和Ag(I)、Cu(I)、Zn(II)的配位,合成出了一系列MOFs结构,TPT配体的发射峰出现在490 nm处,合成出的MOFs的发射峰出现在465~478 nm范围内,发射出荧光,此荧光为金属离子微扰荧光,属于典型的基于荧光配体的发射。Antigoni Douvali等[34]以2,5-二羟基对苯二甲酸(H4dhtp)为配体,以N,Nˊ-二甲基甲酰胺,N-甲基吡咯烷酮、H2O为溶剂,合成出的一系列碱土金属MOFs材料,在490~580 nm之间表面出强的荧光发射,此类MOFs的荧光发射是激发态分子中配体质子转移所致。
4.2 引入具有荧光发射功能金属离子的MOFs材料
过渡金属离子具有未成对的电子,会发生荧光猝灭作用,而稀土元素除了La3+和Lu3+以外,其余所有Ln3+都可以形成从紫外光到可见光以及近红外光范围的f-f发射,因此具有较好的发光性质。但由于稀土离子的f-f跃迁禁阻,较低的光吸收率导致单个离子不易发射出特征荧光,因此需要能量传递来克服这个问题。而MOFs材料的结构可将能量传递给稀土离子,从而获得更高的发光效率。
当有机配体的最低三线态能级与稀土离子的辐射能级相匹配时,可以发生T1-Ln3+的能量传递,稀土离子发生跃迁辐射出特征f-f光谱并回到基态,Eu3+、Sm3+、Tb3+、Tm3+的特征荧光分别为红色、橙色、绿色、蓝色,而Yb3+、Nd3+、Er3+发出的光则在红外区附近[35-40]。
另外,能量也有可能直接从配体激发单重态传递到稀土离子辐射能级(主要是稀土Eu3+和Tb3+),然后辐射出特征光谱跃迁到基态能级[41]。因此,向MOFs材料中引入不同的稀土离子,可得到不同范围的荧光发射。
4.3 引入荧光客体的MOFs材料
MOFs具有一定的孔洞,可以包裹客体分子,如荧光染料、稀土离子等发光物,从而表现出客体的特征荧光发射。2007年,Shilun Qiu等[42]成功将Rh6G染料分子包裹于含有一维六角形管状通道的MOFs中,组装后的新物质表现出与掺杂Rh6G染料的纳米结构材料相似的黄色荧光。2010年,Feng Luo等[43]使用Eu3+和Tb3+替换[NH4]2 [ZnL]·6H2O (L=1, 2, 4, 5-苯四甲酸)1D孔道里的NH4+,替换后的新物质表现出稀土离子的特征荧光发射。
4.4 表面修饰荧光基团的MOFs材料
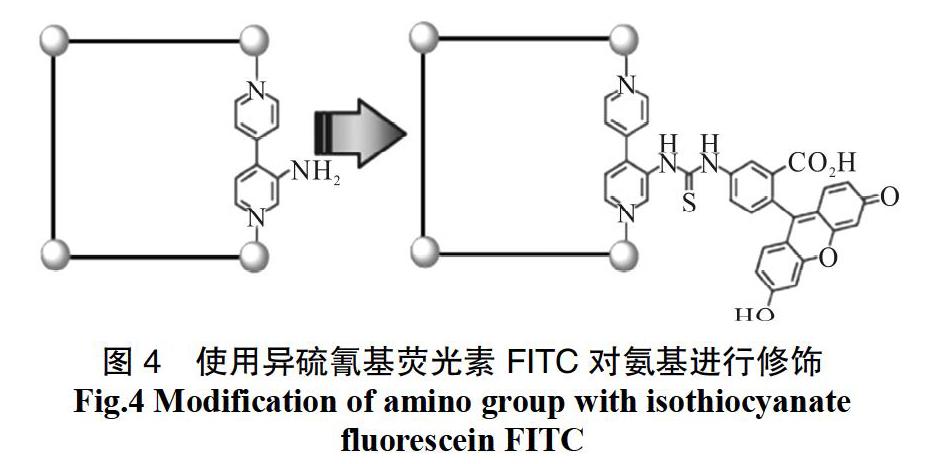
除了在MOFs中引入配体等前合成法外,还可采用后合成法即通过荧光功能基团与MOFs结构上的活性位点发生反应达到修饰的作用。到目前为止,活性位点主要有氨基、羧基等基团。Chunying Duan等[44]以吡啶和4,4′,4"-苯-1,3,5-三-苯甲酸为原料,合成出了一种MOFs结构BTPY-NH2,此MOFs结构具有三维大孔洞,在此基础上,使FITC(一种荧光素)进入孔洞与MOFs结构中的氨基反应,实现了对MOFs的后合成荧光修饰。修饰后的结构在515 nm处有绿光发射(图4)。
Suhyun Jung等[45]探索了对MOFs羧基基团的后合成荧光修饰。采用1-乙基-3-(3-二甲基氧丙基)碳二亚胺、二环己基碳二亚胺将MOFs结构表面的羧酸基团激活,然后再使用EGFP(一种共轭增强型绿色荧光蛋白)等生物材料或者蛋白质对激活后的MOFs机构进行修饰,通过荧光显微镜检测,表现出的强烈绿色荧光表明EGFP的确修饰到了MOFs上。
5 MOFs材料在其他应用领域的研究进展
MOFs材料因具有大的比表面积和孔体积,对氢气、甲烷等燃气存储具有很大的优势,是新型的燃气存储材料,随着对MOFs材料结构与燃气存储之间的研究,其作为燃气存储材料将会有更为实用的发展。由金属中心与有机配体自组装成的MOFs材料在修饰后由具有良好的发光性能,是获得新型光学材料的有效途径。MOFs材料除了在以上所提到的燃料存储和荧光性能方面拥有广泛的应用外,在化学、医药学、材料科学等其他领域也有很好的应用前景。
通过对MOFs材料及其合成方法、条件不断深入的研究,更多种类的金属用来构建MOFs材料,由于第Ⅷ族金属如Fe、Co、Ni等金属的引入,使得MOFs材料在磁学领域具有一定的应用价值。Fe、Co、Ni等第Ⅷ族金属可与MOFs形成具有良好磁性和稳定性的配合物,进而有利于研究材料磁学性质与微观结构之间的关系[46-48]。此外,由于MOFs材料的多孔性、大的比表面积、结构的多样性及具有不饱和金属配位点的特点,很多研究者正致力于MOFs材料在催化[49, 50]、化學传感[51, 52]、药物吸收与释放[53]等领域的开发和研究。
参考文献:
[1]Buser HJ, Schwarzenbach D, Petter W, et al. The crystal structure of Prussian Blue, Fe4[Fe(CN)6]3.xH2O[J]. Inorg. Chem., 1977, 16(11): 2704-2710.
[2]Rayner JH, Powell HM. J. Structure of molecular compounds. Part X. Crystal structure of the compound of benzene with an ammonia–nickel cyanide complex[J]. Chem. Soc., 1952,6(6):433-438.
[3]Iwamoto T, Miyoshi T, Sasaki Y. The Metal Cyanide Aromatic Clathrates. XIII. The Crystal Structure of the Hofmann-type Biphenyl Clathrate, Diammineickel(II) Tetracyanonickelate(II) Di-biphenyl: Ni(NH3)2Ni(CN)4·2C12H10[J]. Acta. Cryst., 1974, B30: 292-295.
[4]Hoskins BF, Robson R. Infinite polymeric frameworks consisting of three dimensionally linked rod-like segments[J]. J. Am. Chem. Soc., 1989, 111(15): 5962-5964.
[5]Kondo M, Yoshitomi T, Seki K, et al. Three‐Dimensional Framework with Channeling Cavities for Small Molecules: {[M2(4, 4′‐bpy)3(NO3)4]·xH2On (M Co, Ni, Zn)[J]. Angew. Chem., Int. Ed. Engl., 1997, 36(16): 1725-1727.
[6] Li HL, Eddaoudi M, Groy TL, et al. Establishing Microporosity in Open Metal?Organic Frameworks: Gas Sorption Isotherms for Zn(BDC) (BDC = 1,4-Benzenedicarboxylate)[J]. J. Am. Chem. Soc., 1998, 120(33): 8571-8572.
[22]Li YW , Yang RT. Hydrogen storage in metal-organic frameworks by bridged hydrogen spillover[J]. J. Am. Chem. Soc., 2008, 128(25): 8136-8137.
[23]Mulfort KL, Hupp JT. Alkali metal cation effects on hydrogen uptake and binding in metal-organic frameworks[J]. Inorg. Chem., 2008,47(18): 7936-7938.
[24]Getman RB, Bae YS, Wilmer CE, et al. Review and Analysis of Molecular Simulations of Methane, Hydrogen, and Acetylene Storage in Metal–Organic Frameworks[J]. Chem. Rev., 2012, 112(2): 703-723.
[25]Düren T, Sarkisov L, Yaghi OM, et al. Design of New Materials for Methane Storage[J]. Langmuir, 2004, 20(7): 2683-2689.
[26]Ma SQ, Sun DF, Simmons JM ,et al. Metal-organic framework from an anthracene derivative containing nanoscopic cages exhibiting high methane uptake[J]. J. Am. Chem. Soc., 2008, 130(3): 1012-1016.
[27]Lin XM, He CT, Liu Y et al. A Metal–Organic Framework with a Pore Size/Shape Suitable for Strong Binding and Close Packing of Methane[J]. Angew. Chem. Int. Ed., 2016, 55(15), 4674–4678.
[28]Llewellyn PL, Bourrelly S, Serre C, et al. High uptakes of CO2 and CH4 in mesoporous metal-organic frameworks MIL-100 and MIL-101[J]. Langmuir, 2008, 24(14): 7245-7250.
[29]武鵬彦. 光功能金属有机骨架的构筑及其性能研究[D]. 大连理工大学, 2013.
[30]Bordiga S, Lamberti C, Ricchiardi G, et al. Electronic and vibrational properties of a MOF-5 metal-organic framework: ZnO quantum dot behavior [J]. Chem. Comm., 2004, (20):2300-2301.
[31]Fang QR, Zhu GS, Xue M, et al. Structure, Luminescence, and Adsorption Properties of Two Chiral Microporous Metal?Organic Frameworks[J]. Inorg. Chem, 2006, 45(9): 3582-3587.
[32]Wei YQ, Yu YF , Wu KC. Highly Stable Five-Coordinated Mn(II) Polymer [Mn(Hbidc)]n (Hbidc=1H-Benzimidazole-5,6- dicarboxy- late): Crystal Structure, Antiferromegnetic Property, and Strong Long-Lived Luminescence[J]. Cryst. Growth Des., 2008, 8(7): 2087-2089.
[33]Li MX, Miao ZX, Shao M, et al. Metal-Organic Frameworks Constructed from 2,4,6-Tris(4-pyridyl)-1, 3,5-triazine[J]. Inorg. Chem., 2008, 47(11): 4481-4489.
[34]Sava Gallis DF, Rohwer LES, Rodriguez MA, et al. Efficient Photoluminescence via Metal–Ligand Alteration in a New MOFs Family[J]. Chem. Mater., 2014, 26 (9):2943–2951.
[35]Chandler BD, Cramb DT , Shimizu GKH. Microporous metal-organic frameworks formed in a stepwise manner from luminescent building blocks[J]. J. Am. Chem. Soc., 2006, 128(32): 10403-10412.
[36]Sun YQ , Yang GY. Organic-inorganic hybrid materials constructed from inorganic lanthanide sulfate skeletons and organic 4,5-imidazoledicarboxylic acid[J]. Dalton Trans., 2007 (34): 3771- 3781.
[37]Song XQ, Liu WS, Dou W, et al. Structure variation and luminescence properties of lanthanide complexes incorporating a naphthalene- derived chromophore featuring salicylamide pendant arms[J].Eru. J. Inorg. Chem,. 2008, 11: 1908-1912.
[38]Cheng JW, Zheng ST, Yang GY. Diversity of crystal structure with different lanthanide ions involving in situ oxidation-hydrolysis reaction[J]. Dalton Trans., 2007, (36): 4059-4066.
[39]Douvali A, Papaefstathiou GS, Gullo MP, et al. Alkaline Earth Metal Ion/Dihydroxy-Terephthalate MOFs: Structural Diversity and Unusual Luminescent Properties[J]. Inorg. Chem., 2015, 54 (12): 5813–5826.
[40]Chen BL, Yang Y, Zapata F, et al. Enhanced near-infrared- luminescence in an erbium tetrafluoroterephthalate framework[J]. Inorg. Chem., 2006, 45(22): 8882-8886.
[41]Binnemans K. Lanthanide-based luminescent hybrid materials[J]. Chem. Rev., 2009, 109(9): 4283-4374.
[42]Fang QR, Zhu GS, Jin Z, et al. Mesoporous Metal–Organic Framework with Rare etb Topology for Hydrogen Storage and Dye Assembly[J]. Angew. Chem. Int. Ed., 2007, 46(35): 6638-6642.
[43]Luo F , Batten SR. Metal-organic framework (MOF): lanthanide (III)-doped approach for luminescence modulation and luminescent sensing[J]. Dalton Trans., 2010, 39(19): 4485-4488.
[44]Zhang LJ, Jian Y, Wang J ,et al. Post-modification of a MOF through a fluorescent-labeling technology for the selective sensing and adsorption of Ag+ in aqueous solution[J]. Dalton Trans., 2012, 41(34): 10153-10155.
[45]Jung S, Kim Y, Kim S-J, et al. Bio-functionalization of metal–organic frameworks by covalent protein conjugation[J]. Chem. Commun., 2011, 47(10): 2904-2906.
[46]Shiga T, ?kawa H, Kitagawa S, et al. Stepwise synthesis and magnetic control of trimetallic magnets [Co2Ln(L)2(H2O)4] [Cr(CN)6]·nH2O (Ln = La, Gd; H2L = 2,6-Di(acetoacetyl)pyridine) with 3-D pillared-layer structure[J]. J. Am. Chem. Soc., 2006, 128 (51): 16426-16427.
[47]Cheng XN, Zhang WX, Chen XM. Single crystal-to-single crystal transformation from ferromagnetic discrete molecules to a spin-canting antiferromagnetic layer[J]. J. Am. Chem. Soc., 2007, 129 (51): 15738-15739.
[48]Zheng YZ, Xue w, Tong ML, et al. A two-dimensional iron(II) carboxylate linear chain polymer that exhibits a metamagnetic spin-canted antiferromagnetic to single-chain magnetic transition[J]. Inorg. Chem., 2008, 47(10): 4077-4087.
[49]Yoon M, Srirambalaji R, Kim K. Homochiral Metal-Organic Frameworks for Asymmetric Heterogeneous Catalysis[J]. Chem. Rev., 2012, 112(2):1196-1231.
[50]Yang D,Han Y, Xu W, et al. A Series of Lanthanide-Based Metal–Organic Frameworks: Synthesis, Structures, and Multicolor Tuning of Single Component[J]. Inorg. Chem., 2017,56: 2345-2353.
[51]Kreno Le, Leong K, Farha OK, et al. Metal-organic framework materials as chemical sensors[J]. Chem. Rev., 2012, 112 (2): 1105-1125.
[52]Li H Y, Wei Y L, Dong X Y, et al. Novel Tb-MOF Embedded with Viologen Species for Multi-Photofunctionality: Photochromism, Photomodulated Fluorescence, and Luminescent pH Sensing[J]. Chem. Mater., 2015, 27(4): 1327-1331.
[53]Horcajada P, Serre C, Maurin G, et al. Flexible porous metal-organic frameworks for a controlled drug delivery[J]. J. Am. Chem. Soc., 2008, 130(21):6774-678.
