miR-130a对缺氧诱导的人肺动脉平滑肌细胞增殖的影响
2019-12-03徐啟腾
徐啟腾,宋 敏
1)青岛市妇女儿童医院心脏中心 山东青岛 266022 2)青岛大学附属医院保健科 山东青岛 266022
肺动脉高压是先天性心脏病最常见的并发症,其致残率和病死率均较高。肺动脉高压的病理学特征为平滑肌细胞快速增殖致使小动脉内径变细,导致肺动脉压力升高。目前先天性心脏病肺动脉高压仍缺乏有效的治疗方式[1]。微小RNA(microRNA,miRNA)参与肺动脉高压的发生和发展[2]。近期的研究[2-3]提示miR-130a可能参与先天性心脏病肺动脉高压的发病过程。研究[4]表明Wnt信号通路在先天性心脏病肺动脉高压中参与肺动脉高压血管重构过程。诱发肺动脉高压发病的因素多而复杂,其中缺氧是重要原因[5]。因此本研究首先在先天性心脏病肺动脉高压患者血清中检测miR-130a的表达水平,并探讨miR-130a对缺氧诱导的人肺动脉平滑肌细胞(human pulmonary artery smooth muscle cell,HPASMC)增殖及Wnt信号通路的影响,以期为开发新型小分子药物用于靶向治疗先天性心脏病肺动脉高压提供实验基础。
1 材料与方法
1.1主要材料血清标本来源于2017年4月至2018年4月青岛市妇女儿童医院收治的先天性心脏病伴肺动脉高压(CHD-PAH)患儿及肺动脉压正常的先天性心脏病(CHD-norPAP)患儿各30例,患儿家属知情同意。肺动脉高压的诊断标准为静息状态下右心导管检测的肺动脉平均压>3.33 kPa,肺毛细血管压或左房压<2 kPa,运动状态下肺动脉平均压>4 kPa。血液样本在室温下静置1 h,4 ℃、3 000 r/min 离心10 min,取上清于-80 ℃冰箱保存。HPASMC购于美国Science Cell公司;DMEM培养基、胰蛋白酶、胎牛血清购于美国Gibco公司;miR-130a 抑制剂及抑制剂对照购于上海吉玛制药技术有限公司;RNA提取试剂盒购于北京康为世纪生物科技有限公司;M-MLV反转录试剂盒、RIPA蛋白裂解液购于碧云天生物技术研究所;SYBR Premix Ex Taq试剂盒购于日本TaKaRa公司;Lipofectamine2000转染试剂购于美国Invitrogen公司;EdU检测试剂盒购于广州市锐博生物科技有限公司;实验所用引物均由上海生工生物工程有限公司设计合成;BCA蛋白定量检测试剂盒购于武汉塞维尔生物科技有限公司;ECL发光检测试剂盒购于大连宝生物工程有限公司;Wnt1、β-catenin、GAPDH抗体及辣根过氧化物酶标记的二抗均购于英国Abcam公司。
1.2细胞培养及缺氧诱导将HPASMC加入到含体积分数0.5%胎牛血清的DMEM培养基中,置于含体积分数5%CO2、21%O2、74%N2的常氧培养箱中培养,24 h后将培养基更换为含体积分数10%胎牛血清的DMEM培养基,置于含体积分数5%CO2、3%O2、92%N2的缺氧培养箱中培养,24 h后收集细胞,记为缺氧组。常氧组细胞则置于常氧培养箱中培养24 h。
1.3细胞转染取处于对数生长期的HPASMC,以含体积分数0.5%胎牛血清的DMEM培养基将细胞密度调整为5×104个/mL,取200 μL细胞悬液接种于96孔板中,置于常氧培养箱中培养24 h后采用Lipofectamine2000进行转染,具体步骤依照说明书。将转染后的细胞置于含体积分数5%CO2、3%O2、92%N2的缺氧培养箱中继续培养48 h后进行指标检测。将转染miR-130a 抑制剂的细胞记为miR-130a 抑制物组,将转染抑制剂对照的细胞记为阴性对照组,将未转染的细胞记为空白对照组。
1.4qRT-PCR法检测miR-130a表达水平提取血清样本中、常氧及缺氧组HPASMC中、1.3中3组HPASMC中的总RNA,检测RNA浓度和纯度,将RNA反转录合成cDNA。miR-130a反转录引物序列5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGACATGCCCT-3’,操作步骤按照M-MLV反转录试剂盒说明书进行。将得到的cDNA采用SYBR Premix Ex Taq试剂盒进行PCR扩增。miR-130a引物:上游5’-GGCAGTCAATGCAATGTTAAAAG-3’,下游5’-CAGTGCGTGTCGTGGAGT-3’。以U6为内参,采用2-ΔΔCt方法计算miR-130a相对表达量。细胞实验每组设置3个复孔,重复3次。
1.5细胞增殖情况的检测取1.3中3组HPASMC,更换培养基为1 mL EdU培养基,继续孵育2 h,弃含EdU的培养基,加入胰蛋白酶消化3 min,离心收集细胞,再加入200 μL Apollo®染色反应液室温避光染色10 min,弃去染色液,再用Hoechst33342反应液进行DNA染色,PBS洗涤2次,上流式细胞仪测荧光强度。每组设置3个复孔,实验重复3次。
1.6Western blot检测细胞中Wnt1和β-catenin蛋白表达水平提取1.3中3组HPASMC的总蛋白,采用BCA法检测蛋白浓度,将蛋白与上样缓冲液混匀后加热变性,经100 g/L的聚丙烯酰胺凝胶电泳分离蛋白,湿转法转移至硝酸纤维素膜上,于含脱脂奶粉的封闭液中孵育4 h,分别加Wnt1和β-catenin抗体(均为1∶1 000稀释)、二抗(1∶3 000稀释)杂交。TBS洗涤后,采用ECL显色发光,于暗室中以凝胶成像仪拍照,采用Image J图像分析系统分析各条带灰度值,以GAPDH为内参,以目的蛋白条带与内参条带灰度值的比值表示目的蛋白的相对表达量。每组设置3个复孔,实验重复3次。
1.7统计学处理采用SPSS 21.0进行数据分析。CHD-norPAP组和CHD-PAH组、常氧组和缺氧组HPASMC中miR-130a相对表达量的比较均采用两独立样本的t检验;3组间miR-130a相对表达量、相对荧光强度、Wnt1和β-catenin蛋白相对表达量的比较均采用单因素方差分析,两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1CHD-norPAP组和CHD-PAH组、常氧组和缺氧组HPASMC中miR-130a表达的比较CHD-norPAP组和CHD-PAH组miR-130a的相对表达量分别为(1.00±0.09)、(2.01±0.08)(t=21.867,P<0.001)。常氧组和缺氧组HPASMC中miR-130a的相对表达量分别为(1.00±0.10)、(3.38±0.30)(t=13.741,P<0.001)。
2.2 3组HPASMC中miR-130a表达的比较结果见表1。由表1可知,与空白对照组和阴性对照组比较,miR-130a 抑制物组细胞中miR-130a的表达水平降低。
2.3 3组HPASMC增殖情况的比较结果见表1。由表1可知,与空白对照组和阴性对照组比较,miR-130a 抑制物组细胞相对荧光强度降低。
2.4 3组HPASMC中Wnt1、β-catenin蛋白表达的比较结果见图1和表1。可知,与空白对照组和阴性对照组比较,miR-130a抑制物组HPASMC中Wnt1和β-catenin蛋白表达水平升高。

表1 3组HPASMC中miR-130a表达水平、相对荧光强度、Wnt1和β-catenin蛋白表达水平的比较
*:与其他2组比较,P<0.05
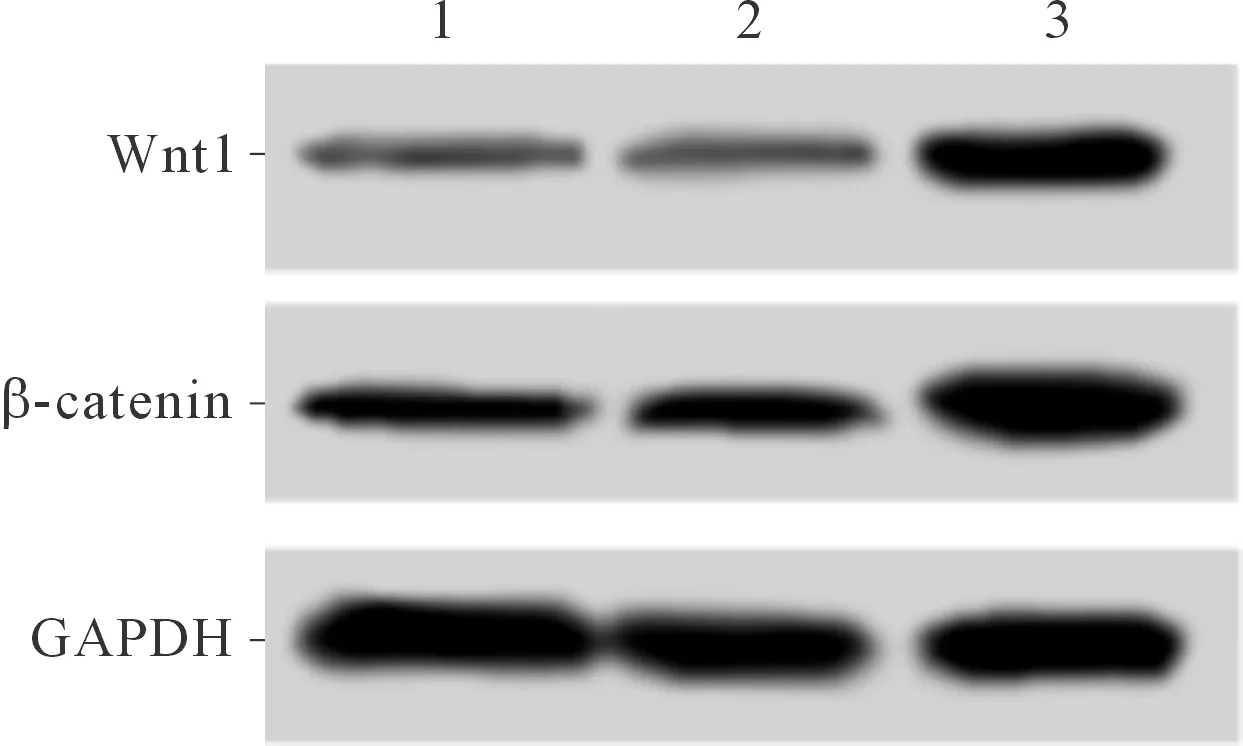
1:空白对照组;2:阴性对照组;3:miR-130a抑制物组
3 讨论
诱发肺动脉高压发病的因素多而复杂,其中缺氧是重要原因[5]。目前主要通过观察缺氧对HPASMC增殖、迁移、凋亡、分泌等生物学过程的影响研究其发病机制[6]。近期研究[2-3]表明miR-130a在CHD-PAH患者血浆中表达量升高,且参与肺动脉高压血管重构,提示miR-130a与先天性心脏病肺动脉高压有关。miR-130能够增强缺氧诱导的小鼠平滑肌细胞的增殖,参与肺动脉高压的右心室肥厚和血管重塑的发展[7]。本研究结果显示,在CHD-PAH患儿血清中miR-130a的表达水平显著高于CHD-norPAP患儿,且缺氧诱导的HPASMC中miR-130a的表达水平显著高于常氧条件下培养的细胞,与上述研究结果一致。本研究结果还显示,下调miR-130a的表达能够抑制HPASMC增殖,提示miR-130a可能通过调控HPASMC的增殖参与先天性心脏病肺动脉高压的发病过程。
目前研究[8]显示,Wnt信号通路的异常将会导致多种癌症、心血管疾病等的发生。β-catenin作为Wnt信号通路中核心效应分子,其表达水平的上调可启动和激活下游靶基因的表达,诱导多种生物学过程的发生。有报道[9]指出,Wnt/β-catenin信号通路参与HPASMC的表型转化、异常增殖和迁移等过程。Wnt信号传导途径的缺失是遗传性和特发性肺动脉高压中的常见分子缺陷[10-11]。miR-130a通过调控Wnt/β-catenin、NF-κB/PTEN等多种信号通路抑制多种肿瘤细胞的增殖[12]。上调的miR-130a通过调节顺铂处理的肝癌细胞中RUNX3和Wnt信号传导通路增加顺铂耐药性[13]。本实验结果显示,抑制miR-130a的表达能够促进Wnt1和β-catenin蛋白的表达,提示下调miR-130a的表达能够通过上调HPASMC中Wnt1和β-catenin蛋白的表达水平诱导Wnt信号通路的激活。以上结果说明miR-130a能够通过调控Wnt信号通路抑制缺氧诱导的HPASMC的增殖。
综上,在缺氧诱导的HPASMC中抑制miR-130a的表达可以抑制HPASMC的增殖,其作用机制与调控Wnt信号通路的激活有关。
