硝镁法制吉纳过程中物料热稳定性分析
2019-12-02周鹏朱伊娜陈利平陈网桦
周鹏 朱伊娜 陈利平 陈网桦
摘 要:硝镁法合成吉纳的过程中存在很高的反应热失控风险。为了进一步辨识并降低这种风险,对反应过程中物料的反应进程及热稳定性进行了研究。在实验室规模下通过两种不同的路径合成了吉纳,利用傅里叶变换红外光谱仪研究了反应过程中反应体系官能团的变化情况,并得到了各步反应的反应方程式。利用差示扫描量热仪(DSC)测试了各阶段产物的热稳定性,发现在两种合成路径中反应体系的热稳定性都较差,且发现吉纳合成过程中最不稳定的反应阶段为发烟硝酸与二乙醇胺的酯化产物体系,其起始分解温度最低在70 ℃左右,比放热量为1 500 J/g。提出了通过混合加料的方式来合成吉纳,这种方法一方面可以使反应在较低的温度下平稳进行,另一方面可以降低物料在不稳定状态下存在的时间。
关 键 詞:吉纳;合成路径;热稳定性;混合加料
中图分类号:X937;TQ226.1 文献标识码: A 文章编号: 1671-0460(2019)10-2292-06
Abstract: In order to understand the thermal runaway risk of the reaction in the process of synthesizing DINA by the magnesium nitrate method, the variation process and thermal stability of the materials in the reaction process were studied. DINA was synthesized by two different paths in the laboratory scale, and the Fourier transform infrared spectrometer was used to study the change of the functional group of the reaction system during the process. The reaction equation of each step was obtained according to the results of FTIR. The thermal stability of the products at each stage was tested by differential scanning calorimetry (DSC) ,and it was found that the thermal stability of the reaction system was poor in both two synthetic routes. The most unstable substance in the synthesis of DINA was the esterification product of fuming nitric acid and diethanolamine(DEA), whose initial decomposition temperature was about 70 °C and the specific heat release was around 1 500 J/g. In addition, a mixed feed method was proposed to synthesize DINA that can both conduct the reaction at a lower temperature and improve the thermal stability of the reaction system.
Key words: DINA; Path; Thermal stability; Mixed feed
N-硝基二乙醇胺二硝酸酯,又称吉纳(DINA),是一种出现较晚的猛炸药。作为硝化棉的不挥发胶化剂(高能增塑剂),吉纳在双基推进剂中有着广泛的应用 [1]。吉纳熔点低(49.5~51.5 ℃),160 ℃时开始分解,180 ℃时剧烈分解,72 ℃时Abel测试值可达60 min[2,3]。根据这一特点,含有吉纳的双基推进剂可以在更高的温度下加工[4]。1995年,马玉英[3]研究了吉纳在双基推进剂中的应用,以及一些因素对双基推进剂配方和性能的影响。2011年,皮文丰等[1]研究了吉纳作为高能增塑剂对双基推进剂燃烧性能调节的影响。2017年,张军等[5]对吉纳热分解的特点和动力学进行了深入研究。然而,上述研究都只考虑了吉纳及其在应用中的性能特征,对于吉纳合成过程中相关物料的热安全性几乎没有涉及。
吉纳的制造方法有醋酸酐法和硝镁法两种[6]。其中,硝镁法制吉纳是以二乙醇胺(DEA)、发烟硝酸和轻质氧化镁为原料,经二乙醇胺羟基的硝酸脂化和氨基的硝化得到吉纳[7]。根据氧化镁的加料顺序不同,有两种不同合成路径。
反应方总方程式如图1所示。
显然,吉纳的合成涉及硝化反应。一般说来,硝化反应放热量大,机理复杂。此外,由于吉纳是典型含能材料,因此,该合成过程还存在分解放热量大、产气产热迅速等特点。定性看来,吉纳合成过程一旦出现反应失控,则相应的热风险高。因此,对该合成过程中相关物料的热稳定性进行研究,分析合成过程中的危险步骤,对于充分理解吉纳合成反应的危险特性具有重要意义,同时也有助于反应过程的本质安全化设计。
1 实验部分
1.1 吉纳合成实验
参考文献[6,7],通过两种合成路径合成吉纳,各物料质量比如下:
二乙醇胺∶轻质氧化镁∶发烟硝酸∶氯化钠=1∶0.5∶5∶0.042。
合成路径1:以发烟硝酸为底料,不超过50 ℃条件下加入轻质氧化镁,升温并在55 ℃附近条件下加入二乙醇胺,最后升温至60 ℃加入氯化钠,并控制65 ℃附近保温20 min使反应完全;
合成路径2:以发烟硝酸为底料,在加35~40 ℃条件下加入二乙醇胺,再加入轻质氧化镁,最后升温至60 ℃加入氯化钠,并控制65 ℃附近保温20 min使反应完全。
两种合成路径产物后处理的方式相同:将反应产物倒入冷水中,水洗并结晶析出,再用pH为8的碳酸氢钠溶液进行高温碱煮后冷却结晶、过滤并在35 ℃环境下将产物烘干8~10 h得到最终产物,利用HPLC对最终产物中吉纳纯度进行测量[8]。
1.2 红外光谱分析
红外光谱分析是化学领域常用的一种分析手段,广泛用于未知化合物的结构鉴定[9]。仪器参数如下:
测试范围:4 000~400 cm-1;
分辨率:4 cm-1。
测试样品和测试条件:二乙醇胺、纯品吉纳以及两种合成路径中各阶段产物室温下的固体组分,每次取样在加料结束后等待一段时间且体系温度稳定之后进行。采用扫描前空白为背景,扫描次数为32次。通过对比分析原料、各部分中间产物以及产物的红外谱图,研究反应过程中物质结构变化规律。
1.3 DSC试验
差示扫描量热仪(DSC)是一种流行的热分析仪器,它可用于研究材料特别是含能材料的热稳定性和分解特性。
取样方法:合成路径中各阶段产物混合体系,每次取样在加料结束后等待一段时间且体系温度稳定之后进行。与红外光谱测试的取样方法相比,DSC测试所取的样品除了含有常温下体系中固态组分,还包含液态组分,以保证所取样品能代表反应体系。
测试条件:样品池均为高压镀金坩埚(30μL),耐压15 MPa。高纯氮(99.999%)作为保护气体(200 mL·min-1)和吹扫气体(50 mL·min-1)。被测样品质量在1~2 mg之间,在30~300 ℃的温度下以10 ℃·min-1的升温速率进行测试。
2 结果与讨论
2.1 吉纳合成实验
两组实验分别按照不同的合成路径来合成吉纳。通过路径1合成吉纳的过程中,在轻质氧化镁加料结束阶段,体系黏度较大,烧杯壁有“挂蜡”现象。升高温度并加入二乙醇胺之后,体系黏度下降,挂蜡现象消失。通过路径2合成吉纳的过程中没有挂蜡现象产生。以50 g发烟硝酸为底料,反应得到产物质量及纯度如表1所示。
显然,两种合成路径都能够得到纯度较高的吉纳,其中第一种合成路径的产率较高。
2.2 红外实验结果与分析
取合成路径中各阶段产物进行红外分析实验,以编号A、B分别代表合成路径1发烟硝酸和氧化镁中依次加入二乙醇胺和氯化钠之后且反应完全的体系;以编号C、D、E分别代表合成路径2发烟硝酸中依次加入二乙醇胺、氧化镁和氯化钠之后且反应完全的體系。
红外检测结果见图2。
根据一些学者对40种以上硝酸酯红外光谱的研究成果,得到如下表征硝酸酯的振动频率[10]。结合红外实验结果,分析得到的结果见表2。
由表2红外特征峰信息可知,样品A、C与D结构相似,样品B与E成分类似。和二乙醇胺相比,A、C、D在3 300 cm-1 附近仲胺的N—H键和O—H键的吸收峰消失,与此同时,可观察到这三个样品生成了O—NO2,但却没有观察到N—NO2的特征吸收光谱。样品B、E在样品A、C、D的基础上在1 515 cm-1处出现了吸收峰,此峰为N—NO2的吸收峰,说明样品B、E和产物吉纳一样,已经生成了N—NO2。
因此,在设定工艺条件下,将二乙醇胺加入发烟硝酸中,其氨基和羟基都发生了反应,其中羟基直接与发烟硝酸脂化生成了硝酸酯,仲胺的氨基消失,但没有生成N—NO2;加入轻质氧化镁之后,轻质氧化镁与体系中硝酸反应并与水分结合生成Mg(NO3)2·n H2O,但同样未能生成N—NO2。需要注意的是,反应开始后,叔胺氨基消失,但并没有直接被硝化,很可能生成了某种中间体。由于硝化反应机理的复杂性,尚无法利用红外手段检测中间体的具体结构,此处用R来表示这种未知基团。加入氯化钠并升温之后,二乙醇胺中的氨基才开始被硝化,生成了吉纳。具体的反应过程如图3。
2.3 DSC试验
根据张军等对纯品吉纳热分解规律的研究可知,纯品吉纳在10 K/min的升温速率条件下,起始分解温度为189.6 ℃(选取偏离基线的温度,下同),峰温为213 ℃,比放热量为3 288 J/g[5]。通过比较纯品吉纳与硝镁法制吉纳过程的各步产物的分解特性,进一步分析吉纳合成过程体系的热稳定性变化。
2.3.1 合成路径1阶段产物热稳定性研究
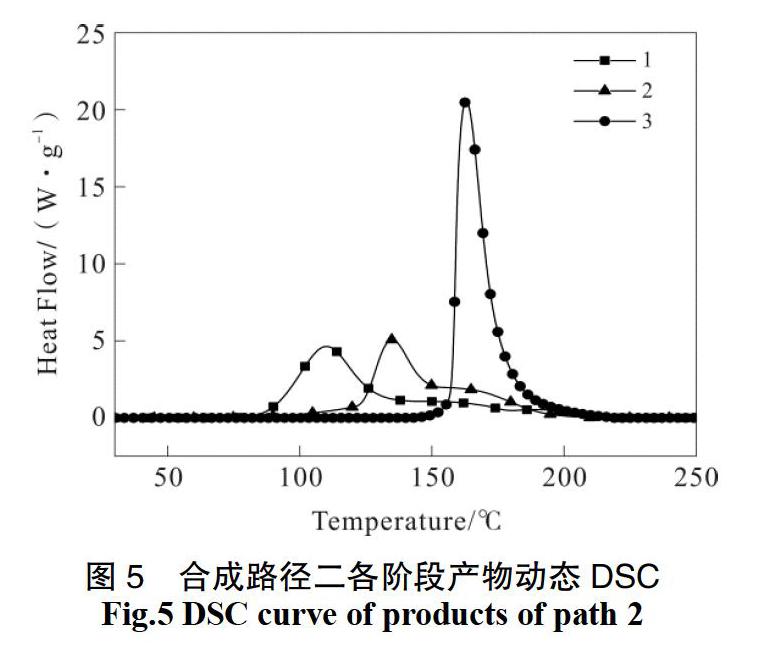
通过合成路径1进行合成吉纳,以编号1、2、3分别代表发烟硝酸中依次加入轻质氧化镁、二乙醇胺和氯化钠之后并反应完全的反应体系。DSC测试结果如图4。
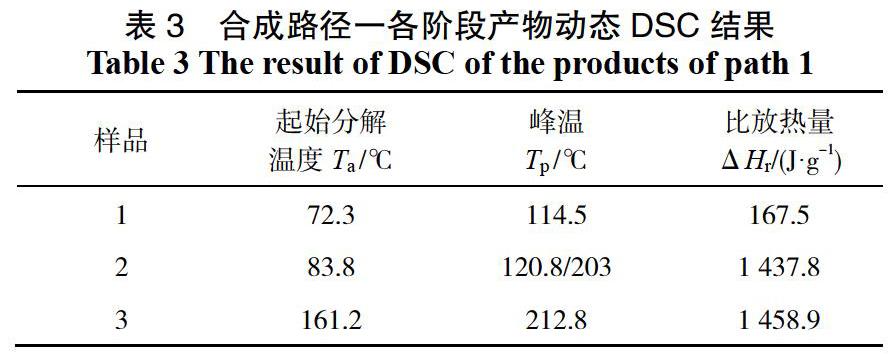
对DSC结果进行分析,结果见表3。
样品1是轻质氧化镁与发烟硝酸的混酸体系,体系内主要物质应为硝酸、硝酸镁等。根据DSC的测试结果,可知体系在73 ℃之后开始有微小放热,峰温在110 ℃附近,此峰可能是由于体系内硝酸的分解引起的,这与文献[11]的结论一致。
加入氯化钠并升温反应后得到最终的反应体系样品3,样品3的起始分解温度为161.2 ℃,放热迅速且较为集中。结合红外检测结果和样品DSC的出峰位置,可以判断样品3主要成分为吉纳。
样品2从83 ℃附近开始有明显放热,放热峰较宽,由有多个放热峰耦合而成,其中有两个峰比较明显。第二个峰的峰温203 ℃,与产物体系的放热峰温较接近,因此判断是产物的分解。鉴于红外分析结果显示,在加入二乙醇胺之后会生成一个未知的中间产物,所以判断第1个放热峰包含中间产物的分解,同时考虑到体系中含有硝酸、硝酸镁等物料,所以应该还包含硝酸分解,以及反应混合物在升温后继续发生硝化反应的放热。
在合成路径1中,二乙醇胺加料阶段体系温度为55 ℃,通过DSC结果发现该阶段产物的起始分解温度为83.8 ℃,这说明在此阶段,体系处于一个热失控风险非常高的状态。
2.3.2 合成路径2各阶段产物热稳定性研究
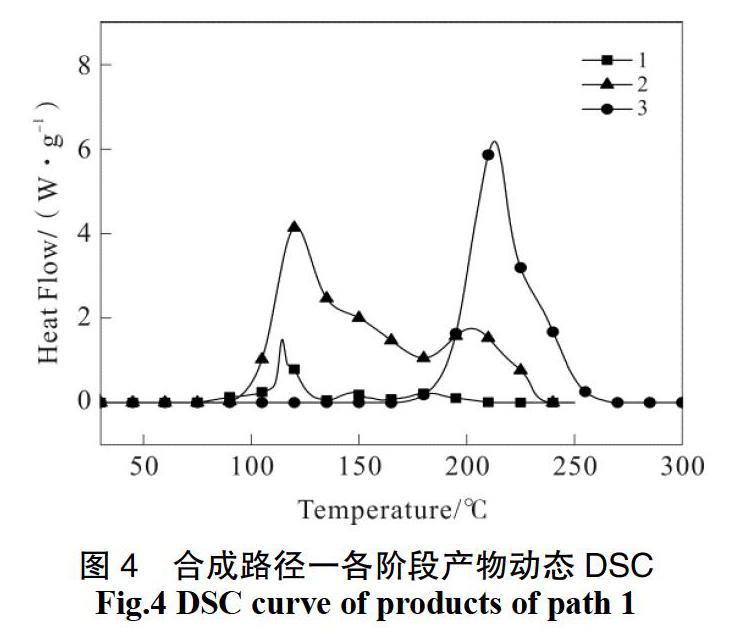
通过合成路径2中进行吉纳合成实验,以编号4、5、6分别代表发烟硝酸中依次加入二乙醇胺、轻质氧化镁和氯化钠之后且反应完全的反应体系。DSC测试结果如图5。
对DSC结果进行分析,结果见表4。
样品4为二乙醇胺与发烟硝酸的反应体系,体系热稳定性较差,起始分解温度为74.3 ℃,并且持续到200 ℃体系都有放热。同时可以观察到在纯品吉纳分解放热位置,该样品的放热不明显。因此判断即使在较高温度下,仅有发烟硝酸和二乙醇胺难以反应生成吉纳。
上述反应体系加入氧化镁反应之后,得到样品5。结合红外分析结果,可以判断轻质氧化镁的加入体系的有机组分即主要放热物质没有发生改变,样品4、5的放热峰形很接近也可以说明这一点。但样品5的起始分解温度要明显高于样品4,这说明氧化镁的加入使得反应体系的稳定性上升。有研究结果表明,硝酸体系中,体系起始反应温度随硝酸浓度的降低或随产物浓度的升高而增加[12]。因此,造成这一结果可能是因为在加入氧化镁之前,体系中硝酸所占比例更高。
样品6在142 ℃开始分解,放热迅速且较为集中,体系分解的比放热量为1 688.4 J/g。样品3与样品6体系内主要成分都是吉纳,但是两者的出峰位置与峰形差别都比较大。推测这一结果可能是由于吉纳在体系内的含量差异、反应混合物组成差异等因素引起的,样品3中吉纳的含量要远高于样品6,因此其硝酸含量较低,起始温度会相对升高。
结合反应体系的起始分解温度和比放热量,不考虑硝酸分解的前提下,吉纳的两种合路径中体系的最不稳定及分解放热量最大的物料都是在二乙醇胺的加料结束阶段。
3 新的加料方式
合成路径1中,在轻质氧化鎂的加料结束阶段,由于生成的硝酸镁浓度过高,容易在釜内析出固体,产生挂蜡现象,不利于反应的传热传质。为解决这一问题,可提高加入二乙醇胺阶段的反应温度,进而提高硝酸镁在体系中的溶解度。但是DSC结果显示,反应体系在反应过程不稳定,因此提高反应温度不利于反应的安全。而对于合成路径2,二乙醇胺与发烟硝酸反应体系热稳定性较差,进一步提高反应体系的稳定性尤为重要。
显然,两种方法各有不足。如果二乙醇胺和轻质氧化镁同时加入,一方面可以解决硝酸镁加料阶段挂蜡问题,另一方面二乙醇胺与发烟硝酸的初步不稳定产物体系可以快速被转化为较稳定的体系。但是这会导致反应过程的放热更加集中,不利于控制反应的平稳进行。为此,考虑将二乙醇胺和轻质氧化镁等分为几份后轮流加入,最后升温并加入氯化钠。
这里将物料等分为三份轮流加入进行实验,并对过程中各阶段产物的热稳定性进行了测试。以编号a、b、c、d、e、f、g分别代表每次加料之后且反应完全的反应体系,其中a代表加入第一次加入三分之一二乙醇胺之后的反应体系,b代表第一次加入三分之一轻质氧化镁之后的反应体系,以此类推,g代表加入氯化钠之后的最终产物体系。得到的DSC结果如图6。
对DSC结果进行分析,结果见表5。
正如之前预料,样品加入二乙醇胺之后的a、c、e的起始分解温度都低于加入轻质氧化镁的b、d、f的起始分解温度,这表明加入轻质氧化镁确实可以提高二乙醇胺与发烟硝酸反应体系的起始分解温度。从放热量角度而言,随着反应进行产物越来越多,其放热量也就越来越大。
比较上述7个样品,发现这些样品的放热峰温主要集中在110 ℃、130 ℃和150 ℃这3个位置附近,与合成路径二中各阶段产物的放热峰位置接近。表明在这种加料方式下,其反应机理并没有发生变化。此外,在混合加料合成吉纳的实验过程中,没有固体析出造成挂蜡现象。这种加料方式合成吉纳得到最终产率在75%左右,在上述两种合成方法产率之间。
4 结 论
在吉纳的合成过程中,二乙醇胺与发烟硝酸能快速发生羟基的脂化反应,加入氧化镁并没有直接促进反应的进一步进行,加入氯化钠之后其氨基才开始被硝化。
DSC实验显示,吉纳合成过程中的中间产物起始分解温度低且比放热量大,热稳定性要远低于纯品吉纳。因此,在合成路径一中通过提高反应温度来减少反应过程中的挂蜡现象,将增加了反应过程中体系热失控的风险。
对于反应路径一,反应体系在加入二乙醇胺之后起始分解温度较低,其中二乙醇胺与发烟硝酸反应体系的热稳定性最差;而路径二中物料最不稳定阶段为二乙醇胺的加料后,该物料体系在10 ℃·min-1的DSC实验中,70 ℃附近就开始放热,且比放热量较大。
最后本文提出的新的混合加料的方式,这种加料方式一方面可以使二乙醇胺与硝酸快速发生酯化反应生成水,增加硝酸镁在体系中的溶解度,从而避免挂蜡现象的出现;另一方面轻质氧化镁的加入会促进二乙醇胺与发烟硝酸反应体系的转变,得到更为稳定的反应体系。
参考文献:
[1]皮文丰, 宋秀铎, 张超,等. 一种非铅双基推进剂燃烧性能调节[J]. 含能材料, 2011, 19(4):405-409.
[2]A. Ksi??czak, M. Ostrowski, W. Tomaszewski. Thermochemistry of the binary system nitrocellulose+N-nitrodiethanolamine dinitrate[J]. Journal of Thermal Analysis & Calorimetry, 2008, 94(1):275-279.
[3]马玉英. 硝化二乙醇胺对双基推进剂性能的影响[J]. 含能材料, 1995 (2): 31-36.
[4]Zayed MA, Soliman AAW, Hassan MA. Evaluation of malonanilides as new stabilizers for double base propellants (I). J Hazard Mater., 2000;73:237–44.
[5]Zhang Jun, Xue Beibei, Rao Guoning, et al. Thermal decomposition characteristic and kinetics of DINA[J]. Journal of Thermal Analysis & Calorimetry, 2017(4):1-9.
[6]任特生. 硝胺及硝酸酯炸药化学与工艺学[M]. 北京:兵器工业出版社, 1994.
[7] 陈振潮, 陈嘉琨, 张信学. DINA连续化生产线的设计[J]. 南京理工大学学报, 1982 (2): 97-108.
[8]王恩琪, 李佩芳, 张国安. HPLC测定缓燃药中三醋精(TA)、吉纳(DINA)及二号中定剂(C_2)[J]. 南京理工大学学报, 1986 (2): 137-144.
[9] 唐學红, 肖先举. 高效液相色谱-质谱联用技术在药物分析中的应用[J]. 当代化工, 2011, 40(9):988-990.
[10]许妍. 三种硝酸酯的热安定性研究[D]. 南京理工大学, 2007.
[11] 陈利平. 甲苯硝化反应热危险性的实验与理论研究[D]. 南京理工大学, 2009.
[12]曹智, 卞晓艳, 晏太红,等. 微量热法研究硝酸体系中N,N-二甲基羟胺的热稳定性[J]. 核化学与放射化学, 2016, 38(6):347-352.
