Ag/CeO2-Al2O3催化剂的制备及催化氧化甲醛性能研究
2019-12-02周学凤卢素红郑一鸣贺路路刘彦雄庞凡爵彭博陈玉亮
周学凤 卢素红 郑一鸣 贺路路 刘彦雄 庞凡爵 彭博 陈玉亮

摘 要:以Al2O3和CeO2-Al2O3載体,制备了x% Ag/CeO2-Al2O3(x=0.5%、1%和2%)催化剂,并用于催化氧化甲醛。研究发现:Ag的含量对催化剂催化氧化甲醛性能的影响显著,当Ag为1%时,催化剂1% Ag/CeO2-Al2O3在60 ℃可以将甲醛完全氧化成H2O和CO2。H2-TPR和O2-TPD表征揭示:催化剂的低温还原能力和丰富的表面活性氧物种提高了催化剂催化氧化甲醛的性能。
关 键 词:催化氧化;甲醛;Ag;CeO2-Al2O3
中图分类号:TQ 032.41 文献标识码: A 文章编号: 1671-0460(2019)10-2261-04
Abstract: A series of x% Ag/CeO2-Al2O3 catalysts with different loading amounts of Ag (x=0.5%, 1% and 2%) were prepared by wet impregnation method and tested for catalytic oxidation of formaldehyde (HCHO). The catalysts were characterized by BET, H2-TPR and O2-TPD. The results demonstrated that 1% Ag/CeO2-Al2O3 showed excellent catalytic activity, HCHO was completely oxidized to H2O and CO2 at 60 oC. It was found that good low temperature reducing ability and abundant surface oxygen species of 1% Ag/CeO2-Al2O3 catalyst served as essential roles in the catalytic removal of HCHO.
Key words: Catalytic oxidation; Formaldehyde; Ag; CeO2-Al2O3
室内甲醛污染主要来源于家具、装修、装饰材料,其释放期一般为8~15 a。2004年,世界卫生组织发布的153号公告中明确指出——甲醛致癌。室内甲醛污染引起的白血病、胎儿畸形事件屡见报道。甲醛污染已经成为严重危害人类健康安全的“隐性杀手”,对人们造成了巨大的经济损失甚至生命安全事故,健康隐患步步惊心。因此,净化室内甲醛污染刻不容缓。
传统用于净化室内甲醛的方法主要有吸附法[1]、光催化法[2]、低温等离子法[3]以及催化氧化法[4,5]。吸附技术是采用活性炭和分子筛等高比表面积材料吸附甲醛,虽已达到净化空气的目的,但吸附材料的吸附能力有限,需定期再生或者更换,易产生二次污染。光催化技术对于净化室内空气具有良好的应用前景,但需要紫外激发光源,常伴随有CO、O3、HCOOH等有毒的物质生成。低温等离子体技术处理甲醛具有处理速度快、处理量大、反应完全等优点,但在对空气放电过程中容易产生氮氧化物及臭氧等二次污染。催化氧化技术利用空气中的O2在催化剂作用下来氧化甲醛,彻底地将甲醛生成无害无毒的H2O和CO2,达到净化空气的目的,具有室温下可以使用、无需热源和光源、节约能耗、无二次污染等优点,是净化甲醛最具有应用前景的方法[6]。
催化氧化法净化甲醛的核心是研究低温甚至室温可以将甲醛分解成的H2O和CO2的催化剂。目前,用于净化室内甲醛的催化材料主要是过渡金属氧化物[7-9](如MnOx、Co3O4、CeO2等的单一或复合氧化物)和贵金属负载型催化剂[10-12](如Pt、Au、Pd等的单一或双金属)。过渡金属氧化物资源丰富,价格相对较低,但不足之处在于催化活性相对较低,起燃温度较高;贵金属负载型催化剂具有较高低温甚至室温的活性,但活性组分容易烧结,资源短缺,价格昂贵。研究表明,相对廉价的Ag催化剂在催化净化室内甲醛表现出较好的低温催化反应活性,但是甲醛完全转化温度高于100 ℃。例如Ag/MnOx-CeO2完全氧化甲醛的温度分别为100 ℃[13]。因此,研究和开发制备高性能Ag基负载型纳米催化剂显得异常重要。
本文制备了系列Ag/CeO2-Al2O3催化剂,并用于催化氧化甲醛反应,采用BET、H2-TPR和O2-TPR技术表征了催化剂的结构。
1 实验部分
1.1 催化剂制备
1.1.1 CeO2-Al2O3载体的制备
(1)称取3.00 g聚氧乙烯-聚氧丙烯-聚氧乙烯(P123),溶解在60 mL乙醇中,持续搅拌1 h后,加入入4.5 mL HNO3,得到溶液Ⅰ。
(2)称取5.63 g异丙醇铝和1.04 g硝酸铈铵加入到溶液Ⅰ中,搅拌5 h后得到溶液Ⅱ。
(3)将溶胶Ⅱ在80 ℃干燥24 h,600 ℃焙烧4 h,升温速率为1 ℃/min。
为了比较,采用同样的方法制备了Al2O3。
1.1.2 催化剂x% Ag/ CeO2-Al2O3的制备
称取一定量的CeO2-Al2O3载体加入40 mL去离子水,磁力搅拌30 min,将适量的AgNO3溶入40 mL去离子水中,用胶头滴管缓慢滴入到加有载体的蒸馏水中,磁力搅拌24 h后,将温度升到80 ℃,继续搅拌蒸干,之后80 ℃烘箱中干燥24 h,450 ℃下焙烧4 h。其中,Ag的百分含量分别为0.5%、1%、2%。
1.2 催化剂的表征
1.2.1 比表面积(BET)
样品的比表面积是在型号ASAP2020HD88的N2物理吸附仪上测得。
1.2.2 程序升温还原(H2-TPR)
将50 mg样品置于Φ=6 mm石英管中,H2/N2混合气吹扫样品走基线1 h,待基线稳定后由50 ℃程序升温至700 ℃,升温速率为10 ℃/min。采用TCD检测器检测氢气浓度的变化。
1.2.3 氧程序升温脱附(O2-TPD)
将60 mg样品置于Φ=6 mm石英管中,通入10% H2/N2由室温经升温至200 ℃保持1 h,切换He在200 ℃吹扫30 min,冷却至室温后通入21% O2/N2保持30 min,再切换He吹扫30 min,待基线稳定后采用升温速率为10 ℃/min由50 ℃程序升温至700 ℃。
1.3 催化剂活性评价
活性评价在固定床装置上进行,将50 mg的催化剂(40~60目)装入到内径为6 mm的反应管中,流速为30 mL/min的21% O2/N2将多聚甲醛分解出的甲醛带入反应管,在催化剂的作用下将甲醛转化成CO2和H2O。反应混合气的组成为150 ppm HCHO,21% O2/N2。原料反应气和尾气采用色谱仪在线分析,甲醛转化率为:
其中:[CO2]out是产物中CO2的浓度,[HCHO]in为进气中HCHO的浓度。
2 结果与讨论
2.1 催化剂的表征
2.1.1 BET
表1列出了载体CeO2-Al2O3和催化剂x% Ag/ CeO2-Al2O3的SBET、孔容、孔径数据。载体CeO2-Al2O3的SBET、孔容和孔径分别为286.2 m2·g-1、4.2 nm和0.459 cm3·g-1。Ag的加入,使催化剂x% Ag/ CeO2-Al2O3的SBET和孔容减小,孔径增加。原因可能是Ag颗粒堵塞了载体的微孔,相同的现象文献中也有报道[13]。
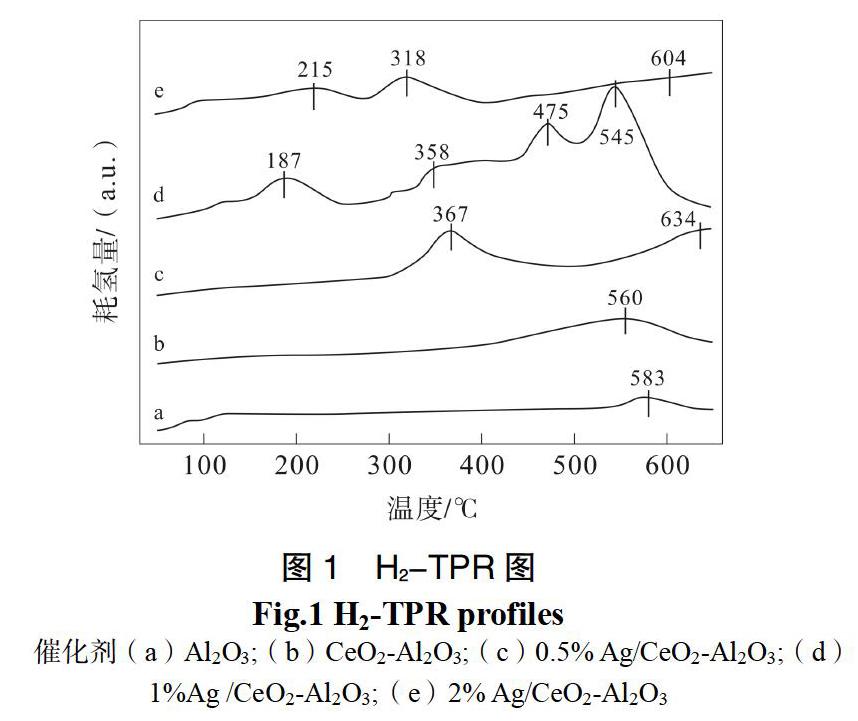
2.1.2 H2-TPR
图1是载体Al2O3、CeO2-Al2O3和催化剂x% Ag/ CeO2-Al2O3(x=0.5%、1%、2%)的H2-TPR图。载体Al2O3和CeO2-Al2O3在500~700 ℃出现的较弱的还原峰归属为表面氧物种的还原[14]。x% Ag/ CeO2-Al2O3催化剂在50~250 ℃出现的还原峰归属为氧化银物种的还原,300~500 ℃归属为表面氧物种的还原;500~700 ℃出现的还原峰来自于CeO2-Al2O3物相中氧物种的还原[15]。随着Ag质量百分含量的增加,催化剂Ag/ CeO2-Al2O3的还原峰越来越明显,表明Ag的存在促进了CeO2-Al2O3表面氧物种的还原。有文献报道,Ag物种的存在利于CeO2或Co2O3表面氧物种的还原[16,17];也有文献报道,Ag和载体间的相互作用促进了氧物种的迁移[18]。催化剂1% Ag/ CeO2-Al2O3还原温度较低表明该催化剂具有较强的还原能力,利于催化氧化甲醛,该结果与催化剂的性能测试一致(见图3)。
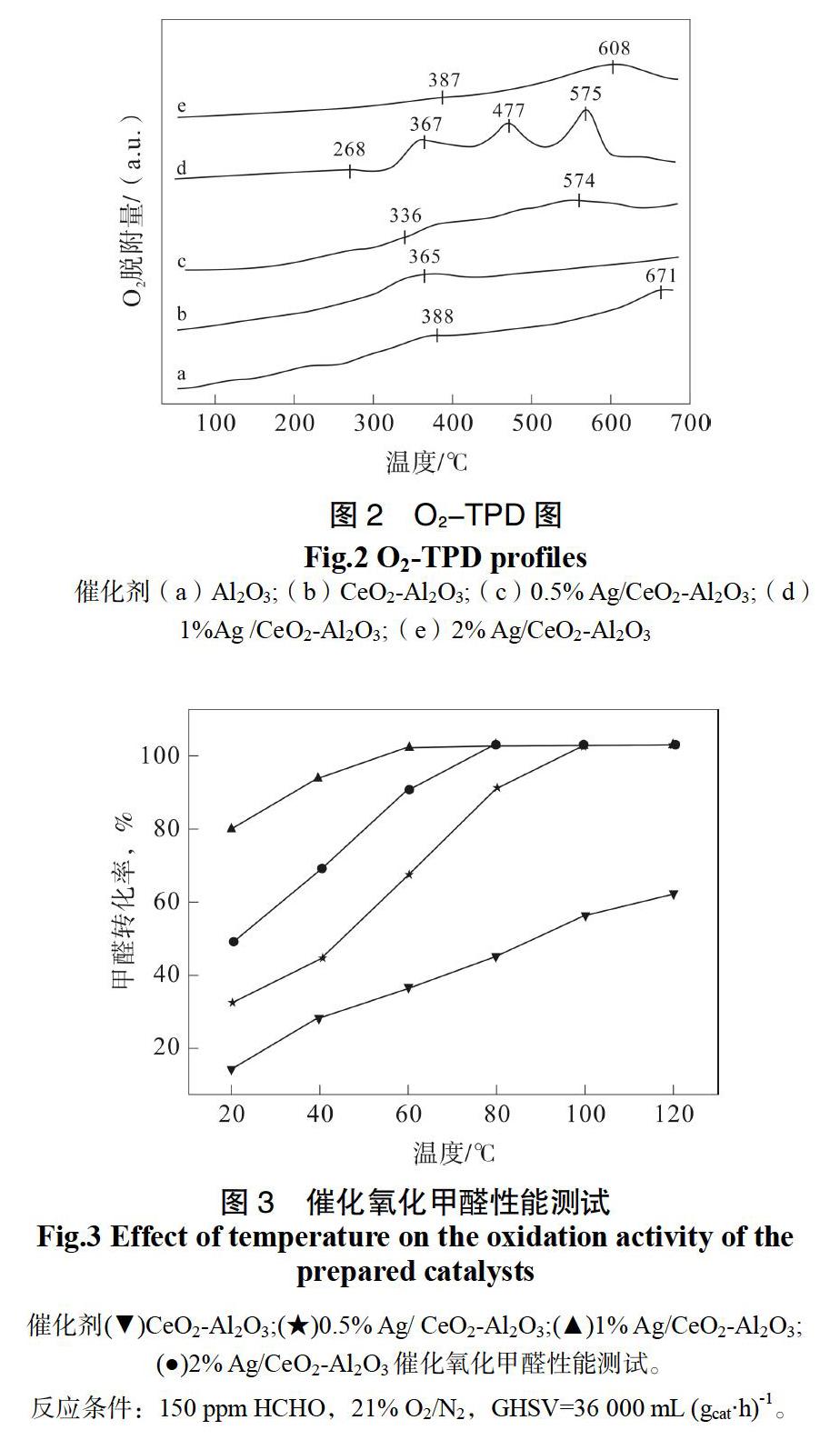
2.1.3 O2-TPD
图2是载体Al2O3、CeO2-Al2O3和x% Ag/ CeO2-Al2O3催化剂的O2-TPD图。文献中报道,氧物种脱附从易到难的顺序为:O2>O2->O->O2-[19],O2-和O-统称为表面活性氧物种,特别容易从金属氧化物表面脱附,一般脱附温度<500 ℃。O2-属于晶格氧(表面晶格氧和体相晶格氧),较难从金属氧化物催化剂中脱附,其脱附温度较高,一般脱附温度>500 ℃。图2中样品的O2-TPD曲线主要分为二个区域:50~500 ℃和500~700 ℃。由图2(a)可知,样品Al2O3在50~700 ℃温度区间内出现两个较弱的脱附峰,分别在388 ℃和671 ℃,归属为表面活性氧和表面晶格氧的脱附。样品CeO2-Al2O3在365 ℃出现一个微弱的氧气脱附峰,归属为表面活性氧物种的脱附。CeO2-Al2O3载体负载0.5% Ag后,有利于表面活性氧和表面晶格氧的脱附,温度分别出现在336 ℃和574 ℃。当Ag质量分数增大到1%时,氧气脱附峰分别出现在268、367、477和575 ℃,从图2(d)可以看出,该样品的氧脱附峰信号很强,说明样品中含有丰富的表面活性氧化物种。随着Ag负载量的增加,氧气脱附峰的温度分别向高温段移动,并且强度减弱,如1% Ag/ CeO2-Al2O3的氧气脱附峰出现在387和608 ℃。由此可知,Ag的质量百分含量对催化剂Ag/ CeO2-Al2O3中氧气的脱附影响很大,其中最佳的Ag负载量为1%,与H2-TPR表征结果一致。文献中报道[19,20],催化剂中表面活性氧物种在氧化反应中起到重要的作用,活性氧物种的脱附温度越低和脱附强度越强,催化劑性能越好。因此,催化剂1% Ag/ CeO2-Al2O3催化性能最好(见图3)。
2.2 催化剂的性能评价
图3是CeO2-Al2O3和x% Ag/ CeO2-Al2O3催化氧化甲醛的性能图,载体CeO2-Al2O3的催化性能较差,在120 ℃的转化率为59.2%。Ag的加入提高了催化剂的活性,当Ag的含量为0.5%时,催化剂0.5% Ag/CeO2-Al2O3在100 ℃可以将甲醛完成氧化成CO2和H2O;当Ag的含量为1%时,在60 ℃,催化剂1% Ag/CeO2-Al2O3可以将甲醛完全转化;当Ag的含为2%时,甲醛完全分解的温度为80 ℃。由此可见,Ag的含量对催化剂性能影响较大,当Ag含量为1%时,催化剂具有最好的催化性能。1% Ag/ CeO2-Al2O3具有较强的还原能力和丰富的表面活性氧物种,导致其具有优异的催化性能。
3 結 论
在制备的一系列x% Ag/CeO2-Al2O3催化剂中,1% Ag/CeO2-Al2O3表现出优异的催化氧化甲醛性能,在温度为60 ℃下可以将甲醛完全转化。表征结果表明1% Ag/CeO2-Al2O3催化剂的高活性与其具有较强的还原能力和丰富的表面活性氧物种紧密相关。
参考文献:
[1]Giraudet S, Boulinguiez B, Cloirec P L. Adsorption and electrothermal desorption of volatile organic compounds and siloxanes onto an activated carbon fiber cloth for biogas purification[J]. Energy Fuels, 2014, 28(6): 3924-3932.
[2] Zhu X B, Jin C, Li X S, et al. Photocatalytic formaldehyde oxidation over plasmonic Au/TiO2 under visible light: moisture indispensability and light enhancement[J]. ACS Catalysis, 2017, 7(10): 6514-6524.
[3] Yi H H, Yang X, Tang X L, et al. Performance and pathways of toluene degradation over Co/13X by different processes based on nonthermal plasma[J]. Energy Fuels, 2017, 31: 11217-11224.
[4] Zhang Z X, Jiang Z, Shangguan W F. Low-temperature catalysis for VOCs removal in technology andapplication: A state-of-the-art review[J]. Catalysis Today, 2016, 264: 270-278.
[5] Huang H B, Xu Y, Feng Q Y, et al. Low temperature catalytic oxidation of volatile organic compounds: a review[J]. Catalysis Science & Technology, 2015, 5(5): 2649-2669.
[6] Tan W, Deng J G, Xie S H, et al. Ce(0.6)Zr(0.3)Y(0.1)O2 nanorod supported gold and palladium alloy nanoparticles: high-performance catalysts for toluene oxidation[J]. Nanoscale, 2015, 7(28): 8510-8523.
[7] Wen Y R, Tang X, Li J H, et al. Impact of synthesis method on catalytic performance of MnOx-SnO2 for controlling formaldehyde emission[J]. Catalysis Communication, 2009, 10: 1157-1160.
[8]Bai B Y, Arandiyan H, Li J H. (2013) Comparison of the performance for oxidation of formaldehyde on nano-Co3O4, 2D-Co3O4, and 3D-Co3O4 catalysts[J]. Applied Catalysis B: Environmental, 2013, 142-143: 677-683.
[9] Tang X F, Li Y G, Huang X M, et al. MnOx-CeO2 mixed oxide catalysts for complete oxidation of formaldehyde: Effect of preparation method and calcination temperature[J]. Applied Catalysis B: Environmental, 2006, 62: 265-273.
[10]Zhang C B, He H, Tanaka K I. Perfect catalytic oxidation of formaldehyde over a Pt/TiO2 catalyst at room temperature[J]. Catalysis Communication, 2005, 6: 211-214
[11]Ma C Y, Wang D H, Xue W J, et al. Investigation of formaldehyde oxidation over Co3O4-CeO2 and Au/Co3O4-CeO2 catalysts at room temperature: effective removal and determination of reaction mechanism[J]. Environmental Science & Technology, 2011, 45, 3628-3634.
