延胡索乙素对乳鼠海马神经元缺氧缺糖损伤保护作用的研究
2019-12-02甘椿椿金湛汪琴猛陈高金美花
甘椿椿 金湛 汪琴猛 陈高 金美花


【摘 要】目的:探讨延胡索乙素对乳鼠海马神经元细胞因缺糖缺氧所致损伤的保护作用。方法: 建立乳鼠海马神经元细胞缺糖缺氧损伤模型。利用CCK法和预实验确定加药浓度后,将培养的细胞随机分成 6 组:正常组、模型组、延胡索乙素低、中、高治疗组(2、4、8 μg/mL )和阳性药物对照组尼莫地平(8 μg/mL)。观察延胡索乙素对乳鼠海马神经元乳酸脱氢酶(LDH)的释放量,细胞一氧化氮(NO)和丙二醛(MDA)含量,一氧化氮合酶(NOS)、超氧化歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-PX)活性的影响;采用流式细胞仪检测各组细胞的凋亡率。结果:与模型组相比,延胡索乙素中、高剂量组均能显著增加细胞内SOD以及GSH-PX的活性(P<0.01);能够显著减少细胞内LDH外漏以及抑制NOS的活性(P<0.01);能够显著减少细胞内NO以及MDA的生成量(P<0.01)。结论:延胡索乙素对乳鼠海马神经元细胞的缺糖缺氧损伤显示出良好的保护作用,其机制可能与抗氧化、抑制细胞凋亡有关。
【关键词】延胡索乙素;海马神经元;缺氧缺糖;抗氧化作用
【中图分类号】R285.5 【文献标志码】A 【文章编号】1007-8517(2019)19-0014-05
Abstract: Objective To investigate the protective effect of tetrahydropalmatine on the injury of suckling rat hippocampal neurons due to hypoxia and sugar deficiency. Methods To establish the model of hypoglycemic anoxic injury in suckling rat hippocampal neurons. CCK method and preliminary experiment were used to determine the drug concentration, the cultured cells were randomly divided into 6 groups: normal group, model group, low, medium and high tetrahydropalmatine treatment group (2, 4, 8 μg/mL) and positive control group nimodipine (8 μg/mL). To study the effect of tetrahydropalmatine on the release quantities of lactate dehydrogenase(LDH), nitric oxide(NO) and malondialdehyde (MDA) content, nitric oxide synthase(NOS), super oxide dismutase(SOD) and glutathione peroxidase(GSH-PX) activities in suckling rat hippocampal neurons; Cell apoptosis rate was detected by flow cytometry. Results Compared with the model group, the activity of SOD and GSH-PX in the cells were significantly increased in both middle and high dose groups (P<0.01). It could significantly reduce the intracellular LDH leakage and inhibit the activity of NOS (P<0.01). The productions of NO and MDA in cells (P<0.01) were reduced by tetrahydropalmatine; It could obviously inhibit early apoptosis of cells; the protein expression levels of caspase-3 and caspase-8 were suppressed by tetrahydropalmatine. Conclusion Tetrahydropalmatine showed a good protective effect on the hypoglycemic anoxia damage in suckling rat hippocampal neurons, and its mechanism may be related to anti-oxidation and inhibition of apoptosis.
Key words:Tetrahydropalmatine; Suckling Rat Hippocampal Neurons; Hypoxia and Sugar Deficiency; Anti-oxidation
缺血性腦血管病为临床常见的神经系统疾病,约占脑血管疾病的85%,其病死率仅次于心脏病、肿瘤,是造成人类死亡的主要疾病之一[1]。研究发现,脑缺血后大部分血管能自然再通或经溶栓治疗恢复再通,但同时也会造成进一步脑损伤和功能障碍,即脑缺血再灌注损伤[2]。许多研究证明,很多中药中的有效成分对防治脑缺血损伤具有良好的疗效,可通过调控脑缺血损伤的相关信号通路,减少炎症级联反应等方式减少脑缺血再灌注损伤。
海马结构正常和功能完整是人类学习记忆的基础,海马神经元损伤与脑卒中认知功能障碍的发病密切相关[3]。在脑缺血再灌注损伤中,海马神经元是中枢神经系统中最易受累的脑区,对于缺血缺氧最为敏感,对缺血缺氧的耐受性差。取乳鼠海马神经元体外培养,既可重现其体内生长过程,也易于使用各种技术检测相关指标,能够直观反映药物治疗脑缺血再灌注损伤的效果,因此乳鼠海马神经元细胞是体外研究脑缺氧缺血再灌注损伤常用的模型[4]。
延胡索为罂粟科植物延胡索的干燥块茎,具有活血、利气、止痛的功效,临床常用于胸胁、脘腹胀痛、经闭痛经、产后瘀阻和跌打肿痛等[5]。延胡索乙素作为延胡索的主要有效成分之一,在药材以及制剂中常作为控制指标。已有研究证明延胡索乙素对中枢神经系统和心脑血管都有一定的预防和保护作用[6]。延胡索的中药复方制剂有很多,例如玄归止痛滴丸、玄胡索散等,均有活血止痛的作用,但是关于脑缺血的研究未见报到,笔者以体外乳鼠海马神经元细胞为研究对象,探讨延胡索乙素对乳鼠海马神经元细胞因缺糖缺氧所致损伤的保护作用,为进一步开发延胡索及其复方制剂抗脑缺血研究提供一定的实验依据。
1 仪器与材料
1.1 仪器 DMI4000B荧光倒置显微镜(德国徕卡公司),LDZ5-2型低速自动平衡离心机(北京京立离心机有限公司),Molecular Devices SpectraMAX Plus 384酶标仪(美国MD公司)。
1.2 药品与试剂 DMEM/F12培养基、胎牛血清、胰蛋白酶(Gibco公司);BCA (bicinchoninic acid)蛋白浓度测定试剂盒,超氧化物歧化酶(super oxide dismutase,SOD)、谷胱甘肽过氧化酶(glutathione peroxidase,GSH-PX)、乳酸脱氢酶(lactate dehydrogenase,LDH)、一氧化氮合酶(nitric oxide synthase,NOS)、丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide,NO)试剂盒(南京建成生物工程研究所)。
1.3 动物 SD乳鼠,雌雄兼用,1~3日龄,由浙江中医药大学动物实验研究中心提供,许可证号SCXK(沪) 2008-0016(上海西普尔必凯实验动物有限公司)。
2 方法
2.1 海马神经元的培养[7] 取新生24 h的乳鼠放进75%乙醇内浸泡消毒,在无菌条件下分离出双侧海马,充分剪碎,加入同体积0.25% 胰蛋白酶消化20 min,用含10% 胎牛血清的DMEM/F12完全培养基终止消化,处理后放入37 °C、5 % CO2培养箱中培养,于24 h后全量换液(置换后的培养液由97% Neurobasal,2% B27,1% L-谷氨酰胺组成),之后每3天半量换液。在海马神经元细胞接种3 d后加入终浓度为10 μmol/L的阿糖胞苷,以抑制非神经元细胞生长。培养8 d后建立海马神经元缺氧缺糖细胞模型,并检测相关指标。
2.2 实验分组以及配药 经过CCK-8(Cell Counting Kit-8)法确定延胡索乙素浓度在0~100 μg/mL内是非细胞毒剂量。取培养8 d生长成熟的海马神经元细胞,分为正常组、模型组、延胡索乙素低、中、高剂量组(2、4、8 μg/mL)、阳性对照药尼莫地平组(8 μg/mL)。按照上述比例配置所需各浓度药物,除正常组加入无糖DMEM/F12完全培养基外,其余各组均采用无糖Earles培养基与相应浓度的药物配置。
2.3 乳鼠海马神经元细胞缺氧缺糖模型的建立 取培养8 d生长成熟的海马神经元细胞,按1×106个/mL的密度接种于6孔板,随后将原培养液吸出,以PBS洗涤两次,加入含有相应浓度药物的无糖Earles培养基,除正常组外,其余各组均放置于缺氧装置中,持续通入包含95%氮气和5%二氧化碳的混合气体,直至充满装置,封口膜密封,放入37 °C恒温箱孵育4 h。4 h后取出,在倒置显微镜下观察每组细胞形态。
2.4 生化指标的测定 按照“2.3”所述方法建立海马神经元细胞缺氧缺糖模型,随后取各组细胞上清液,同时收集各组细胞并破碎,采用BCA法检测蛋白含量。按照各试剂盒说明书,检测细胞上清液中LDH含量以及各组细胞中SOD、GSH-PX、NOS活性和NO、MDA等生化指标含量。
2.5 细胞早期凋亡率的测定 将培养8 d生长成熟的海马神经元细胞,以0.25% 胰酶消化,制成细胞悬液,以3×105个/mL密度接种到12孔板,每孔终体积0.75 mL,分组情況同“2.2”项分组方法一致,每组设3个复孔,0.25% 胰酶消化收集各组细胞,PBS洗两次,细胞密度调整为1×106个/mL。试管中加入100 μL细胞悬液。加入Annexin V-FITC/PI染料各5 μL后,轻轻混匀,室温避光放置15 min,最后各试管中分别加入1×Binding-Buffer缓冲液。
2.7 统计学处理 采用SPSS 17.0软件进行数据统计,实验数据均以(x±s)表示,多组间比较采用单因素方差分析,以P<0.05为具有统计学意义。
3 结果
3.1 延胡索乙素对海马神经元细胞形态学的影响 正常组的海马神经元呈锥形或多极性,胞体饱满清晰、有明显光晕,有强折光性及立体感;神经元突起相互交织成网状,细胞核明显可见(图1A)。模型组神经元肿胀或变形,突起缩短并逐渐消失,胞质内颗粒变性明显、光晕减弱,神经元内甚至出现了空泡物质,神经元损伤严重(图1B);延胡索乙素中、高剂量组(4、8 μg/mL)以及阳性药尼莫地平组(8 μg/mL)海马神经元形态较完整,光晕减弱现象较轻,胞体内空泡物质减少(图1D,E和F)。其中延胡索乙素中、高剂量组海马神经元形态明显较好,说明延胡索乙素能够明显降低缺氧缺糖对海马神经元细胞的损害。如图1所示。
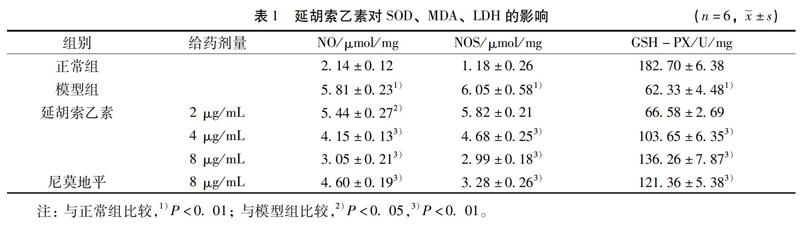
3.2 延胡索乙素对相应生化指标的影响 与正常组相比,模型组的LDH的释放量增加(P<0.01),而SOD、NOS、GSH-PX的活性降低(P<0.01),同时NO、MDA的含量明显增加(P<0.01)。与模型组相比,延胡索乙素的中、高剂量组(4、8 μg/mL)能有效抑制LDH的释放(P<0.01),且SOD、NOS、GSH-PX的活性增加(P<0.01),同时NO、MDA的含量显著降低(P<0.01),但是延胡索乙素的低剂量组的LDH的释放量,SOD、NOS、GSH-PX的活性与模型组差异无统计学意义(P>0.05),而NO、MDA的含量与模型组比较差异具有统计学意义(P<0.05),见表1、表2。上述延胡索乙素中、高剂量组的生化指标的改变证明延胡索乙素能有效改善缺氧缺糖环境下脑组织的微环境。
3.3 延胡索乙素对海马神经元细胞早期細胞凋亡的影响 Annexin V-FITC/PC双染色法检测细胞凋亡,在此双变量流式细胞仪的散点图上,左下象限显示活细胞,为(FITC-/PI-);右 下象限为早期凋亡细胞,显现(FITC + /PI-);右上象限是非活细胞,即坏死细胞,为(FITC + /PI-),详细结果如图2所示。各组早期细胞凋亡的数据见表3,与模型组相比,延胡索乙素中、高剂量组能有效抑制细胞的早期凋亡(P<0. 01),并存在一定的剂量依赖性。以上数据说明延胡索乙素中、高剂量组能够显著抑制缺氧缺糖损伤海马神经元的早期凋亡进程。
4 讨论
海马神经细胞体外生存能力较为脆弱,取材、种植、饲养、消化、冻存过程中需要注意以下关键环节:取材时为了保持组织的低基础代谢率,海马组织需放在冰浴的D-hanks液中。根据组织块剪切的大小和量确定加胰蛋白酶的量、浓度、消化时间等,消化细胞时一定要在镜下观察消化情况防止消化过头。阿糖胞苷需要选取专用于细胞培养级别的,而非用于临床治疗的[7]。
脑缺血发生后,多种因素以及多种损失机制共同影响机体的各项功能正常运转,本研究证明了延胡索乙素能有效减轻由氧化应激以及细胞凋亡而导致脑缺血损伤。MDA是自由基对内皮细胞损害后,引起生物膜上不饱和脂肪酸脂质过氧化反应的最终代谢产物,常用来反映组织脂质过氧化损伤的程度[8]。而SOD作为目前发现的人体唯一的负氧离子天然酶类清除剂,其活性高低亦可间接反映组织自由基的含量[9]。LDH水平的增高是细胞受损的一个敏感指标,它能一定程度上反映细胞的损伤程度[10]。GSH-PX是机体内广泛存在的一种重要的过氧化物分解酶,能清除过氧化物代谢产物,阻断脂质过氧化链锁反应,从而起到保护细胞膜结构和功能完整的作用[11]。
[JP2]目前研究发现,NO参与缺血性脑血管疾病的整个病理生理过程。在病理状态下当NO产生过多时,它又是一种自由基,可造成膜脂质过氧化并且反应生成毒性更大的超氧自由基,引起广泛的脂质过氧化及蛋白质酪氨酸硝基化反应,诱导DNA损伤。NO参与缺血性脑血管疾病表现为双重作用,这主要催化NO生物合成的酶NOS所决定的。NOS以L2精氨酸(LZArg)和分子氧为底物,催化两个等价的肌基氮之一,经氧化反应生成NO和LZ肌氨酸。NOS是NO合成过程中的重要限速因素,体内NO的生物作用完全依赖于NOS的活性[12]。 细胞凋亡是指机体受到损伤时,为维持机体内环境稳定,细胞在基因调控下的主动程序性死亡。Annexin V-FITC/PC双染色法检测以此现象为基础,对早期凋亡的细胞进行检测,从而通过细胞凋亡率反映出脑缺血损失的程度。
实验结果表明延胡索乙素使造模后细胞内SOD活性增加,MDA水平下降,LDH释放量减少,该结果表明延胡索乙素对海马神经元的保护作用可能与抗氧化损伤作用有关,一定程度上显现了对氧化损伤的保护作用;延胡索乙素可以使缺氧缺糖时细胞内GSH-PX水平下降,起到保护细胞的作用;一定程度上能降低缺氧缺糖时NO、NOS的水平。综上所述,延胡索乙素对脑缺血损失有非常显著的保护作用,它可以保护细胞膜的完整性,减少损伤时细胞膜的通透性,增强机体抗氧自由基的能力,减少脂质过氧终产物的生成,减轻细胞早期凋亡,有效对抗脑缺血损失,延胡索乙素在脑缺血疾病的治疗中有着非常宽广的应用领域。
参考文献
[1]王娜梅, 赵玉红, 解旭东. 缺血性脑血管病的治疗现状及进展研究[J]. 医学综述, 2017, 23(19): 3822-3826.
[2]王晓丽, 董妙先, 徐天娇,等. β-细辛醚对缺糖缺氧再灌注损伤原代大鼠海马神经元的保护作用[J]. 中国病理生理杂志, 2014, 30(5): 928-932.
[3]雷世庸, 张荣发. 延胡索乙素的提取及含量测定方法研究进展[J]. 中国药业, 2009, 18(16): 83-84.
[4]杨波, 纪宏宇, 郑东友,等. 中药延胡索的炮制工艺和药理作用的研究进展[J]. 药学实践杂志, 2017, 35(2):112-115.
[5]耿武军, 陈成宇, 莫云长,等. Wnt/β-catenin信号通路介导参麦注射液对脑缺血再灌注损伤大鼠的脑保护作用[J]. 中国动脉硬化杂志, 2018, 26(2): 109-114.
[6]杜成昊, 万海同, 周惠芬,等. 谷红注射液对新生乳鼠海马神经元缺氧缺糖损伤的保护作用[J]. 中华中医药杂志, 2017(1): 289-293.
[7]张雅丽, 高维娟. 乳鼠海马神经细胞的原代培养以及冻存复苏方法[J]. 承德医学院学报, 2007, 24(4): 406-408.
[8]刘青青, 郭虹, 王少峡,等. 脑缺血损伤机制的研究进展[J]. 中华中医药学刊, 2012(6): 1228-1230.
[9]崔海月, 王庆国. 缺血性脑血管病发病机制的新进展[J]. 长春中医药大学学报, 2009, 25(2): 291-292.
[10]易志红, 白洋, 陈立荪,等. 丹酚酸A对H2O2所致大鼠脑微血管内皮细胞氧化损伤保护的实验研究[J]. 浙江医学, 2015, 37(11): 951-954.
[11]钱桂凤, 李虹竹, 赵玮璇,等. 火针膏肓穴对慢性疲劳综合征大鼠血清SOD、MDA及GSH-PX的影响[J]. 中华中医药杂志, 2018, 33(8): 85-88.
[12]宋宁宁. 丹皮酚对大鼠海马神经元缺糖缺氧再灌注损伤的保护作用[D]. 济南:山东大学, 2007.
(收稿日期:2019-07-23 编辑:陶希睿)
