miR-137靶向下调SETD7表达对缺氧复氧诱导的心肌细胞氧化应激的影响研究
2019-11-30王彦利李纪明罗进光
王彦利 李纪明 罗进光
急性心肌梗死是全世界死亡和致残的主要原因之一。在急性心肌梗死患者中,心肌再灌注可以打开闭塞的冠状动脉,但会诱发心肌缺血再灌注(Ischemia reperfusion,IR)损伤[1-2]。心肌IR损伤是在缺氧或缺血一段时间后,当血液供应回到心脏组织时,导致额外的心肌损伤[3]。目前,对于心肌IR损伤的分子机制尚未完全阐明。因此,探究心肌IR损伤的细胞和分子机制对于发现新的心肌IR损伤治疗策略具有重要意义。微小RNA(MicroRNA,miRNA/miR)是一类高度保守的短链RNA[4],多项研究已证明miRNA参与心肌IR损伤过程[5-6]。资料显示,miR-137与缺氧诱导相关[7],可以保护神经元免受IR损伤[8]。但关于miR-137在心肌IR损伤中的作用鲜见报道。本研究以缺氧复氧刺激心肌细胞H9C2,构建心肌IR损伤模型,观察miR-137在缺氧复氧诱导的H9C2细胞增殖和凋亡的影响,进一步探索其作用机制。
1 材料与方法
1.1 主要试剂
心肌细胞H9C2购自中国科学院典型培养物保藏委员会细胞库,DMEM培养基、胎牛血清购自美国Gibco公司,RIPA裂解液、MTT购自美国Sigma公司,Lipofectamine 2000、qPCR试剂盒购自美国赛默飞世尔有限公司,TRIzol试剂购自Invitrogen公司,Annexin V-FITC细胞凋亡检测试剂盒、乳酸脱氢酶(Lactate dehydrogenase,LDH)检测试剂盒、丙二醛(Malondialdehyde,MDA)检测试剂盒购自上海碧云天生物技术研究所,β肌动蛋白(β-actin)、SETD7、细胞周期蛋白D1(Cyclin D1)、活化的含半胱氨酸的天冬氨酸蛋白水解酶-3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)抗体购自美国Cellular Signaling Technology公司,辣根过氧化物酶标记二抗购自博士德生物公司,miR-137、anti-miR-137、pcDNASETD7购自广州锐博生物有限公司。
1.2 细胞培养、细胞转染与分组
H9C2细胞加入DMEM培养基(含10%胎牛血清),于37℃、5%CO2条件下培养。当细胞密度达约80%时,加入胰酶消化、传代。细胞转染前,在6孔板接种1×105个/mL H9C2细胞,当密度达约80%,按照Lipofectamine 2000说明书的指示,将miR-137、anti-miR-137、pcDNA-SETD7及各自阴性对照转染入细胞。H9C2细胞随机分为空白组(H9C2细胞)、缺氧复氧组(缺氧复氧处理H9C2细胞)、缺氧复氧组+miR-con(转染miR-con,并进行缺氧复氧处理)、缺氧复氧+miR-137组(转染miR-137,并进行缺氧复氧处理)、缺氧复氧+miR-137+pcDNA组(共转染miR-137和pcDNA,并进行缺氧复氧处理)、缺氧复氧+miR-137+pcDNA-SETD7组(共转染miR-137和pcDNA-SETD7,并进行缺氧复氧处理)。其中,缺氧复氧处理为缺氧6 h,复氧6 h。
1.3 qPCR检测miR-137和SETD7 mRNA表达
TRIzol试剂提取H9C2细胞总RNA,逆转录为cDNA,以制成的cDNA为模板,U6为参照,依据qPCR试剂盒说明书,进行检测。miR-137上游引物序列 5′-ACTCTCTTCGGTGACGGGTA-3′,下游引物序列5′-CGCTGGTACTCTCCTCGACT-3′,SETD7 mRNA上游引物序列 5′-CCCTGATGAAAGGACTGCCC-3′,下游引物序列 5,-TACACCGAACTTCCAGGCATC-3′。以 2-ΔΔCt法计算miR-137和SETD7 mRNA相对表达量。
1.4 Western blot检测 SETD7、Cyclin D1、Cleaved Caspase-3蛋白表达
RIPA裂解液提取H9C2细胞总蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDSPAGE),将其转至聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉封闭 1 h,加入1∶1 000稀释的一抗,同时加入内参β-actin一抗,4℃孵育过夜,次日充分洗膜,加入1∶5 000稀释的二抗,孵育1 h,充分洗膜,进行显色,显影,分析SETD7、Cyclin D1、Cleaved Caspase-3蛋白相对表达量。
1.5 MTT法检测细胞增殖
96孔板中接种1×105个/mL H9C2细胞,每孔加入20 μL浓度为5 mg/mL MTT溶液,37℃培养4 h,弃上清,加150 μL DMSO,37℃摇床振荡培养10 min,于酶标仪检测各孔细胞在490 nm波长处的吸光值(OD值),细胞存活率(%)=实验组OD值/对照组OD值×100%。
1.6 比色法检测LDH、MDA水平
H9C2细胞接种于96孔板,待密度达80%,按照LDH检测试剂盒指示测定LDH活性。PBS裂解H9C2细胞,离心获取上清,依据MDA检测试剂盒说明书测定MDA含量。
1.7 流式细胞仪检测细胞凋亡
按照Annexin V-FITC细胞凋亡检测试剂盒步骤,H9C2细胞重悬后,加入5 μL Annexin V-FITC,轻轻混匀,10 μL PI染色液,轻轻混匀,室温避光孵育20 min,上流式细胞仪检测细胞凋亡。
1.8 双荧光素酶报告实验
TargetScan 软件(http://www.targetscan.org/)预测出miR-137与SETD7的3′非编码区(3′untranslated region,3′UTR)中部分碱基存在互补配对现象。构建野生型 SETD7 3′UTR(WT-SETD7)和突变型SETD7 3′UTR(MUT-SETD7)报告质粒,分别转染miR-con或miR-137,48 h后检测双荧光素酶活性。
1.9 统计学分析
采用SPSS 22.0软件进行数据整理与分析,结果以()表示。两组间数据比较采用t检验,多组数据间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05代表差异有统计学意义。
2 结果
2.1 缺氧复氧处理对心肌细胞miR-137和SETD7表达的影响
与空白组比较,缺氧复氧明显降低H9C2细胞中 miR-137表达量(P<0.05,表 1),显著提高SETD7 mRNA和蛋白水平(P<0.05,表1、图1)。
表1 缺氧复氧处理心肌细胞影响miR-137和SETD7表达(±s,n=9)Table 1 Effects of hypoxia-reoxygenation on the expression of miR-137 and SETD7 in cardiomyocytes(±s,n=9)
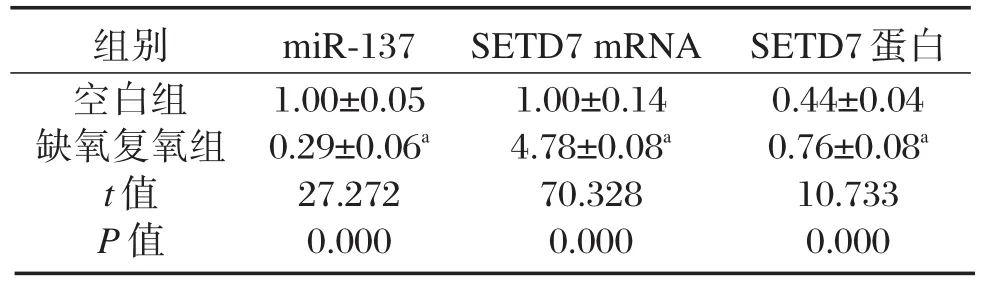
表1 缺氧复氧处理心肌细胞影响miR-137和SETD7表达(±s,n=9)Table 1 Effects of hypoxia-reoxygenation on the expression of miR-137 and SETD7 in cardiomyocytes(±s,n=9)
与空白组比较,aP<0.05。
组别空白组缺氧复氧组t值P值miR-137 1.00±0.05 0.29±0.06a 27.272 0.000 SETD7 mRNA 1.00±0.14 4.78±0.08a 70.328 0.000 SETD7蛋白0.44±0.04 0.76±0.08a 10.733 0.000
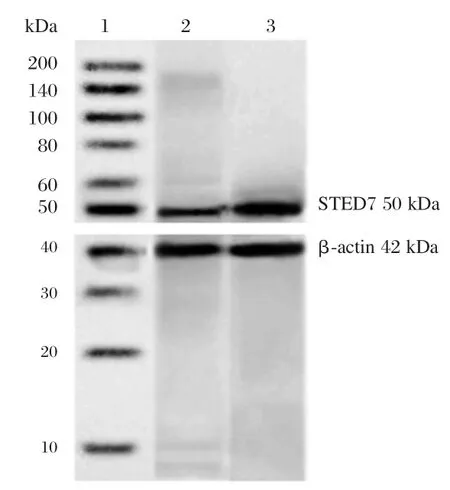
图1 心肌细胞中SETD7蛋白表达Figure 1 SETD7 protein expression in cardiomyocytes
2.2 上调miR-137表达促进缺氧复氧处理心肌细胞增殖
相比于空白组,缺氧复氧显著降低H9C2细胞中miR-137、Cyclin D1表达量和细胞存活率(P<0.05,表 2、图 2),明显提高 LDH、MDA 水平(P<0.05,表2)。相比于缺氧复氧+miR-con组,转染miR-137显著提高H9C2细胞内miR-137、Cyclin D1表达量和细胞存活率(P<0.05,图2、表2),明显降低LDH、MDA水平(P<0.05,表2)。
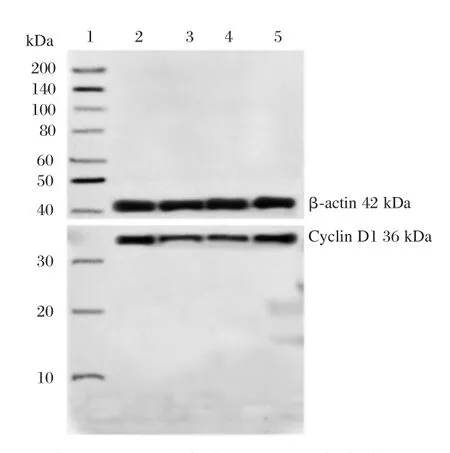
图2 心肌细胞中Cyclin D1蛋白表达Figure 2 Cyclin D1 protein expression in cardiomyocytes
2.3 上调miR-137表达抑制细胞凋亡
与空白组相比,缺氧复氧显著增加H9C2细胞中Cleaved Caspase-3蛋白水平和细胞凋亡率(P<0.05,表3、图3)。与缺氧复氧+miR-con组相比,转染miR-137明显减少H9C2细胞中Cleaved Caspase-3蛋白表达量和细胞凋亡率(P<0.05,表3、图3)。
表2 转染miR-137促进缺氧复氧处理心肌细胞存活率(±s,n=9)Table 2 Transfection of miR-137 promoted the survival rate of myocardial cells treated with hypoxia-reoxygenation(±s,n=9)
表2 转染miR-137促进缺氧复氧处理心肌细胞存活率(±s,n=9)Table 2 Transfection of miR-137 promoted the survival rate of myocardial cells treated with hypoxia-reoxygenation(±s,n=9)
与空白组比较,aP<0.05;与缺氧复氧+miR-con组比较,bP<0.05。
组别空白组缺氧复氧组缺氧复氧组+miR-con缺氧复氧+miR-137组F值P值miR-137 1.00±0.11 0.31±0.05a 0.28±0.04 4.97±0.50b 681.458 0.000 Cyclin D1 0.83±0.08 0.38±0.05a 0.42±0.04 0.68±0.06b 117.511 0.000 LDH(U/L)489.43±34.14 823.82±56.28a 842.78±63.39 621.58±52.77b 92.761 0.000 MDA(nmol/mL)4.67±0.43 13.58±1.28a 14.29±3.04 7.78±1.07b 63.423 0.000细胞存活率(%)100.00±5.37 56.46±4.86a 59.72±5.16 78.69±7.08b 112.307 0.000
表3 转染miR-137抑制缺氧复氧处理心肌细胞凋亡(±s,n=9)Table 3 Transfection of miR-137 inhibited apoptosis of myocardial cells treated with hypoxia-reoxygenation(±s,n=9)
表3 转染miR-137抑制缺氧复氧处理心肌细胞凋亡(±s,n=9)Table 3 Transfection of miR-137 inhibited apoptosis of myocardial cells treated with hypoxia-reoxygenation(±s,n=9)
与空白组比较,aP<0.05;与缺氧复氧+miR-con组比较,bP<0.05。
组别空白组缺氧复氧组缺氧复氧+miR-con组缺氧复氧+miR-137组t值P值Cleaved Caspase-3蛋白0.28±0.04 0.67±0.06a 0.71±0.07 0.54±0.05b 107.619 0.000细胞凋亡率(%)4.78±0.39 20.68±1.25a 22.36±1.39 10.38±1.08b 527.099 0.000
图3 转染miR-137影响缺氧复氧处理心肌细胞Cleaved Caspase-3蛋白表达和细胞凋亡Figure 3 Transfection of miR-137 affected Cleaved caspase-3 protein expression and apoptosis in cardiomyocytes treated with hypoxia-reoxygenation
2.4 miR-137靶向调控SETD7的表达
TargetScan软件预测发现,SETD7 3′UTR中含有与miR-137互补的核苷酸序列(图4A)。双荧光素酶报告实验结果表明,WT-SETD7荧光素酶相对活性被 miR-137显著抑制(P<0.05),MUTSETD7荧光素酶相对活性无显著变化P>0.05(表4)。上调或下调miR-137显著调控SETD7蛋白水平(P<0.05,图4B、表5)。
表4 双荧光素酶报告实验(±s,n=9)Table 4 Dual luciferase reporting experiment(±s,n=9)
表4 双荧光素酶报告实验(±s,n=9)Table 4 Dual luciferase reporting experiment(±s,n=9)
与miR-con组比较,aP<0.05。
组别miR-con组miR-137组t值P值WT-SETD7 1.06±0.09 0.39±0.05a 19.523 0.000 MUT-SETD7 1.06±0.11 1.09±0.12 0.553 0.588
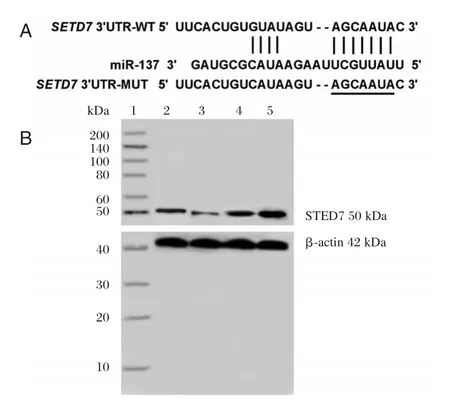
图4 miR-137靶向调控SETD7的表达Figure 4 miR-137 targeted to regulate the expression of SETD7
2.5 上调SETD7部分逆转miR-137对缺氧复氧处理心肌细胞的保护作用
缺氧复氧组和缺氧复氧+miR-137组明显影响 H9C2细胞Cyclin D1、Cleaved Caspase-3蛋白表达、LDH活性、MDA含量、细胞存活率和细胞凋亡率(P<0.05,表6、图5)。缺氧复氧处理H9C2细胞中SETD7蛋白表达量明显增加,转染miR-137后,其表达量显著降低(P<0.05,表6、图5)。
表5 miR-137靶向SETD7调控其表达(±s,n=9)Table 5 miR-137 targeted SETD7 to regulate its expression(±s,n=9)
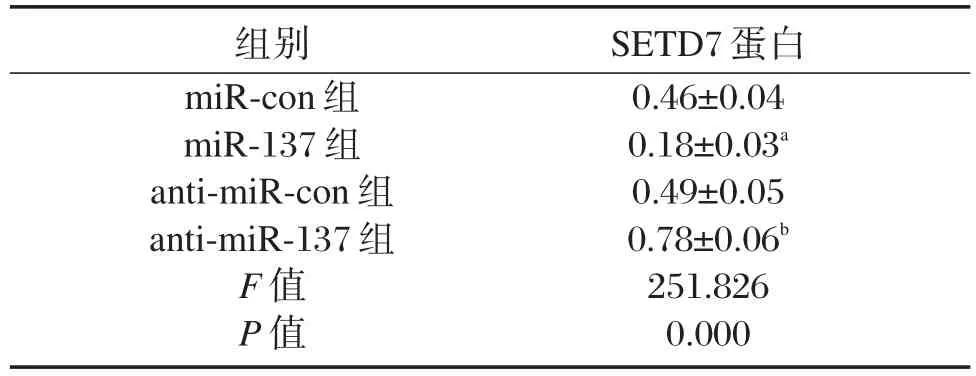
表5 miR-137靶向SETD7调控其表达(±s,n=9)Table 5 miR-137 targeted SETD7 to regulate its expression(±s,n=9)
与miR-con组比较,aP<0.05;与anti-miR-con组比较,bP<0.05。
组别miR-con组miR-137组anti-miR-con组anti-miR-137组F值P值SETD7蛋白0.46±0.04 0.18±0.03a 0.49±0.05 0.78±0.06b 251.826 0.000
3 讨论
资料显示,氧化应激和细胞凋亡在心肌IR损伤中扮演着重要角色[9]。因此,抑制氧化应激和细胞凋亡可能成为针对心肌IR损伤的策略和目标。目前,缺氧复氧损伤已被广泛用作心肌IR损伤体外模型[10]。本研究也利用缺氧复氧处理H9C2细胞构建体外心肌IR损伤模型,评价miR-137在其中的作用。
表6 过表达SETD7部分逆转miR-137对缺氧复氧处理心肌细胞的保护作用(±s,n=9)Table 6 Overexpression of SETD7 partially reversed the protective effect of miR-137 on myocardial cells treated with hypoxia and reoxygenation(±s,n=9)
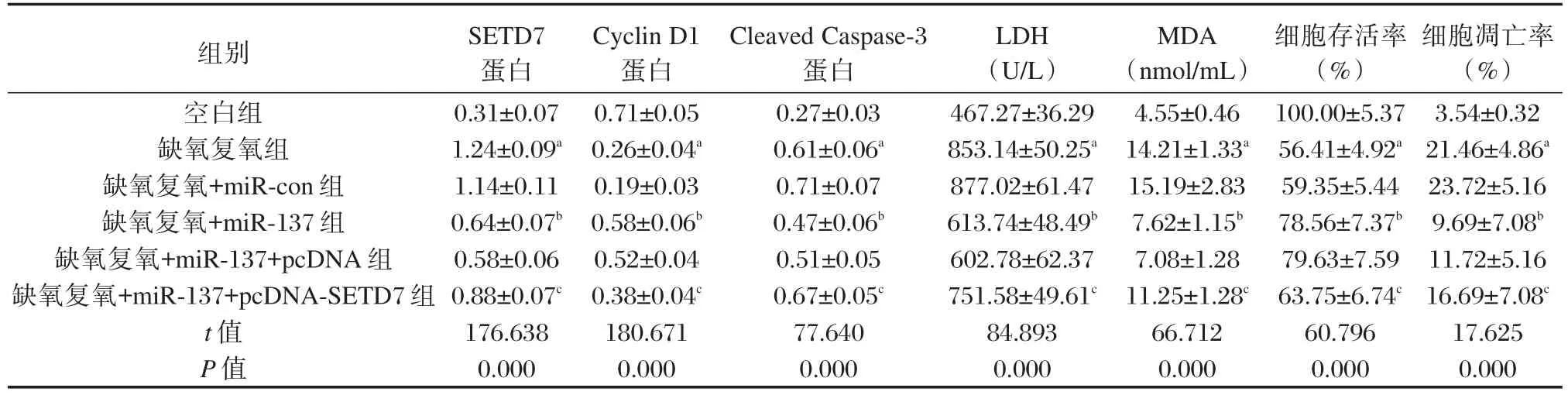
表6 过表达SETD7部分逆转miR-137对缺氧复氧处理心肌细胞的保护作用(±s,n=9)Table 6 Overexpression of SETD7 partially reversed the protective effect of miR-137 on myocardial cells treated with hypoxia and reoxygenation(±s,n=9)
与空白组比较,aP<0.05;与缺氧复氧+miR-con组比较,bP<0.05;与缺氧复氧+miR-137+pcDNA组比较,cP<0.05。
组别空白组缺氧复氧组缺氧复氧+miR-con组缺氧复氧+miR-137组缺氧复氧+miR-137+pcDNA组缺氧复氧+miR-137+pcDNA-SETD7组t值P值SETD7蛋白0.31±0.07 1.24±0.09a 1.14±0.11 0.64±0.07b 0.58±0.06 0.88±0.07c 176.638 0.000 Cyclin D1蛋白0.71±0.05 0.26±0.04a 0.19±0.03 0.58±0.06b 0.52±0.04 0.38±0.04c 180.671 0.000 Cleaved Caspase-3蛋白0.27±0.03 0.61±0.06a 0.71±0.07 0.47±0.06b 0.51±0.05 0.67±0.05c 77.640 0.000 LDH(U/L)467.27±36.29 853.14±50.25a 877.02±61.47 613.74±48.49b 602.78±62.37 751.58±49.61c 84.893 0.000 MDA(nmol/mL)4.55±0.46 14.21±1.33a 15.19±2.83 7.62±1.15b 7.08±1.28 11.25±1.28c 66.712 0.000细胞存活率(%)100.00±5.37 56.41±4.92a 59.35±5.44 78.56±7.37b 79.63±7.59 63.75±6.74c 60.796 0.000细胞凋亡率(%)3.54±0.32 21.46±4.86a 23.72±5.16 9.69±7.08b 11.72±5.16 16.69±7.08c 17.625 0.000
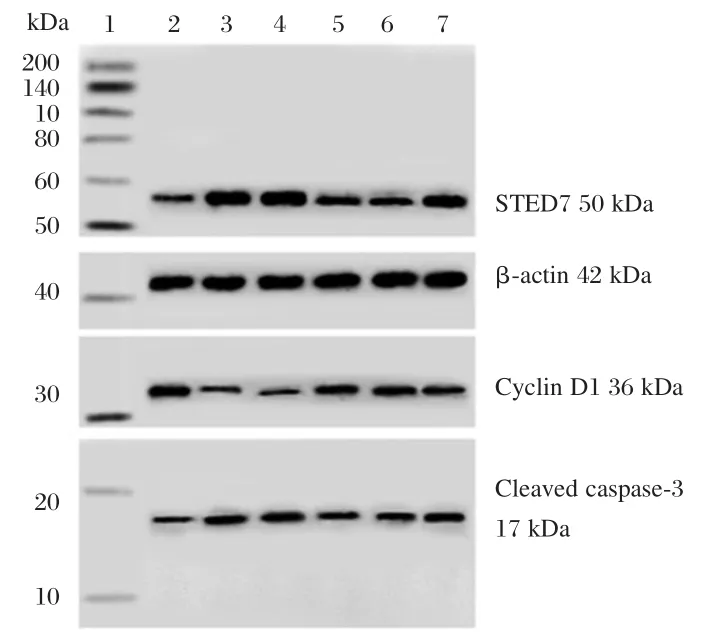
图5 心肌细胞中SETD7、Cyclin D1、Cleaved Caspase-3蛋白表达Figure 5 The protein expression of SETD7,Cyclin D1 and Cleaved caspase-3 in cardiomyocytes
大量证据表明,miRNA是心肌IR损伤等各种病理过程的重要调节因子[11],如 miR-126[12]、miR-29b[13]。miR-137 被认为是前列腺癌[14]、骨肉瘤[15]在内的多种癌症类型的肿瘤抑制因子,同时参与缺血性星形胶质细胞损伤[16]和缺氧诱导的视网膜疾病[17]。研究发现,miR-137在缺氧的小鼠脑中表达下调[7],与本研究中缺氧复氧抑制miR-137表达一致。Cyclin D1是一种重要的有丝分裂原细胞周期调节剂,Cleaved Caspase-3与细胞凋亡密切相关,LDH是心肌损伤的标志物,MDA是氧化应激的产物之一,其含量高低可以反映细胞氧化应激损伤程度。在缺氧复氧刺激的心肌细胞损伤中,Cyclin D1蛋白表达、细胞存活率显著降低,Cleaved Caspase-3蛋白水平、LDH、MDA水平、细胞凋亡率明显提高[18-19],这与本实验结果相同。miR-137促进缺氧复氧处理H9C2细胞增殖、Cyclin D1表达,并抑制细胞凋亡、Cleaved Caspase-3、LDH和MDA水平,可以保护缺氧复氧刺激的心肌细胞氧化应激损伤,其保护作用同样出现在神经元IR损伤中[8]。
miRNA通过转录后在各种生物活动中发挥关键作用。利用TargetScan工具和双荧光素酶报告实验证实SETD7是miR-137的靶基因。研究表明,抑制SETD7表达显著抑制缺氧复氧诱导的心肌细胞凋亡,减少ROS产生,通过下调Keap1和促进Nrf2介导的抗氧化信号传导,减弱缺氧复氧诱导的心肌细胞损伤[20]。本实验中,缺氧复氧抑制SETD7表达,上调SETD7逆转了miR-137对缺氧复氧处理心肌细胞的保护作用。提示miR-137通过直接靶向SETD7实现对缺氧复氧处理心肌细胞的保护作用。
综上所述,miR-137可以保护缺氧复氧诱导的心肌细胞氧化应激损伤,促进缺氧复氧处理的心肌细胞增殖并抑制细胞凋亡,机制与靶向调控SETD7表达有关,这为心肌IR损伤提供了新治疗靶点。