Apelin-13对3T3-L1前体脂肪细胞增殖与分化的影响
2019-11-29童国相王莎高国应何一伟李琼
童国相 王莎 高国应 何一伟 李琼
长沙医学院附属第一医院内分泌科 410219
Apelin 是血管紧张素受体AT1 相关受体蛋白( putative receptor protein related to the angiotensin receptor AT1,APJ) 的内源性配体[1]。其主要存在于心脏、肾、肺的大血管内皮细胞中,在肾上腺细胞、血管平滑肌细胞、神经细胞、结缔组织等中也有表达。Apelin也存在于脂肪组织中,是其中的一种脂肪因子[2]。Apelin的前体肽源包含77 个氨基酸残基,羧基C 末端为合成肽序列,可被肽酶分解成多种成熟的Apelin活性肽,包括Apelin-10、11、12、13、15、17、19、28、36 等,其中Apelin-13的生物活性最强[3]。既往研究显示,Apelin在控制血压,增强心肌收缩力,调节体液平衡,促进垂体激素分泌和调节免疫等生物学效应中均发挥着不同程度的作用[4-7]。此外,Apelin在肥胖、脂肪细胞代谢中同样具有重要调节作用。Guo 等[8]研究显示,Apelin-13在体外可以降低肥大脂肪细胞的脂质贮积,可能的作用机制为通过磷脂酰肌醇3 激酶信号通路上调水通道蛋白7 的表达。Sawane等[9]在高脂饮食诱导肥胖小鼠模型中发现,Apelin基因敲除小鼠的体重及皮下脂肪层厚度、脂肪细胞直径显著高于高脂饮食野生型小鼠。Apelin 基因转染则可以降低高脂饮食的作用。Apelin基因敲除小鼠在肥胖发生过程中,可以出现肠系膜淋巴管增生与扩张。Apelin基因转染抑制了高脂饮食诱导的淋巴管数量和通透性的增加。结果表明,Apelin通过增强淋巴管和血管的完整性,从而抑制肥胖。本研究通过在3T3-L1 前体脂肪细胞增殖、分化过程中,予以Apelin-13干预,探讨Apelin-13对脂肪细胞增殖、分化的影响,并初步探讨其可能的作用机制。具体报道如下。
1 材料与方法
1.1 试剂与仪器 3T3-L1前体脂肪细胞购自于中国科学院上海细胞库; Apelin-13购自于上海齐一生物科技有限公司; DMEM 高糖培养液、胎牛血清、1-甲基-3-异丁基-黄嘌呤( IBMX) 、地塞米松、胰岛素,四甲基偶氮唑盐( MTT) 检测试剂盒、油红O 染液、甘油三酯检测试剂盒购自于北京鼎国昌盛生物科技有限公司;实时荧光定量PCR 引物由上海生工生物工程有限公司合成; Trizol试剂盒、逆转录试剂盒和SYBR Green荧光定量试剂盒均购自北京索莱宝科技有限公司; 过氧化物酶体增殖物活化受体( PPAR) γ 抗体、HRP 标记的二抗,总蛋白提取试剂盒和蛋白浓度检测试剂盒均购自上海碧云天生物科技有限公司; CO2恒温细胞培养箱购自美国Thermo公司;离心机购自美国Sigma公司; FlexStation 3多功能酶标仪购自美国Molecular Devices公司; IX51倒置显微镜购自日本Olympus 公司; PE2400 型多功能PCR 仪购自美国Perking公司; 电泳槽、电泳仪、化学发光荧光成像系统等购自美国Bio-Rad公司。
1.2 研究方法
1.2.1 3T3-L1 前体脂肪细胞培养 3T3-L1前体脂肪细胞置于DMEM 高糖培养液( 含10%胎牛血清,100 U/ml的青霉素和链霉素) ,在37℃、5%CO2的细胞培养箱内培养。每2 天更换培养液。
1.2.2 MTT 法检测3T3-L1 前体脂肪细胞增殖 取对数生长期细胞,以5 000 个/孔接种至96 孔培养板,培养液100 μl/孔,置于37℃,5%CO2的细胞培养箱中培养24 h,贴壁后轻轻吸弃上清液。分别予以浓度为5、10、20、40、50、100 μmol/L的Apelin-13进行干预,每组6 个复孔,并设置空白对照孔。干预24、48、72、96 h后,分别每孔加入5 g/L MTT 20 μl,37℃温育,弃去孔内液体,避光振荡10 min后,在酶标仪上以490 nm 波长测定各孔吸光度值( A 值) 。各浓度平行孔A 值均值减去空白对照孔A 值均值后,按照细胞存活率(%) =( A实验孔-A空白孔) /A空白孔×100%。
1.2.3 “经典鸡尾酒法”诱导3T3-L1前体脂肪细胞分化及干预 取对数生长期细胞,以5 000个/孔接种至96 孔培养板,培养液100 μl/孔,继续培养2 d。待3T3-L1前体脂肪细胞融合后,将培养液换为含0.5 mmol/L IBMX、0.25 μmol/L 地 塞 米 松 和10 mg/L胰岛素的DMEM 高糖培养液。2 d 后再更换为含10%胎牛血清、10 mg/L胰岛素的DMEM高糖培养液继续孵育2 d。随后以不含任何诱导剂的DMEM高糖培养液继续培养2 d 至分化完成。培养液每2 天更换1 次。诱导分化第8 天,95%以上的细胞可分化为具有脂肪细胞表型的成熟脂肪细胞。将对数生长期细胞分为实验组和对照组。实验组分别于诱导分化第2、4、6、8 天更换培养液的同时,予以细胞存活率抑制作用最强的Apelin-13浓度进行干预。对照组不做处理。
1.2.4 油红O 染色和甘油三酯含量检测 于诱导分化第8 天,分别取两组成熟脂肪细胞,采用油红O染色法室温染色2 h。倒置显微镜下观察脂滴形成情况并拍照。然后加入异丙醇处理染色的细胞,通过酶标仪在510 nm波长下测定吸光度( OD) 值,计算脂质含量。严格按照说明书,使用甘油三酯检测试剂盒测定甘油三酯含量。
1.2.5 RT-PCR 检测PPARγ mRNA表达变化 于诱导分化第2、4、6、8 天,分别收集两组细胞。经胎牛血清洗涤后,Trizol法提取3T3-L1 前体脂肪细胞总RNA,紫外分光光度计测定总 RNA 浓度,A260/A280值在1.8 ~2.0。逆转录合成cDNA,使用SYBR Green染色法进行RT-PCR,检测PPARγ mRNA水平。上游引物: 5'-GTGATGGAAGACCACTCGC-3';下游引物:5'-CCCACAGACTCGGCACTC-3'。PCR反应总体积为10 μl。反应条件为:50℃2 min;预变性95℃5 min; 循环95℃30 s,60℃30 s,PCR 仪上扩增40 个循环。以18s RNA作为内参。采用公式2-△△CT计算mRNA 相对表达量,分析表达量的差异。
1.2.6 Western 印迹检测PPARγ 蛋白表达变化于诱导分化第2、4、6、8 天,分别提取两组3T3-L1前体脂肪细胞总蛋白,经蛋白定量后,每泳道上样40 μg蛋白,电泳后转移至硝酸纤维素膜,5%脱脂奶粉封闭3 h,加入PPARγ抗体,室温摇床孵育2 h,加入HRP 标记二抗孵育30 min,以β-actin作为内参。检测条带用化学发光荧光成像系统扫描灰度值。
1.3 统计学处理 应用SPSS 22.0 软件处理,正态分布的计量资料采用x ±s 表示。计量资料两两比较采用t 检验分析。P <0.05为差异有统计学意义。
2 结果
2.1 Apelin-13 对3T3-L1前体脂肪细胞增殖的影响Apelin-13浓度越高,干预时间越长,3T3-L1前体脂肪细胞的存活率越低。以100 μmol/L Apelin-13 干预96 h 后,3T3-L1前体脂肪细胞的存活率最低( 图1) 。

图1 不同浓度Apelin鄄13 对3T3鄄L1 前体脂肪细胞增殖的影响
2.2 Apelin-13 对3T3-L1前体脂肪细胞分化的影响油红O 染色结果显示,诱导分化第8 天,两组细胞核周可见大量红色“戒环”样脂滴,见图2( 封3) 。经Apelin-13干预的3T3-L1前体脂肪细胞脂滴、脂质和甘油三酯含量均明显少于对照组( t=4.526、5.353、4.827,P 均<0.05),见图3。

图2 Apelin鄄13 对3T3鄄L1 前体脂肪细胞分化的影响(油红O 染色,200×)

图3 Apelin鄄13 对3T3鄄L1 前体脂肪细胞分化的影响
2.3 Apelin-13 对PPARγ mRNA表达的影响 如图4,与对照组相比,诱导分化第6、8 天,经Apelin-13干预的3T3-L1前体脂肪细胞PPARγ mRNA表达量显著下降( t=4.962、5.416,P 均<0.05) 。
2.4 Apelin-13 对PPARγ 蛋白表达的影响 如图5,与对照组相比,诱导分化第6、8 天,经Apelin-13干预的3T3-L1前体脂肪细胞PPARγ蛋白表达量显著下降( t=4.734、5.627,P 均<0.05) 。
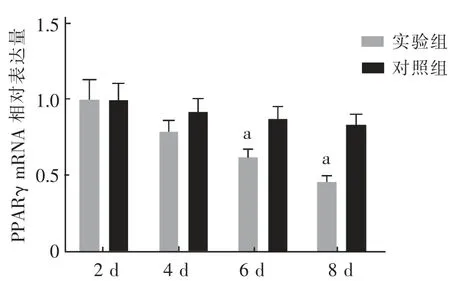
图4 实验组和对照组PPARγ mRNA 表达的比较

图5 实验组和对照组PPARγ 蛋白表达的比较
3 讨论
肥胖以体内白色脂肪组织过度积聚为重要特征,与2 型糖尿病、心脑血管疾病、肿瘤等多种疾病的发生、发展密切相关。肥胖不仅影响生活质量,减少预期寿命,同时也给患者的家庭和社会带来沉重的经济负担[10]。因此,肥胖一直是临床研究的热点与难点。
Apelin 是APJ 的内源性配体,在多种细胞中均有表达。白色脂肪组织是重要的内分泌组织,可分泌瘦素、脂联素、网膜素等多种脂肪因子。Apelin也是白色脂肪组织分泌的众多脂肪因子中的一种[11]。近年来多项研究表明,Apelin在多种疾病的发生、发展中具有重要的调节作用。Boal等[12]研究显示,在高脂饮食喂养的心脏缺血/再灌注小鼠中,静脉注射Apelin-13显著减少了心肌梗死面积、细胞凋亡和线粒体损伤。在H9C2心肌细胞系和原代心肌细胞中,Apelin-13可以诱导叉头框蛋白O1( FOXO1) 磷酸化和核排斥,通过siRNA沉默FOXO1,可消除Apelin-13对缺氧诱导细胞凋亡和线粒体活性氧簇生成的保护作用。小鼠Apelin缺陷导致心肌FOXO1表达减少,FOXO1分布受损。Yang 等[13]体外细胞实验发现,肺腺癌细胞过表达APJ,Apelin-13能显著增加细胞外信号调节激酶1/2 的磷酸化以及细胞周期蛋白D1、微管相关蛋白1 轻链3A/B( LC3A/B) 和自噬相关基因Beclin1的表达,并诱导肺腺癌细胞的增殖和自噬。Bülbül等[14]研究证实,在大鼠体内,Apelin-13可以通过迷走神经胆碱能通路抑制胃肠道运动。
白色脂肪组织的主要成分为前体脂肪细胞和脂肪细胞,还包括渗透入白色脂肪组织的内皮细胞、巨噬细胞、血管神经等非脂肪细胞和组织[15]。肥胖发生的生物学基础是白色脂肪组织内前体脂肪细胞增殖、分化,导致脂肪细胞体积和数量的增加。体积变化与前体脂肪细胞增殖和脂解的平衡相关,而数量变化则与前体脂肪细胞分化和凋亡密切相关[16]。Than等[17]研究显示,Apelin-APJ信号通路通过磷脂酰肌醇3 激酶/蛋白激酶B 和AMP 活化蛋白激酶信号通路,增加棕色脂肪形成和热原性转录因子的表达,从而促进棕色脂肪细胞分化。Apelin可以减轻肿瘤坏死因子-α对棕色脂肪生成的抑制作用,促进棕色脂肪细胞PPARγ协同刺激因子1α 和解耦联蛋白1 的表达增加。此外,Apelin还能够增加白色脂肪细胞的棕色化,从而发挥抗肥胖的作用。本研究首次在3T3-L1前体脂肪细胞诱导分化过程中,予以Apelin-13干预,结果表明,Apelin-13能抑制3T3-L1前体脂肪细胞的增殖,且呈浓度和时间依赖性。油红O 染色检测脂质含量和甘油三酯含量的结果表明,Apelin-13能抑制3T3-L1前体脂肪细胞分化过程中脂滴的形成,减少脂质聚集和甘油三酯含量。
在前体脂肪细胞分化过程中,PPAR、CCAAT增强子结合蛋白α、脂肪细胞蛋白2 等转录因子发挥重要的调控作用[18-19]。其中,PPAR是核激素受体家族中的配体激活受体,根据结构的不同,PPAR可分为α、β 和γ 3 种类型。其中PPARγ主要表达于脂肪组织和免疫系统,具有脂肪组织特异性,是体内脂肪形成所必需的转录因子,能被脂肪酸及外源性过氧化物酶体增殖物激活,调控脂代谢酶的表达,从而导致前体脂肪细胞最终的分化,脂滴形成,脂质聚集[20]。因此,PPARγ在前体脂肪细胞分化中起着重要的调节作用。本研究首次通过检测Apelin-13干预的3T3-L1 前体脂肪细胞诱导分化过程中PPARγ mRNA和蛋白的表达变化,发现Apelin-13 能下调3T3-L1前体脂肪细胞PPARγ mRNA和蛋白的表达。此可能为Apelin-13抑制3T3-L1前体脂肪细胞分化的作用机制。
综上,Apelin-13 呈浓度和时间依赖性抑制3T3-L1前体脂肪细胞的增殖,并抑制3T3-L1前体脂肪细胞分化过程中脂滴的形成,减少脂质聚集和甘油三酯含量。其可能的作用机制为通过抑制3T3-L1前体脂肪细胞分化相关调控因子PPARγ 的表达。
