黄淮麦区部分骨干品种重要基因等位类型分析及全基因组优异位点挖掘
2019-11-29王晓翠杨超凡陈晓杰吉万全闵东红孙道杰胡银岗
游 银,王晓翠,杨超凡,陈晓杰,卢 山,吉万全,3,闵东红,3,孙道杰,胡银岗,3,陈 亮,3
(1.西北农林科技大学农学院,陕西杨凌 712100;2.河南省科学院同位素研究所有限责任公司/河南省核农学重点实验室,河南郑州 450015;3.旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
黄淮麦区是我国小麦的主产区和高产区,小麦常年种植面积约1 530×104hm2,占全国麦播面积的55%,总产量约占全国总产量的60%,提高本区小麦产量对我国的粮食生产具有重要意义[1]。小麦的产量潜力受其春化、光周期、抗倒伏和抗病性等品种特性的影响。
小麦的春化进程受到春化基因VRN1、VRN2、VRN3的调控:VRN1与AP1基因同源,被定位在小麦5A、5B和5D染色体长臂上,该基因经春化诱导后能促进小麦花器官的形成;VRN2为开花抑制因子,位于5A染色体上;VRN3位于7B染色体上,是FT基因的同源基因,该基因也受到日照长度的调节,对小麦开花有促进作用[2]。Yan等[3]在小麦中成功克隆了春化基因VRN1、VRN2、VRN3,并开发了用于检测Vrn-A1和Vrn-B3的分子标记。Fu等[4]根据VRN1在第一内含子区域的差异开发了用于检测Vrn-A1、Vrn-B1、Vrn-D1的分子标记。杨芳萍等[5]利用标记对来自23个不同国家的755份小麦品种的春化基因进行了检测。
小麦是低温长日照植物,当光照长于一定时长时才会开花,这是小麦的光周期现象。小麦的光周期基因包括Ppd-D1、Ppd-B1和Ppd-A1,分别位于2A、2B和2D染色体上,显性表现为光周期不敏感,隐性表现为敏感,显性基因的钝化效应大小为Ppd-D1>Ppd-B1>Ppd-A1。Beales等[6]开发了Ppd-D1位点的功能标记,韩领峰等[7]利用相关分子标记对我国不同地区977个小麦品种的光周期基因进行了检测,发现我国的小麦品种在Ppd-B1和Ppd-A1位点几乎均为光周期敏感型,在Ppd-D1位点大多为光周期不敏感型,其中光周期不敏感基因Ppd-D1a在我国黄淮冬麦区分布频率最高。
矮秆基因能有效降低株高,提高植株抗倒伏的能力。目前生产中应用最广泛的小麦矮秆基因为Rht-B1b、Rht-D1b和Rht8。Rht-B1b、Rht-D1b均来源于农林10号,分别位于4B和4D染色体上,Rht8来源于赤小麦,位于2D染色体。Ellis等[8]设计了相应的STS标记用于检测Rht-B1b和Rht-D1b。Rht8也有相应的分子标记可以检测[9-10]。
赤霉病是由禾谷镰刀菌引起的一种真菌性病害,严重影响小麦的产量和品质。目前在小麦中已定位了多个抗赤霉病QTL,但正式命名的只有7个(Fhb1~Fhb7),Fhb1在国内外育种中运用最广泛,抗性稳定且效应大,其来源于我国抗赤霉病品种苏麦3号。朱展望等[11]开发出的诊断性标记His-Indel可用于Fhb1的分子鉴定。
近年来黄淮麦区反常气候频发,小麦生产受到极大影响。西农系列品种如西农979、西农511及黄淮麦区其他骨干品种表现良好,推广潜力大。为了解析这些骨干品种重要性状相关基因的组成类型、挖掘西农系列品种的优异等位位点,本研究分别利用春化、光周期、矮秆、抗赤霉病基因的分子标记对它们进行检测,分析各品种相关基因组成类型,并利用35K芯片对这些品种进行全基因组SNP筛选,以期为发掘各品种的特有、共有SNP位点提供信息,并为后期利用优势位点进行分子育种提供参考。
1 材料与方法
1.1 供试材料
本研究的试验材料包括10份西农系列小麦品种(西农979、西农511、西农529、西农585、西农2611,西农389、西农811、小偃6号、小偃22号陕229)以及54份黄淮麦区其他骨干小麦品种(矮抗58、郑麦9023、新麦26、周麦22等)。
1.2 春化、光周期、矮秆及抗赤霉病基因等位类型的分子检测
选取各材料幼嫩叶片,采用CTAB法提取DNA,利用相关基因的功能标记进行检测,确定材料的基因型。引物由北京奥科鼎盛生物科技有限公司合成,各引物对反应体系均为10 μL:1×buffer(不含MgCl2),1.5 mmol·L-1MgCl2,150 mmol·L-1dNTPs,引物浓度10 pmol(引物的具体信息见表1),Taq DNA聚合酶1 U,模板DNA 60~100 ng。反应程序为:95 ℃预变性5 min;94 ℃变性20 s,退火温度55~68 ℃,延伸时间 30 s~2 min,38个循环;最后72 ℃延伸5 min。引物Xgwm261、WMC503的扩增产物以8%的聚丙烯酰胺凝胶电泳分离检测,缓冲液体系为1×TBE溶液,150 V电压电泳2 h 30 min,银染显色;其余引物扩增产物以1.5%琼脂糖凝胶电泳分离检测。
1.3 SNP芯片数据分析


表1 引物名称及相关信息
2 结果与分析
2.1 春化基因等位变异及其组成类型分析
以VRNA1和VRN1-INT1R为引物对,所有材料均扩增出734 bp的片段,基因型可能为vrn-A1或Vrn-A1c。所有材料用Intr1/A/F和Intr1/A/R3为引物对进行扩增,无条带;用Intr1/C/F和Intr1/AB/R为引物对扩增,扩增出 1 068 bp的片段,证明所有材料均含有隐性基因vrn-A1。以Intr1/B/F和Intr1/B/R3为引物对,3份材料扩增出709 bp的片段,表明这些材料中含有显性基因Vrn-B1;以Intr1/B/F和Intr1/B/R4为引物对,61份材料扩增出1 149 bp的片段,证明它们中含有隐性基因vrn-B1。以Intr1/D/F和Intr1/D/R3为引物对,13份材料扩增出1 671 bp的片段,表明这些材料中含有显性基因Vrn-D1;以Intr1/D/F和Intr1/D/R4为引物对,51份材料扩增出997 bp的片段,证明它们中含有隐性基因vrn-D1。分别用VRN4-B-INS-F/VRN4-B-INS-R和VRN4-B-NOINS-F/VRN4-B-NOINS-R引物对扩增,前者无条带,后者在所有材料中均扩出1 140 bp的片段,说明这些材料均含隐性基因vrn-B3。在所有材料中,Vrn-A1和Vrn-B3位点均未检测到显性等位变异;Vrn-B1位点检测到3份材料具有显性等位变异,频率为4.7%,Vrn-D1位点检测到13份材料有显性等位变异,频率为20.3%。综合春化基因四个位点的检测结果,49份材料均为隐性基因型vrn-A1+vrn-B1+vrn-D1+vrn-B3,2份材料基因型为vrn-A1+Vrn-B1+vrn-D1+vrn-B3,12份材料基因型为vrn-A1+vrn-B1+Vrn-D1+vrn-B3,1份材料基因型为vrn-A1+Vrn-B1+Vrn-D1+vrn-B3。所有材料中未检测出其他基因型的品种(参试品种基因型见表2)。
2.2 光周期基因组成类型分析
用引物对2D-Ins-F1和2D-Ins-R1检测参试材料,宁春45和中国春扩增出414 bp的片段,说明这两个品种携带光周期敏感基因Ppd-D1b;用引物对2D-Ins-F1和2D-Ins-R2进行扩增,除宁春45和中国春外的62个品种均扩增出288 bp的片段,说明这些品种均携带光周期不敏感基因Ppd-D1a。
2.3 矮秆基因组成类型分析(Rht-B1, Rht-D1, Rht8)
在供试材料中,用引物Rht-BF和Rht-MR1,9个品种扩增出了256 bp的条带,用引物Rht-BF和Rht-WR1,25个品种扩增出了256 bp的条带,说明有9个品种含矮秆基因Rht-B1b。用引物Rht-DF和Rht-MR2,28个品种扩增出了283 bp的条带;用引物Rht-DF2和Rht-WR2,28个品种扩增出了273 bp的条带,说明28个品种携带矮秆基因Rht-D1b。

A:引物Intr1/D/F和Intr1/D/R4的检测结果;B:引物Intr1/D/F和Intr1/D/R3的检测结果;M:Marker DL2000;1:小偃6号;2:陕229;3:苏麦3号;4:西农979;5:西农511;6:西农529;7:矮抗58;8:周麦18;9:周麦22;10:晋麦47;11:西农389;12:陕150
A:Fragments amplified with primers Intr1/D/F and Intr1/D/R4; B:Fragments amplified with primers Intr1/D/F and Intr1/D/R3; M:Marker DL2000; 1:Xiaoyan 6; 2:Shaan 229; 3:Sumai 3; 4:Xinong 979; 5:Xinong 511; 6:Xinong 529; 7:Aikang 58; 8:Zhoumai 18; 9:Zhoumai 22; 10:Jinmai 47; 11:Xinong 389; 12:Shaan 150
图1 部分参试品种中春化基因Vrn-D1(图1A)和vrn-D1(图1B)的检测结果
Fig.1 Detection of vernalization geneVrn-D1andvrn-D1in part of the wheat cultivars

表2 参试品种各类基因型组成
(续表2 Continued table 2)
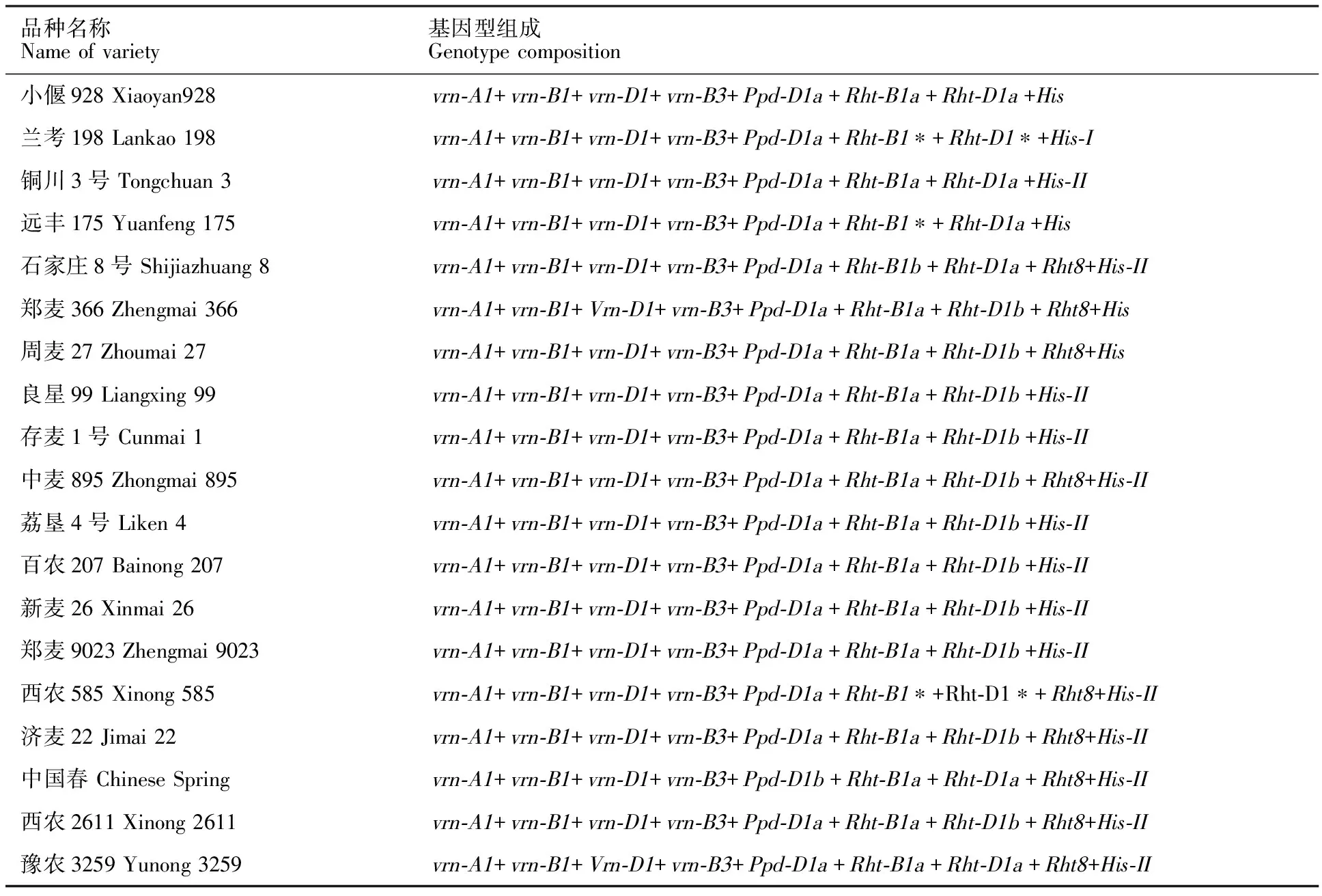
品种名称Name of variety基因型组成Genotype composition小偃928 Xiaoyan928 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1a+His兰考198 Lankao 198 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1∗+ Rht-D1∗+His-I铜川3号 Tongchuan 3 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1a+His-II远丰175 Yuanfeng 175 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1∗+ Rht-D1a+His石家庄8号 Shijiazhuang 8 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1b+ Rht-D1a+ Rht8+His-II郑麦366 Zhengmai 366 vrn-A1+ vrn-B1+ Vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+ Rht8+His周麦27 Zhoumai 27 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+ Rht8+His良星99 Liangxing 99 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+His-II存麦1号 Cunmai 1 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+His-II中麦895 Zhongmai 895 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+ Rht8+His-II荔垦4号 Liken 4 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+His-II百农207 Bainong 207 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+His-II新麦26 Xinmai 26 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+His-II郑麦9023 Zhengmai 9023 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+His-II西农585 Xinong 585 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1∗+Rht-D1∗+ Rht8+His-II济麦22 Jimai 22 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+ Rht8+His-II中国春 Chinese Spring vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1b+ Rht-B1a+ Rht-D1a+ Rht8+His-II西农2611 Xinong 2611 vrn-A1+ vrn-B1+ vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1b+ Rht8+His-II豫农3259 Yunong 3259 vrn-A1+ vrn-B1+ Vrn-D1+ vrn-B3+ Ppd-D1a+ Rht-B1a+ Rht-D1a+ Rht8+His-II
*表示未检测到目标条带,该位点基因型不明确;His表示用His-Indel标记未检测到目标条带,基因型不明确。
* indicates no target band was detected and the genotype is not clear at this site.His indicates that no target band was detected and the genotype is not clear at this site.

M:Marker DL2000;1:小偃6号;2:陕229;3:苏麦3号;4:西农979;5:西农511;6:西农529;7:矮抗58;8:周麦18;9:周麦22;10:晋麦47。
M:Marker DL2000; 1:Xiaoyan 6; 2:Shaan 229; 3:Sumai 3; 4:Xinong 979; 5:Xinong 511; 6:Xinong 529; 7:Aikang 58; 8:Zhoumai 18; 9:Zhoumai 22; 10:Jinmai 47.
图2 部分参试品种中光周期基因Ppd-D1a的检测结果
Fig.2 Detection of photoperiod genePpd-D1ain part of the wheat cultivars
用引物Xgwm261检测参试材料,38个品种扩增出192 bp的片段;用引物WMC503扩增,46个品种中扩增出225 bp的片段。其中,35个品种同时扩增出了192 bp和225 bp的片段,说明这些品种中含有Rht8。
2.4 抗赤霉病基因 Fhb1分析
用His-Indel引物对所有材料进行扩增,只有苏麦3号和兰考198两个品种扩增出1 309 bp的片段,推测这两个品种中含有抗赤霉病基因Fhb1;28个品种扩增出2 000 bp的片段,34个品种无扩增产物,推测这62个品种均不携带抗赤霉病基因Fbh1。

A:引物Xgwm261的检测结果;B:引物WMC503的检测结果;M:Marker DL2000;1:小偃6号 ;2:陕229;3:西农979;4:西农509;5:西农511;6:西农529;7:矮抗58;8:周麦18;9:周麦22;10:晋麦47。
A:Fragments amplified with primer Xgwm261; B:Fragments amplified with primer WMC503;M:Marker DL2000; 1:Xiaoyan 6; 2:Shaan 229; 3:Xinong 979; 4:Xinong 509; 5:Xinong 511; 6:Xinong 529; 7:Aikang 58; 8:Zhoumai 18; 9:Zhoumai 22; 10:Jinmai 47.
图3 部分参试品种中矮秆基因Rht8的检测结果
Fig.3 Detection of dwarf geneRht8in part of the wheat cultivars

M:Marker DL2000;1:小偃6号;2:陕229;3:苏麦3号;4:西农979;5:西农511;6:西农529;7:矮抗58;8:周麦18;9:周麦22;10:晋麦47;11:西农389;12:陕150。
M:Marker DL2000; 1:Xiaoyan 6; 2:Shaan 229; 3:Sumai 3; 4:Xinong 979; 5:Xinong 511; 6:Xinong 529; 7:Aikang 58; 8:Zhoumai 18; 9:Zhoumai 22; 10:Jinmai 47; 11:Xinong 389; 12:Shaan 150.
图4 部分参试品种中Fhb1的检测结果
Fig.4 Detection ofFhb1in part of the wheat cultivars
2.5 西农系列品种及其他骨干品种特异位点分析
通过聚类分析,发现39份材料可聚为三大类(图5),第Ⅰ类包含两个亚类(Ⅰ-a,Ⅰ-b),Ⅰ-a中的材料主要来自河南;Ⅰ-b中的两份材料均来自陕西。第Ⅱ类也包含两个亚类(Ⅱ-a,Ⅱ-b),Ⅱ-a中的材料全部来自陕西,Ⅱ-b中的材料主要来自北京、山东、甘肃、青海。第Ⅲ类中的材料主要来自河南(共15份,10份来自河南、两份来自河北、一份来自山东、一份来自山西)。分析发现,具有相似亲缘关系或具有某一骨干亲本血缘的材料聚为一类,但也有个别遗传背景不同的材料被聚到同一类中。
第Ⅱ-a中的10份西农系列品种聚到一类(图5)。其中,小偃6号是小偃22号的直接亲本;小偃6号、陕229是西农979的间接亲本,这些亲缘关系较近的品种聚为一类,表明西农系列品种具有部分相似的遗传背景,材料间基因交流频繁,各品种继承了相同的决定重要性状的位点。分析发现,这10份材料共含有相同的SNP 4 915个,其中3 866个SNP在其他类别中(I,Ⅱ,Ⅲ)也存在(图6),并不是西农系列品种所特有的,其余 1 049个SNP仅在西农系列品种中存在,为西农系列品种特有(图6),这些位点可能是决定西农系列品种区别于其他地区品种的重要遗传位点。这些特有位点主要分布在2A和6B染色体,集中于2A染色体的100~200 Mb和550~800 Mb及6B染色体的50~250 Mb和500~700 Mb附近,同时,2B、2D、3B染色体上也存在较多的特有SNP(图7、A1、A2),这些位点或区段都可以在育种中加以重视和利用。

图5 基于小麦35K芯片的聚类分析图
另外,研究发现1 445个SNP在所有参试材料中都存在,为39份材料所共有(图6)。其主要分布在2D和3B染色体,集中于2D染色体的 20~100 Mb和600~650 Mb及3B染色体的50~250 Mb和500~700 Mb附近;同时,在7A、1B、2B、3D染色体上分布也较多(图7,B1、B2)。这些SNP位点可能是育种选择或决定重要农艺性状的关键位点。除去Ⅱ-a中的10份西农系列品种,其余29份材料共含有1 676个共有SNP,这些共有位点主要分布在1B、3B和2D染色体上,集中于1B的 300~360 Mb和530~600 Mb、2D染色体的0~100 Mb和430~550 Mb、3B染色体的120~200 Mb和500~700 Mb附近(图8,C1、C2),与西农系列品种共有的SNP位点在染色体上的分布有较大差异,进一步说明位于2A和6B上的特有位点可能是决定西农系列品种区别于其他品种的重要遗传位点。
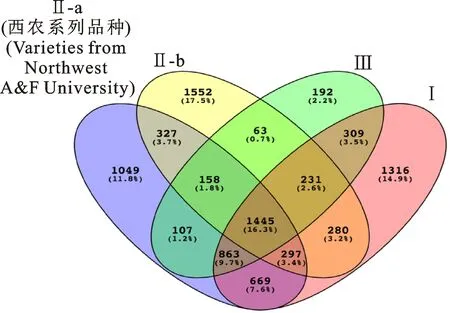
图6 类别间共有SNP分析
3 讨 论
在本研究中,供试品种中春化基因Vrn-D1分布频率最高,为20.3%,其次是Vrn-B1,频率为4.7%,而Vrn-A1和Vrn-B3则未检测到,其中,西农系列品种仅含有Vrn-D1,不含有Vrn-B1。邓更望等[13]对黄淮南片冬麦区进行分子检测,结果显示Vrn-A1、Vrn-B1和Vrn-D1的分布频率分别为0.5%、4.5%和30.8%,显性春化基因Vrn-B3在检测的材料中缺失;赵彦坤等[14]对黄淮麦区北片的主栽品种进行春化基因的检测,结果显示Vrn-D1的频率为22.9%,品种均不含Vrn-A1、Vrn-B1和Vrn-B3。不同研究中春化基因所占频率各不相同,但分布趋势一致,即Vrn-D1>Vrn-B1>Vrn-A1,而Vrn-B3则几乎不存在于黄淮麦区的主栽品种中。Vrn-D1的春化效应较弱,其单独存在时并不能使材料表现出完全春性特征,但其在半冬性及部分冬性品种中具有一定的分布频率。本研究中4 个位点均为隐性等位变异的品种(小偃6号、西农979、陕229等)主要分布在黄淮北部冬麦区,这些品种对春化作用的敏感性较强,必须经历一定的低温阶段才能由营养生长阶段进入生殖生长阶段。光周期基因对于小麦品种的适应性有很大影响。刘玉平等[15]研究发现,光周期不敏感基因Ppd-D1a能通过缩短拔节到抽穗持续的天数来缩短冬小麦的生育期,从而实现早熟高产。杨芳萍等[5]发现,光周期敏感基因Ppd-D1b主要分布在高纬度和中高纬度地区,光周期不敏感基因Ppd-D1a主要分布在中低纬度、对早熟性有要求的地区。本研究中,西农系列品种均携带光周期不敏感基因Ppd-D1a,说明西农系列品种都表现为光周期不敏感,在推广过程中对大部分地区都具有很好的适应性。

A1:西农系列品种特有SNP在各染色体上的分布;A2:西农系列品种特有SNP在2A、6B染色体上的分布及物理位置;B1:所有参试材料共有SNP在各染色体上的分布;B2:所有参试材料共有SNP在2D、3B染色体上的分布及物理位置。A2、B2中的黑点为着丝粒 位置。
A1:Distribution of specific SNPs on chromosomes of Xinong series cultivars; A2:Distribution and physical locations of specific SNPs on chromosomes 2A and 6B of Xinong series cultivars;B1:Distribution of common SNPs on chromosomes of all tested materials; B2:Distribution and physical locations of common SNPs on chromosomes 2A and 6B of all tested materials.The black dots in A2and B2are centromere positions.
图7 西农系列品种及所有参试品种间的特有、共有SNP分析
Fig.7 Characteristic and common SNP analysis of Xinong varieties and all tested varieties

C1:29份材料共有SNP在各染色体上的分布;C2:29份材料共有SNP在1B、2D、3B染色体上的分布及物理位置。C2中的黑点为着丝粒位置。
C1:Distribution of common SNPs on chromosomes of the 29 materials;C2:Distribution and physical locations of common SNPs on chromosomes 1B,2D and 3B of the 29 materials.The black dots in C2are centromere positions.
图8 29份材料(除去西农系列品种)共有SNP分析
Fig.8 Common SNP analysis of the 29 materials except Xinong ser varieties
张德强等[16]研究发现,Rht-B1b、Rht-D1b和Rht8在黄淮冬麦区的分布频率分别为 28.6%、56.5%、68.9%。本研究中,携带矮秆基因Rht-B1b、Rht-D1b、Rht8的品种分别占 14.1%、43.08%和54.7%,这些结果表明,黄淮麦区大多数品种都含有Rht-D1b或Rht8。
在本研究中,利用Fhb1的诊断性标记His-Indel进行扩增,西农系列品种未扩增出与苏麦3号一致的条带,说明这些品种不含Fhb1抗病基因,这与朱展望等[11]的研究结果一致。然而,在实际生产中,西农系列品种如西农979,表现出较好的赤霉病抗性。有研究发现,西农979含有抗赤霉病等位基因PFT-I,不含抗赤霉病位点His-I,即不含Fhb1,这可能与育种家对农艺性状的选择有关,即该区段的His-I或相邻基因可能与不利性状连锁(黄淮麦区);而PFT-I可能来自苏麦3号(PFT和His间发生重组)或小偃6号某一早代亲本,在赤霉病筛选压力较小的情况下,育种家优先考虑综合农艺性状,从而没能选择Fhb1区段抗病的单倍型;目前,已发现苏麦3号含有赤霉病抗性基因Fhb1和Fhb2,但其是否还含有其他抗赤霉病位点尚不清楚,这些未知的位点有可能会部分解释陕西材料及其衍生系具有一定赤霉病抗性的机理[11]。另外,在张玲丽等[17]的研究中,利用Fhb1紧密连锁的标记Xgwm533、Xgwm493和UMN10对西农979等进行检测,推测西农979及部分亲本含有抗病位点Fhb1,这些研究差异可能与标记类型及标记的准确性、广适性有关。刘新伦等[18]研究发现,普通小麦-十倍体长穗偃麦草衍生品种西农509、西农511 和西农529 具有较好的赤霉病抗性,携带来自于十倍体长穗偃麦草7E染色体的相关遗传区段,而该赤霉病抗性基因不同于该区段内的Fhb7。以上结果也表明西农系列品种所表现的赤霉病抗病特性机理复杂,可能不是由某一单一抗性位点决定的,这值得深入研究,为黄淮麦区赤霉病抗病育种提供支撑。
西农系列品种在黄淮麦区的生产与发展中一直占有重要地位,且在品质、抗逆性、广适性等方面优势突出。本研究发现,西农系列品种含有相同的SNP位点1 049个,且这些位点仅在西农系列品种中存在,为西农系列品种共有、特有,这些位点可能与西农系列品种优良性状的形成有一定的关系,为后续进行相关性状的关联分析提供了参考。同时,发现所有参试材料含有相同SNP 1 445个,这些SNP被不同地区、不同单位的育种家所选择、保留,可能与小麦重要农艺性状的形成相关,是决定某些性状的关键基因位点。由于本研究测试的品种数量有限,聚类后发现的共有、特有SNP数量可能偏多,后续研究会增加更全面的材料进行SNP芯片分析,为解析西农系列品种及黄淮麦区骨干品种的遗传特性及优异位点发掘提供参考。
