虾肝肠胞虫LAMP 检测技术的建立与应用
2019-11-28陈进会陈珍容刘国庆段丽萍
陈进会,陈珍容,刘国庆,陈 洵,段丽萍,谢 会,石 磊
(1.黄埔海关技术中心,广东 东莞 523072;2.四川省中江县畜牧局,四川 德阳 618107;3.暨南大学食品安全与营养研究院,广东 广州 510025)
随着对虾需求量的不断增加,国内对虾养殖业大规模扩建,存在的病害问题变得更加尖锐,直接或间接威胁到整个虾类养殖业的发展,可造成严重的经济损失。据全球水产养殖联盟调查,约40%对虾养殖病害源于细菌性和寄生虫疾病等[1]。其中,对对虾养殖业危害较严重的寄生虫疾病就包括肝肠胞虫(Enterocytozoon hepatopenaei,EHP),全名为“肠道上皮细胞微孢子虫”,属于微孢子虫目(Microsporidia)、微孢子虫科(Nosematidae)、肠胞虫属(Enterocytozoon),最初是在泰国养殖池塘生长迟缓的斑节对虾中发现[2]。与急性肝胰腺坏死病(AHPND)的暴发一样,EHP 在感染早期阶段,不会引起对虾死亡或产生其他明显症状,但会导致对虾生长缓慢。在这一背景下,对对虾病害的有效防控关系到对虾养殖业的可持续发展,将对虾病害疫情的早期快速检测作为病害防控的关键点,可提高检测效率,并在病害发生的源头加强监控,降低病害发生率和蔓延程度。
传统的形态学鉴定不适用于肝肠胞虫这一类长度较小的寄生虫,更多的是分子生物学检测方法,如普通PCR、实时荧光定量PCR 和LAMP等[3-6]。但PCR 方法在一定程度上存在操作繁杂、费时等缺点,不适用于现场检测,而环介导等温扩增无需循环变温,只需较短时间和简易仪器就能完成高灵敏度、高特异性的扩增。因此,在本研究中,根据EHP 的18S 保守区域设计LAMP 引物,从中筛选出一套扩增效率较高的引物,并优化反应体系和反应条件。该方法的特异性、灵敏度和精密度也得到了验证。通过对不同地区实际对虾样品进行检测,验证该方法用于现场检测样品的可行性,已建立的LAMP 方法可作为EHP 检测和监测的基础。
1 材料与方法
1.1 试验材料 样品来源:虾肝肠胞虫阳性样品为本实验室分离鉴定并保存。其他病原如传染性皮下和造血器官坏死病毒(IHHNV)、对虾白斑综合征病毒(WSSV)、斑节对虾杆状病毒(MBV)、虾细菌性肝胰腺坏死病毒(NHPB)、对虾杆状病毒(BP)、副溶血弧菌(VP)及南美白对虾急性肝胰腺坏死病毒(AHPND)等均由本实验室分离保存。试剂:MgSO4·7H2O、(NH4)2SO4、KCl、Tris-HCl、甜菜碱均为Sigma 公司;Tween 20、dNTPs、BstDNA 聚合酶均为天根生化科技(北京)有限公司;仪器:ABI Stepone plus 实时荧光定量PCR 仪、Nano drop 2 000超微量分光光度计均为北京赛默飞世尔生物化学制品有限公司;Gel 2000 凝胶成像仪为美国伯乐公司;多功能台式高速离心机为德国艾本德公司。
1.2 DNA 提取 副溶血弧菌核酸提取参照细菌DNA 抽提试剂盒(广州美基生物科技有限公司)说明书操作。其余病毒核酸参照水生动物病毒基因组DNA/RNA 提取试剂盒(广州双螺旋基因技术有限公司)说明书操作,并使用分光光度计Nano drop 2000 测定浓度,于-80 ℃储存待用。
1.3 LAMP 引物设计与筛选 通过对虾肝肠胞虫的分子生物学信息分析,确定18S 基因作为其检测基因,并对该基因组的同源序列进行比对,结果表明,同源性高,特异性好。使用Primer Explorer V4 软件(http://primerexplorer.jp/e/;Eiken Chemical Co.,Ltd.,Tokyo,Japan)针对对虾肝肠胞虫18S 基因保守区域共设计4 套引物(生工生物工程(上海)服份有限公司合成,HPLC 纯化)。
引物筛选实验基于相关研究的反应体系[7]。以EHP 阳性样品核酸为阳性对照(Positive Control,PC),双蒸馏水为阴性对照(Negative Control,NC)进行LAMP 扩增。反应程序为:63 ℃,30 s 预变性;63 ℃,15 s,63 ℃,45 s,60 个循环,每个循环结束后收集荧光信号;基于实时收集的荧光信号绘制熔解曲线(由65 ℃升温至95 ℃,每0.5 s 增加0.5 ℃)。
1.4 LAMP 反应体系及条件优化 为优化反应体系,对BstDNA 聚合酶浓度(U)(2.0,4.0,6.0,8.0,10.0),内外引物浓度比(μmlo/L)(0.4:0.2,0.8:0.2,1.2∶0.2,1.6∶0.2,2.05∶0.2),dNTPs 浓 度(mmlo/L)(1.0,1.2,1.4,1.6,1.8)和Mg2+浓度(mmlo/L)(5.0,6.0,7.0,8.0,9.0)进行优化。在确定LAMP 反应体系后,对反应温度优化,分别设置59 ℃、61 ℃、63 ℃、65 ℃和67 ℃。
1.5 LAMP 引物特异性检测 为确认LAMP 检测的特异性,选用传染性皮下和造血器官坏死病毒(IHHNV)、对虾白斑综合征病毒(WSSV)、斑节对虾杆状病毒(MBV)、虾细菌性肝胰腺坏死病毒(NHPB)、对虾杆状病毒(BP)、副溶血弧菌(VP)及南美白对虾急性肝胰腺坏死病毒(AHPND)基因组DNA 为模板进行LAMP 扩增。并使用TE 缓冲液为阴性对照(NC),EHP 肝胰腺提取核酸为阳性样品,质粒DNA(10 fg/μL)为阳性对照(PC)。
1.6 LAMP 检测质粒DNA 灵敏度及标准曲线绘制 首先用外引物F3 和B3 扩增含EHP 基因组的LAMP 靶区域片段。将获得的PCR 产物纯化并根据说明书克隆到pGEM-T Easy 载体(Promega,Fitchburg,W I,USA),得到重组质粒pEasy-EHP,浓度为67 ng/μL,将构建的重组质粒DNA 使用TE 缓冲液10 倍梯度稀释至1×100~1×10-7ng/μL,以此为为模板,双蒸馏水作为阴性对照(NC),进行LAMP 扩增。并根据其Ct值和初始模板质粒DNA的对数量之间的关系制作标准曲线,用于定量分析。
1.7 检出限及精密度试验 根据灵敏度试验结果,选用最低检出浓度的质粒溶液及其10 倍稀释液为模板,各重复20 次,以确定该方法的检出限。同时使用10 pg/μL 和1 pg/μL 为扩增模板,各重复30次,根据扩增曲线得出其Ct值,并计算变异系数,以确定该方法的精密度。
1.8 人工侵染样品检测 取临床检测为阴性的健康对虾的肝胰腺组织,分别加入终浓度分别为4.4 ng/μL、440 pg/μL、44 pg/μL、4.4 pg/μL、440 fg/μL 和44 fg/μL 的虾肝肠胞虫核酸。以此为模板,双蒸馏水作为阴性对照(NC),进行LAMP 扩增,每组进行2 次重复。
1.9 实际样品检测 为进一步评估LAMP 方法对现场采集样品进行诊断的可行性,用本研究建立的LAMP 方法对来自不同城市(海口,湛江,福建)的120 份对虾样品进行检测,同时使用qPCR 方法进行确认,分析两种检测结果的符合率。
2 结果
2.1 LAMP 引物筛选 根据图1 的熔解曲线图可知,EHP-2、EHP-3 和EHP-4 引物阴性对照均出现非特异性扩增,故不可用于EHP 检测。只有EHP-1 引物阳性对照在80.5 ℃有单一的熔解峰值,重复性好,不存在非特异性扩增,故选用EHP-1 引 物(F3:5′-ACTATGCCGACAATGCTG-3′,B3:5′-TAGAAGATCTCACTGGTTCCA-3′,FIP:5′-TTAAGCAGCACAATCCACTCCTGATAGTACGCTCGCAAGG-3′,BIP:5′-GCGGGAAAACTTACCAGGGTCCATGCACCACTCTTGT-C-3′,LF:5′-GGTAGTGTCCTTCCGTCAATT-3′,LB:5′-ATCGTAGATTGGAGACATGAGG-3′)用于后续试验。

图1 4 组引物熔解曲线的比较
2.2 LAMP 反应体系和条件优化 对LAMP 反应中的BstDNA 聚合酶浓度、内外引物浓度比、dNTPs浓度、Mg2+浓度、反应温度等因素进行优化,结果表明,最佳反应体系下BstDNA 聚合酶浓度为8 U,浓度过低会减慢链置换反应速度;内外引物浓度比为1.6∶0.2,内引物浓度过高会增加了引物之间形成二聚体的机会,引起错配和非特异性扩增;dNTPs 浓度为1.6 mmol/L,Mg2+浓度为8 mmol/L,过低会降低BstDNA 聚合酶的活性,影响扩增效率[8-10]。反应温度在63 ℃和65 ℃,扩增效率几乎一致,为节省能耗,选择63 ℃为LAMP 反应温度。
2.3 LAMP 特异性检测 LAMP 特异性试验表明,除了EHP 质粒DNA 外,只有EHP 阳性样品能够产生特异性扩增(见封二彩版图2)。而IHHNV、WSSV、MBV、NHPB、BP、VP 及AHPND 等不含靶区域的核酸在扩增45 min 内均没有出峰。说明本文所建立的LAMP 方法对EHP 具有高度的特异性,可将EHP 与其他常见对虾病害很好地进行区分。
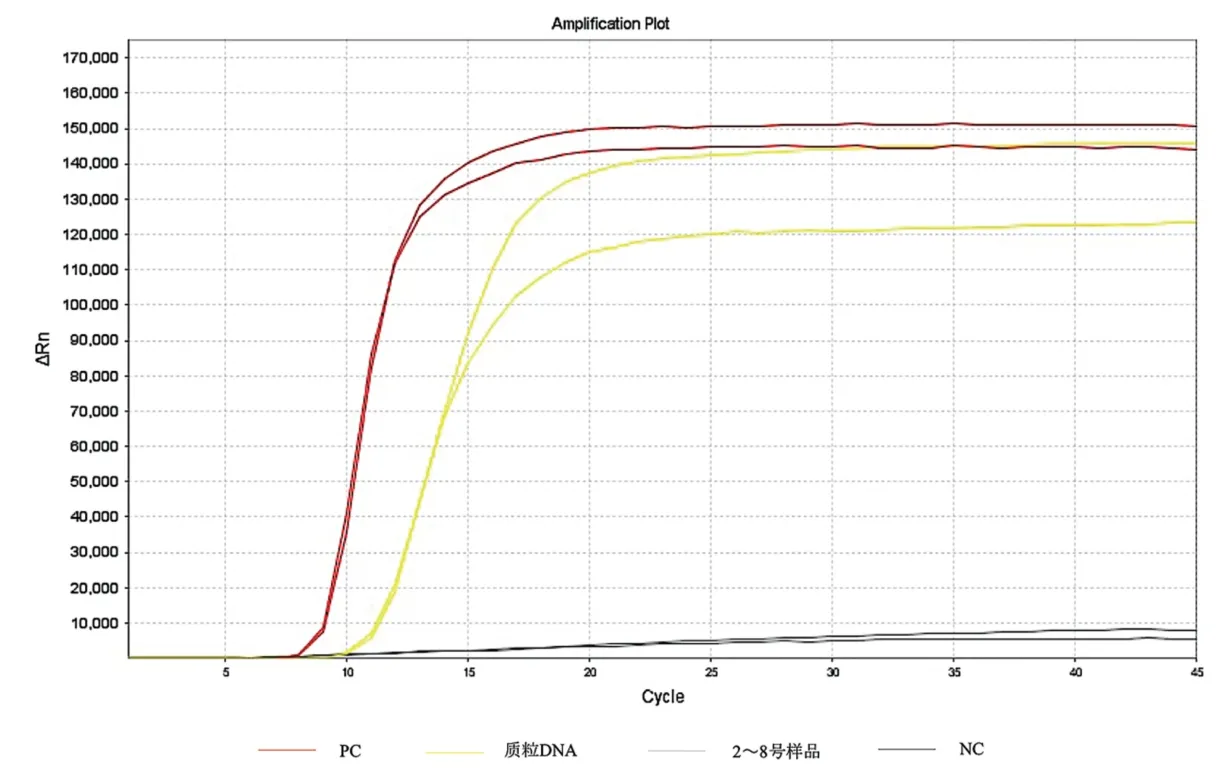
图2 LAMP 特异性检测
2.4 灵敏度验证及标准曲线分析 采用优化好的LAMP 反应体系和条件进行扩增,以1×100~1×10-7ng/μL 质粒DNA 为模板,结果如封二彩版图3所示,LAMP 在质粒浓度为1×100ng/μL~1×10-5ng/μL 范围内均可对虾肝肠胞虫进行检测,且在45 min内即可完成检测,说明此方法检测EHP 的灵敏度较高。检出限的验证试验结果表明,20 组浓度为10 fg/μL的质粒DNA 全部检出,而1 fg/μL 质粒DNA 均未检出。因此,确定其检出限浓度为10 fg/μL质粒DNA。根据其Ct值和初始模板质粒DNA 的对数量之间的关系制作标准曲线(R2>0.98,P<0.05),表明其满足定量检测的线性要求(图4),并且根据绘制的标准曲线,只需要得到目的基因的Ct值,就可以通过标准曲线计算出EHP的含量,实现对EHP 的定量检测。
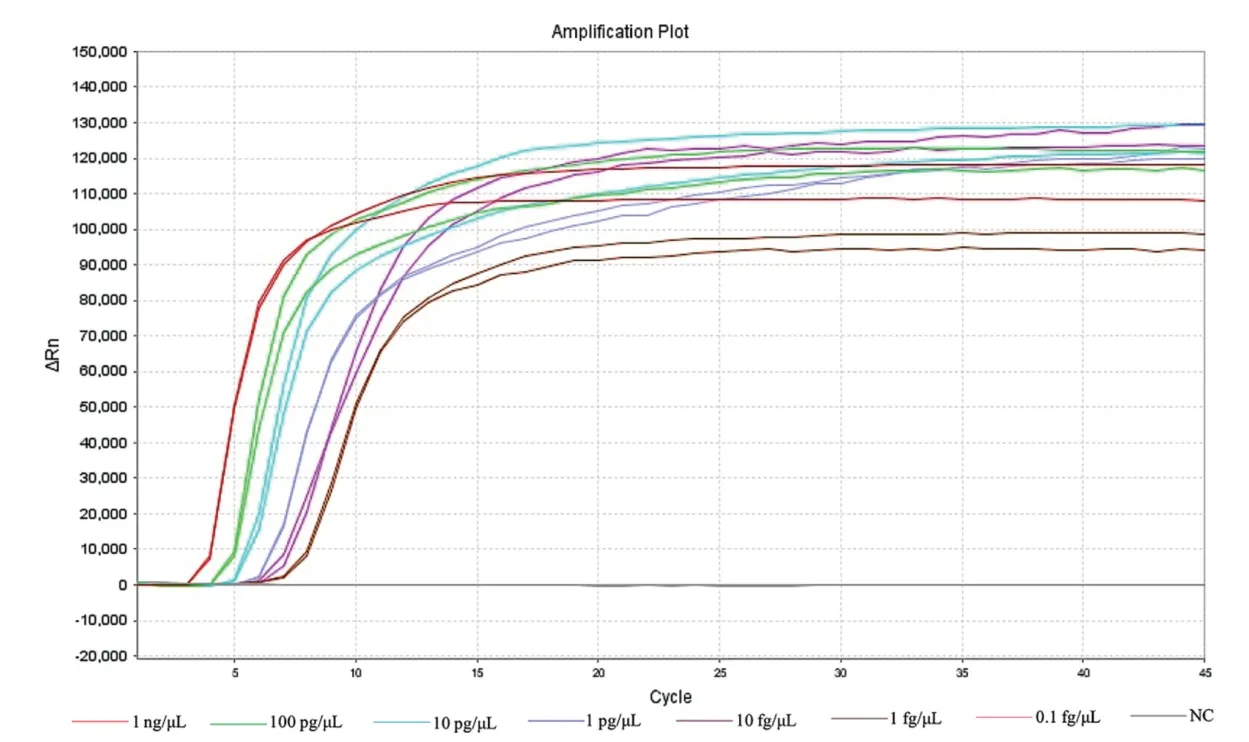
图3 LAMP 灵敏度检测

图4 标准曲线
2.5 LAMP 精密度验证 由封二彩版图5 可以看出,两个浓度均可全部检出。两个浓度梯度下扩增Ct值,变异系数分别为2.88%(10 pg/μL)和3.02%(1 pg/μL),满足变异系数≦5%的要求,误差在可接受范围内。表明建立的LAMP 检测方法具有良好的重复性,扩增结果稳定可靠。
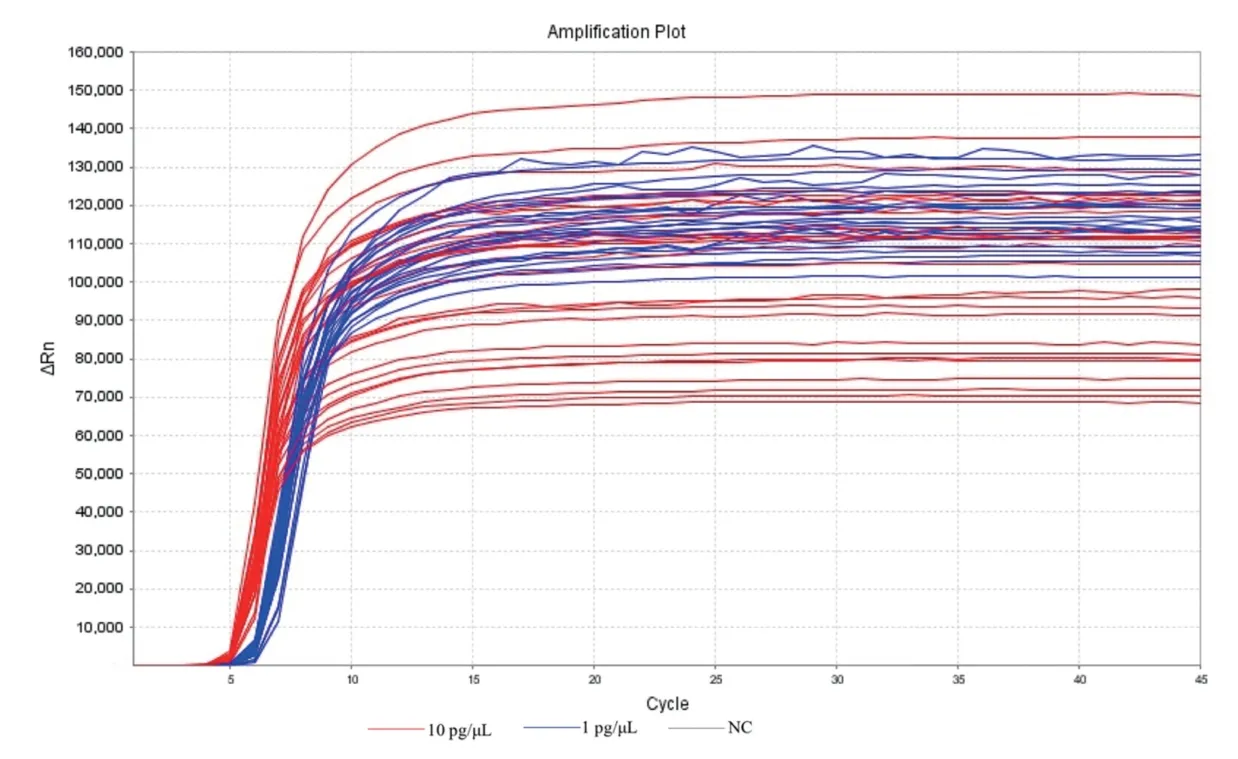
图5 LAMP 精密度检测
2.6 LAMP 检测人工侵染样品灵敏度 对于人工侵染的虾肝肠胞虫样品检测结果见表1,表明LAMP 在模板浓度为4.4 ng/μL~440 fg/μL 内均可检出,LAMP扩增的最大Ct值为13.6。说明本文所建立的LAMP 检测方法用于检测EHP 具有较高灵敏度。
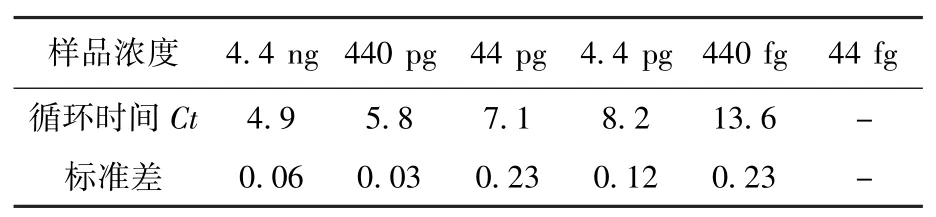
表1 LAMP 检测EHP 灵敏性分析
2.7 实际样品检测 用建立的LAMP 方法与qPCR对120 份样品进行检测,结果见表2。LAMP 的阳性检出率为36%,二者检测结果符合率为97%,且LAMP 相对于qPCR 方法操作更加简单,说明该方法可用于在养殖场对虾肝肠胞虫进行监测。

表2 LAMP 与qPCR 检测临床样品的结果比较
3 讨论
在全国对虾产量不断下降的趋势下,中国对对虾的需求量却逐年增加[11],但对虾病害发生的频率和范围也在不断扩大,检出率也逐步上升。EHP 感染对虾可导致对虾生长缓慢,繁殖速度降低,给对虾养殖业造成巨大的经济损失。第九届中国对虾产业发展研讨会指出:“肝肠包虫在未来很可能成为危害对虾养殖业的首要病害”,且对虾受EHP 感染后,很难彻底消除[12],因此对对虾病害的早期检测及实时监测显得尤为重要,在染病早期发现并确定病原,就能有效采取防治措施,减少损失。
LAMP 检测技术具有特异性好、灵敏度高、操作简单、成本低等特点而被广泛用于水产病害的检测。本研究根据EHP 的18S 基因共设计4 套LAMP引物进行筛选,得到最佳引物EHP-1,并对反应体系中的BstDNA 聚合酶浓度、内外引物浓度比,dNTP浓度,Mg2+浓度和反应温度进行优化试验,最终确定了适用于检测虾肝肠胞虫的LAMP 体系和条件。25 μL 反应体系包括:12.5 μL LAMP 反应缓冲液[缓冲液中各组分最终浓度为1.6 mmol/L dNTPs,1 mol/L 甜菜碱,6 mmol/L MgSO4,20 mmol/L Tris-HCl(pH 值8.8),10 mmol/L KCl,10 mmol/L(NH4)2SO4,and 0.1% Triton X-20,0.1% Triton X-20(Sigma-Aldrich Inc.,Saint Louis,M O,USA),广州双螺旋基因技术有限公司],0.2 μmol/L SYTO-9 fluorescent dye(Invitrogen,Carlsbad,CA,USA),1.2 μmol/L FIP/BIP,0.2 μmol/L F3/B3,1 对环引物LoopF 和LoopB 的浓度均为0.8 μmol/L,6 UBstDNA 聚合酶,2 μL 模板DNA。反应温度为63 ℃,最短反应时间为30 min。此外,本试验所提出的LAMP 方法对传染性皮下和造血器官坏死病毒(IHHNV)、对虾白斑综合征病毒(WSSV)、斑节对虾杆状病毒(MBV)、虾细菌性肝胰腺坏死病毒(NHPBV)、对虾杆状病毒(BPV)、副溶血弧菌(VP)及南美白对虾急性肝胰腺坏死病毒(AHPNDV)组织样品等没有交叉反应,说明具有良好的特异性。该方法可检测浓度为1×100ng/μL~1×10-5ng/μL 的质粒DNA,最低检出限为10 fg/μL 的质粒DNA,灵敏度较高,制作的标准曲线可用于对虾肝肠胞虫定量分析。而对于人工侵染的虾肝肠胞虫样品,LAMP 方法可检测低至440 fg/μL,敏感性较高。重复性试验结果中变异系数为2.88%~3.02%,说明该方法具有良好的重复性。应用建立的LAMP 方法对3 个不同地区的凡纳滨对虾样品进行检测,检测结果显示,EHP 阳性检出率达36%,说明该地区对虾已受虾肝肠胞虫污染,检测结果与qPCR 符合率为97%,说明该方法可用于在养殖场对虾肝肠胞虫进行监测,具有良好的应用前景。综上所述,本试验开发的LAMP 检测方法可对EHP 的早期诊断提供有效指导,避免病害进一步发生,同时也是致病机理研究等相关研究工作的重要辅助手段。
