AMG 510只是攻克RAS的一小步(二)
2019-11-28谢雨礼
文/谢雨礼
(谢雨礼,毕业于南开大学化学系,取得中国科学院上海药物研究所博士学位,在哥伦比亚大学从事博士后研究工作。2017年4月,创办苏州偶领生物医药有限公司,致力于创新化药的研究和开发)
RAS的不可成药性和药物开发的探索
为什么RAS难以成药呢?首先,RAS各个亚型的D-domain高度类似,直接靶向RAS很难达到高度选择性。第二,小分子药物最常见的是抑制酶的活性,但RAS比较特殊,GTP水解酶与其功能反相关,需要开发酶的激活剂。第三,药物分子无法与底物竞争,因为RAS与GTP的亲和力常数达到皮摩尔级别,而细胞中GTP的浓度高达0.5mM。第四,除了不可逾越的核苷酸口袋,RAS蛋白其他地方缺乏有利于小分子结合的口袋。第五,RAS的调控和功能执行都是通过蛋白—蛋白的相互作用实现的,很难通过小分子干预。这些蛋白相互作用发生在细胞膜内,单抗等大分子难以触及。
由于这些原因,制药界早期将注意力转移到RAS的高度可变区(HVR)。HVR是RAS用来定位细胞膜的区域,末端包含CAAX系列。RAS蛋白合成后,要进行一系列修饰才能进入细胞膜。CAAX系列的Cys被异戊烯化后,AAX被转化酶RCE1切除,最后Cys的羧基被甲基转移酶ICMT所甲基化。细胞膜定位对于RAS的功能至关重要,其调节蛋白如GEFs,GAPs以及各种效应蛋白都依赖细胞膜移位进行调控。让人没想到的是,抑制RCE1和ICMT有时反而促进肿瘤的发生,原因还不太清楚。其实,抑制RAS通路的某个环节造成反向激活还比较常见,比如Raf和MEK抑制剂中都发现了类似的现象,这也是RAS药物开发的一个难点。
开发RAS异戊烯化抑制剂的探索就要曲折得多。早在1989年,美国西南医学中心的科学家就发现法尼基转移酶(FT)介导的异戊烯化是RAS活性所必需的。FT抑制剂对RAS变异肿瘤有效且安全性可接受。基于这些研究,FT抑制剂被推上了临床,但临床结果不理想,对于占大多数的KRAS和NRAS病人无效。回头分析,这里有一个“坑”当时被忽视了。前面提到,HRAS是第一个被发现的RAS肿瘤基因,FT抑制剂早期工作都是基于HRAS突变展开的。不幸的是,RAS亚型的异戊烯化有所差异。FT被抑制后,KRAS和NRAS能够通过GGTase1异戊烯化所弥补,而HRAS却不能。这样,FT和GGTase1抑制剂联用才能有效抑制KRAS和NRAS突变的肿瘤,但也容易产生不可耐受的毒副反应。目前,FT抑制剂用于HRAS突变的病人仍在进行临床研究。今年9月,Kura公布了FT抑制剂tipifarnib的一个临床结果:在13名携带HRAS突变的难治或是复发的膀胱癌病人中,ORR达到38%。异戊烯结合蛋白PDEδ是RAS细胞内外膜之间穿梭运输的重要伴侣蛋白。2013年,德国马克斯—普朗克研究所的科学家报道了第一个KRASPDEδ蛋白相互作用的小分子抑制剂Deltrasin,随后又报道了毒性更小的Deltazinone,这些化合物可以有效抑制KRAS驱动的胰腺癌。这一靶点迅速成为RAS药物研究的热点,但还未有临床研究数据报道。
干预RAS细胞膜定位的药物开发至少目前来看还不算成功。近年来,随着共价、变构、蛋白蛋白相互作用、PROTAC等小分子新技术的发展,RAS直接抑制剂又回到了人们的视野。1997年,Schering-Plough报道了第一个直接抑制RAS的小分子化合物。此后,大量RAS抑制剂被相继报道,包括合成小分子、天然产物和多肽模拟分子,这些分子主要靶向RAS核苷酸交换,RAS-SOS和RAS-Raf相互作用等。还有Sulindac和Rigosertib等老药或临床化合物也发现直接作用于RAS。这些早期工作中,最受关注的是RAS-SOS抑制剂。SOS是最常见的GEF,如前所述,抑制GEF干扰GTP的结合。基因泰克2012年报道了通过NMR技术和Fragment-based技术发现的RAS-SOS小分子抑制剂DCAI,但这些化合物活性不高,而且随后的研究发现RAS-SOS抑制剂也存在负反馈激活的问题。2019年,Bayer报道了一类通过双向筛选获得的KRAS G12C-SOS1抑制剂,稳定KRAS-SOS1复合物同时抑制SOS1活性,活性达到纳摩尔级别,且可以与G12C抑制剂联用。
KRAS G12C抑制剂的开发
早期报道的RAS抑制剂由于各种原因,都没有继续开发,这也是RAS得到“不可成药”这个名声的主要原因。精准医学兴起后,药物开发更加强调靶向肿瘤细胞特有的变异。RAS具有重要的生理功能,KRAS生殖突变的老鼠不能成活。RAS调节因子变异造成一组统称为RASopathy的罕见病,仅NF1(GAP蛋白)变异,全球就超过10万名病人。因此,避开正常细胞,特异性靶向肿瘤细胞RAS变异可能带来较少的副作用。然而,前面提到RAS变异主要是G12、G13和Q61三个位点,可逆竞争性的小分子药物要区分野生型和变异蛋白的结合口袋非常困难,更别提RAS蛋白上就没有什么适合小分子结合的口袋。EGFR和BTK等基于半胱氨酸(Cys)共价结合的不可逆抑制剂的成功,让KRAS G12C脱颖而出成为RAS变异的理想靶点。首先,G12C是第三大常见的RAS变异,特别是在非小细胞肺癌和肠癌中排在第一位,每年新发G12C肿瘤病人接近3万人;其次,变异产生的Cys可以成为不可逆抑制剂进攻的目标,减少对结合口袋的依赖;再次,Cys不可逆抑制剂已经证明可以获得相对较高的特异性;最后,G12C位于SWI、SWII以及P-loop三方交界的区域,抑制G12C可能对RAS构象和活性产生重要影响。2013年UCSF的Shokat实验室在Nature上报道了通过“Tethering”技术发现的第一个G12C抑制剂。“Tethering”技术由同在UCSF的Wells James教授开发,基本原理就是针对含有Cys的靶点,利用双硫键的小分子碎片库进行筛选。双硫键与Cys的巯基发生交换后,小分子碎片就会通过Cys连接在蛋白上。这些悬挂在蛋白上的碎片很容易被随后的还原处理所清除,而那些在Cys附近找到结合口袋躲避的碎片就会生存下来。筛选了480个双硫化合物后,Shokat等人找到了两个Hits,其中一个就是6H05。随后开发这个项目的Wellspring公司进行了一系列优化,得到更为有效的先导化合物ARS-853。详细研究发现,这类化合物只能作用于GDP结合的RAS,化合物与G12C共价连接在Switch II下面诱导了一个此前不存在的变构口袋S-IIP。这造成了两个后果:RAS与GDP的亲和力增加,不易转向GTP构象;抑制了GEF催化的核苷酸交换。简单地说,就是将RAS锁在了非活性状态。新的G12C抑制剂在体内外肿瘤模型上都展现了很好的剂量关系和可预测的在靶活性。
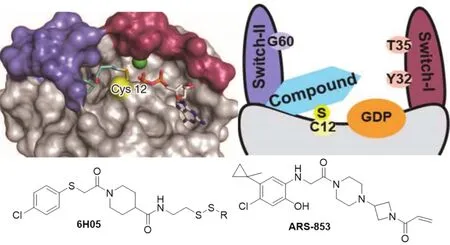
第一个KRAS G12C抑制剂的发现
对于制药公司来说,原创研究到此就基本够了。但细细思考,还是有些让人不解的地方。第一个就是,肿瘤细胞中变异的RAS主要以GTP结合的激活状态存在,而这些G12C抑制剂只能靶向GDP结合的KRAS。第二个疑问是,共价抑制剂首先要与靶点有较强的结合,才能特异地与目标位置的Cys快速反应;而G12C抑制剂与S-IIP口袋结合比较弱而且是事后诱导的。对于第一个问题,纽约MSKCC的Neal Rosen教授2016年在Science发表文章,提出了一个“Trapping”的作用机制。他们认为KRAS G12C类似于野生型,也存在GTP/GDP循环,因为G12C内在的GTPase活性并没有下降。因此,RAS突变不是原来认为的一直处于完全锁死的激活状态,而是一种在接收刺激信号后“hyperactive”的状态。这样,G12C抑制剂不断将RAS蛋白trap在GDP状态而消耗GTP结合的RAS。这实际上是一个平衡反应,因此这类抑制剂需要较长的作用时间。这个发现对G12C抑制剂的临床应用是有重要指导意义的。因为药物的作用是拉动一个平衡反应,也许需要较大的剂量,对于药物的安全性要求比较高。另外,RAS突变仍有GTP/GDP循环,也就是仍然受到各种信号的调控,这样为G12C抑制剂与其他药物,如EGFR抑制剂的联用提供了可能。
对于第二个问题,2018年Wellspring Biosciences的科学家发表了一项详细研究。文章认为G12C抑制剂与传统的共价抑制剂不同,它们与Cys的结合不是亲和力驱动的,而是由化合物与Cys的高反应性驱动的。令人费解的是,这些化合物以及G12C中的Cys,内在的反应性都很低,这也是为什么这类化合物的特异性非常好的原因。那问题是,这个特异的高反应性从哪里来的?晶体结构显示,是因为G12C附近的赖氨酸Lys16质子化后,可以稳定Cys共价反应的过渡态,起到自催化的作用。另外,由于GTP的gamma位磷酸可以干预Lys16的作用,可能是G12C抑制剂只能作用于GDP结合的RAS的原因之一。比较有意思的是,基于GDP结构设计的,以结合力驱动的G12C共价抑制剂比如SML-8-73-1系列反而没有取得理想的效果。这个案例显示,一个非常浅、动态的临时诱导的结合口袋,虽然无法为小分子提供足够的亲和力,也能通过“高反应性”驱动的共价抑制剂有效抑制,这为小分子共价抑制剂在其他所谓“不可成药”靶点的应用提供了无限的遐想。
RAS抑制剂巨大的商业前景,G12C扎实的基础研究和有说服力的前期数据,在制药界激发了一股开发G12C抑制剂的热潮,几乎每个月都有新的专利公开。进展最快的就是已经公开一期临床数据的安进,Wellspring和Mirati等公司的产品也已进入临床。其他大公司比如Pfizer、AZ都在跟进,国内的fast-follow也是争先恐后。
G12C抑制剂开发的潜在风险
KRAS G12C抑制剂的初步成功,无疑是令人兴奋的。让人们重新认识了RAS生物学,发现RAS突变不是持续激活,而是“hyperactive”。化学上展示了小分子共价抑制剂既可以通过亲和力驱动,也可以是反应性驱动,为这类药物的应用拓展了空间。但RAS还有太多的未解之谜和挑战,AMG510的成功只是攻克RAS难题的一小步。即使是G12C抑制剂,还有许多未知的东西,给其开发前景带来不确定性。由于化合物作用于平衡反应,可能需要较大剂量,AMG510效果较好的剂量达到960mg,这对药物的安全性要求比较高。另外,肿瘤进展各阶段的DNA分析发现,KRAS变异在肺腺癌和胰腺癌肿瘤内部异质性较小,而在肺鳞癌和肠癌中KRAS变异出现较晚,含有KRAS突变的肿瘤细胞可能只是其中的一个“亚克隆”。这预示RAS变异对药物的敏感度可能与肿瘤类型高度有关。AMG510目前来看在肠癌中的临床效果比较差,似乎验证了这些基础研究的结果。分子靶向药物出现耐药被认为是难以避免的。AMG510作为KRAS直接抑制剂,刚开始临床研究,是不是容易耐药还难以判断。不过,安进公开的临床数据显示,在15周时间内,11名PR病人已有2名发生疾病进展,其中1人死亡。这也许是为什么AMG510一期数据公开后,安进的股票没涨反而是下跌。基础研究给出的信号也不太好。比如,体外试验发现肿瘤细胞对KRAS变异的依赖程度与细胞的生长条件高度相关,3D培养的细胞对G12C抑制剂的敏感程度大于2D培养。这让人担心肿瘤微环境的调整即可轻松摆脱对KRAS的依赖。2014年的一篇研究报告显示,胰腺癌细胞通过激活Yap1,可以克服对KRAS依赖。还有就是RAS是否存在二聚或者多聚的情况在学术界还有较大争议,但这也可算作机制不明确的风险。RAS通路的RAF蛋白就是通过二聚产生抑制剂诱导的反向激活。
RAS药物开发的展望
首先,考虑靶向其他RAS突变,比如最常见的G12D和G12V。因为这类蛋白缺乏合适的Cys或者其他非天生的可共价结合的氨基酸,要取得足够的活性和选择性比较困难。BI在今年8月报道了一个纳摩尔活性的,结合在Switch区域的非共价抑制剂BI-2852。机制上不同于G12C抑制剂,这个化合物可以同时抑制活性和非活性状态RAS,且不限于G12C。令人遗憾的是,细胞测试上活性不高,而且出现了类似于Braf抑制剂的反向激活的老问题。另外,药物联用是克服耐药和提高疗效的一个常用办法。临床前研究表明,KRAS变异对肿瘤免疫疗法比较敏感,特别是P53共变异的病人。AMG510与PD-1单抗联用的临床研究即将展开,让我们拭目以待。KRAS抑制剂与RAS通路上其他药物的联用也值得探索,比如EGFR、Braf、MEK、PI3K,以及SHP2抑制剂等。寻找与RAS变异合成致死的药物,最近的例子有XPO1抑制剂和铁死亡诱导剂等。随着新技术的发展,人们也将眼光转向了其他非小分子药物形式,比如siRNA、细胞内单抗碎片等。用于RAS蛋白降解的PROTAC也有不少专利公开。这些研究都是很好的尝试,但离真正的临床应用还有很长的路。比较有意思的是,细胞治疗的权威Rosenberg最近在NEJM上报道了一例针对KRAS G12D的TIL疗法。经过G12D特异和HLA-C*8:02等位基因限制的T细胞治疗,一个50岁的带有肺转移的女性肠癌患者取得了9个月的PR。然而,HLA-C*8:02的广泛性如何还有争议,有专家认为非常罕见。
在新药难觅的今天,RAS直接抑制剂的突破,哪怕是一小步,也让人无比欣慰。中国创新药这两年经历了比较大的起伏,向原创新药转型的呼声日益高涨。KRAS G12C抑制剂的开发也许能给我们稍许启示。基础研究确实是原创新药的基础,但能否或多长时间能导致新药的发现却未可知。RAS从20世纪60年代发现,经历了50多年,其中对其生物学有贡献的基础研究数以千计,作为一个潜在的靶点是十分明了的事情,但直到2013年,Shokat实验室才找到了第一个具有成药性的直接抑制剂。Shokat的大胆尝试很重要,但我认为,突破的关键是其UCSF同事Wells James教授开发的“Tethering”技术。这个技术在2000年发表后,一直默默无闻,看似没有什么用处。这说明药物创新的生态环境多么重要,不是单打独斗可以实现的。从商业的角度看,Shokat帮助建立的Wellspring公司应该是原创,但是很快被fast-follow的安进公司超越,大概率AMG510将成为第一个上市的G12C抑制剂。所以,在中国新药研发转型的关键时期,各方应该静下心来做自己擅长的事情,无论是基础研究,仿制还是原创,营造药物创新良好的生态。真正的原创新药可能没有什么路径,也没有什么时间表,事情做好了,就水到渠成了。
