LCMS-IT-TOF测定不同脂肪酸结构食用油中的羰基化合物
2019-11-27陈倩媛俞文韬
江 鑫,陈倩媛,俞文韬,胡 妍,曹 君
(海南大学食品科学与工程学院,海南海口 570228)
食用油是指在制作食品过程中使用的植物或动物油脂,由于受到原材料、加工工艺的限制,常见的食用油多为植物油,其中包括菜籽油、花生油、玉米油、葵花籽油、亚麻籽油、紫苏油、橄榄油、油茶籽油、大豆油、芝麻油等。在人们日常生活中,食用油不仅在食物增加色、香、味上起到重要作用,还是人体不可缺少的营养来源之一。其中甘油三酯是油脂中最重要的营养物质,甘油三酯可以在体内脂肪酶的作用下发生水解,最终得到甘油和各种脂肪酸[1]。脂肪酸可以按饱和程度分为三类,分别是饱和脂肪酸(saturated fatty acid,SFA)、单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)[2]。经营养学和临床医学研究表明,不饱和脂肪酸在维持人体健康方面起着重要的作用[3]。
在食用油加热过程中,由于长时间高温处理食用油中的甘油三酯会发生氧化、水解、聚合等一系列反应,导致其品质下降,甚至产生对人体有害的成分[4]。其中羰基化合物是一种重要的二级氧化产物,它可以作为食用油品质的一个重要指标[5]。研究表明,醛酮类化合物对人的眼睛、皮肤和呼吸道有着强烈的刺激作用,而且甲醛和乙醛已被确认是致癌物或可疑致癌物。其它长链的醛酮类物质是一些风味物质,并被列为一种可以添加的食用香精,如己醛、庚烯醛、辛醛、壬醛、癸二烯醛等,但这些物质大多数阈值较低[6],其含量一旦超过某个阈值就会产生令人不愉快的气味[7],甚至会对人体产生一些未知的危害。与此同时,在食物中羰基化合物的主要来源就是油脂[8],油脂中所产生的活性羰基化合物很可能与其它物质发生反应,形成不同的化合物,包括Strecker醛[9]、丙烯酰胺[10]、杂环胺[11]等,这些变化可能对食品具有很多负面的影响[12]。目前国内对此类二级氧化产物的研究并不多,多数研究都是针对油烟中挥发性醛、酮对室内空气污染的研究,对于残留在油脂中的醛酮类化合物关注较少,因此对醛类及其相关的羰基化合物的研究是十分必要的。想要研究这些羰基化合物,首先要对其进行定性和定量分析,根据国内外的一些相关文献,比较常用的测定羰基化合物的方法有分光光度法[13]、气相色谱法[14]和高效液相色谱法[15]。
本实验对加热前后油茶籽油、玉米油和亚麻籽油的油样进行甲酯化处理,再采用气相色谱法对每种食用油的脂肪酸含量和变化进行测定,对加热后的油样进行2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)衍生化处理,再采用LCMS-IT-TOF进行测定分析,该方法相对简单、有效,可以获得优异的分离效率和特定信息[16]。本文希望通过实验得到高温下油酸、亚油酸和亚麻酸形成的特征性醛酮,为建立一种新的油脂氧化程度的评价方法提供参考;并对希望通过研究加热处理后食用油中脂肪酸含量变化和生成羰基化合物的种类的关系,探究脂肪酸种类对生成羰基化合物种类的影响,为推测羰基化合物的形成过程提供理论支持。
1 材料与方法
1.1 材料与仪器
油茶籽油、玉米油及亚麻籽油 当地超市;正己烷、甲醇、乙腈 色谱纯,美国Fisher公司;GLC-463脂肪酸甲酯混标 标准品,美国Nu-Chek-Prep公司;乙酸甲酯、无水甲醇、甲醇钠、草酸、无水硫酸钠、浓盐酸、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、二氯甲烷、二甲基硅油 均为国产分析纯。
Agilent 7890A气相色谱仪(配有全自动进样器与FID检测器) 美国安捷伦公司;高效液相色谱-离子阱飞行时间质谱仪(LCMS-IT-TOF) 日本岛津公司;TDL-5-A型低速离心机 上海安亭科学仪器;XO-5200DTD型超声波清洗机 南京先欧仪器制造有限公司;SHA-B型双功能水浴恒温振荡器 江苏金坛亿通电子有限公司;DSY-VI型水浴氮吹仪 北京东方精华苑科技有限公司;ME104E型精密天平 METTLER TOLEDO;XW-80A型漩涡振荡器 海门市其林贝尔仪器制造有限公司;SZ-6B型单缸电炸炉 佛山市思博诗电器有限公司。
1.2 实验方法
1.2.1 油脂加热实验 日常烹饪过程中180 ℃也是较为常用的煎炸温度,为使食用油充分氧化得到较为全面的羰基化合物种类,选择加热24 h的油样进行测定。取新开封的油茶籽油、玉米油和亚麻籽油各500 mL,分别加入不锈钢容器内,置于装有二甲基硅油的可控温电炸炉中,在180 ℃硅油浴中加热24 h,取出50 mL油样装入50 mL带盖离心管中进行快速冷却,待冷却至室温,置于-18 ℃冰箱中保存待用,所测指标需在一周内测完。
1.2.2 脂肪酸含量测定
1.2.2.1 样品的甲酯化 采用碱法甲酯化[17]:取适量油样加入1.5 mL的正己烷和40 μL乙酸甲酯,再加入100 μL甲醇钠-甲醇溶液,在37 ℃下反应20 min,然后置于-20 ℃下冷冻10 min,取出后迅速加入60 μL的草酸乙酸甲酯溶液,离心(3600 r/min,5 min)取上清液,将适量上清液用无水硫酸钠柱(除去其中的水分)过滤至进样瓶中,氮气吹干,加正己烷进行复溶,进行气相色谱分析。
1.2.2.2 气相色谱条件 检测器:FID检测器;进样量:1 μL,自动进样;色谱柱:CP-Sil 88熔融石英毛细管柱(100 m×0.25 mm,0.2 μm);进样口温度:250 ℃;程序升温:45 ℃时保持4 min,然后以13 ℃/min的升温速率将温度升至175 ℃保持此温度27 min,后以4 ℃/min的升温速率将温度升至215 ℃保持35 min,总测定时间为86 min;检测器温度:250 ℃;氢气流速为30 mL/min;空气流速为300 mL/min,氮气流速为30 mL/min,压力:24.52 psi;总流量:29.4 mL/min[18]。脂肪酸分析采用Agilent Chemstation软件对气相色谱数据进行分析处理,以脂肪酸甲酯标准品为对照,采用面积百分比法确定脂肪酸的百分含量(以峰值面积的百分比表示)。
1.2.3 羰基化合物的LCMS-IT-TOF分析
1.2.3.1 DNPH反应液的制备 参考Cao的方法[19],称取0.3 g DNPH晶体,先加入10 mL甲醇溶解,再加入3 mL 6 mol/L HCl溶液混匀,超声(200W)5 min,用甲醇定容到100 mL容量瓶中,盖紧,静置,待用。

表2 三种食用油脂肪酸组成变化情况(%)Table 2 The changes of three kinds of fatty acid composition(%)
注:“-”表示未检出;SFA,Saturated fatty acids,饱和脂肪酸;PUFA,Polyunsaturated fatty acids,多不饱和脂肪酸;MUFA,Monounsaturated fatty acids,单不饱和脂肪酸;同一行不同小写字母表示有显著性差异,P<0.05。1.2.3.2 样品的衍生化 根据Seppanen的方法[20]进行改良,称取适量氧化后油脂放入10 mL的具塞试管中,加入DNPH反应液2 mL,涡流使之充分接触,然后置于40 ℃的水浴恒温振荡器中,充分振荡反应1 h。反应结束后,取出样品冷却至室温,加入2 mL甲醇-水(75∶25,v/v)溶液涡流混匀,置于离心机中,4200 r/min离心5 min,取上层甲醇层,重复上述步骤,反复提取3次,合并上层液体,加入适量二氯甲烷进行萃取,取二氯甲烷层用氮气吹干,加2 mL乙腈定容,取1 mL样品通过0.22 μm的有机滤膜进入进样瓶中,进行液相色谱分析。
1.2.3.3 LCMS-IT-TOF对样品中羰基化合物的定性分析 液相色谱条件:色谱柱Water ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);柱温40 ℃;流速0.3 mL/min;进样体积:1 μL;流动相A:甲醇溶液,流动相B:超纯水;梯度洗脱条件见表1;二极管阵列检测器扫描波长270~500 nm,最终选择检测波长为360 nm。
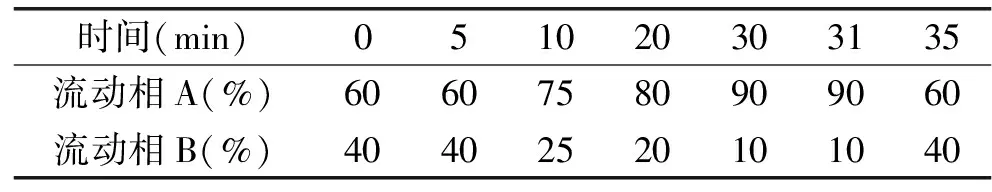
表1 LCMS-IT-TOF的梯度洗脱条件Table 1 Mobile phase gradient elutionconditions of LCMS-IT-TOF
MS条件为:ESI离子源,正离子和负离子扫描,质量范围150~400 Da。雾化气(Nebulizing Gas)流速:1.5 L/min;检测电压(Detector Volta):0.5 kV;曲线脱溶剂管(CDL)和加热模块(Heat Block)温度:200 ℃;RP真空度:97 Pa;TOF真空度:4.1×10-4PA。对主要色谱峰物质进行精确质量数分析,并结合相关文献[21]数据比对进行化学成分确认。
1.2.4 统计分析 实验进行至少3个平行,数据以均值±标准偏差(mean±SD)的形式表达。One-way ANOVA用来比较数据间的显著性差异,并用 Duncan’s进行多重比较,P<0.05则表示数据间有统计学差异。采用SPSS 20.0对实验数据进行单因素方差分析,采用Origin 8.5软件绘图。
2 结果与分析
2.1 脂肪酸组成的变化
将未加热和加热后的样品进行甲酯化后,进行脂肪酸含量测定,通过面积百分比法对3种植物油的脂肪酸组成和变化进行了分析和比较,见表2。
从表2中可以看到,油茶籽油、玉米油和亚麻籽油含有的主要脂肪酸分别是油酸(C18∶1)、亚油酸(C18∶2)和亚麻酸(C18∶3)。油茶籽油含油酸高达79.08%,其次是亚油酸大约占8.8%,亚麻酸不足1%;玉米油含亚油酸高达55.05%,其次是油酸大约占28.08%,亚麻酸仅有1.07%;亚麻籽油所含亚麻酸高达56.57%,其次是油酸大约占20.22%,亚油酸也有14.1%。据文献可知,植物油中不同种类脂肪酸发生氧化速度有所不同,通常情况下,脂肪酸中双键数量越多,越容易与空气发生氧化,花生四烯酸、亚麻酸、亚油酸、油酸的相对氧化速率之比大概为40∶20∶10∶1[22]。油茶籽油中油酸百分含量最高,是亚油酸百分含量的近10倍,但其氧化速率比亚油酸慢10倍,在含量和速率的共同影响下,亚油酸百分含量小幅下降1.8%,油酸百分含量上涨0.96%,γ-亚麻酸百分含量几乎下降为0;玉米油中亚油酸百分含量是亚麻酸含量的50多倍,所以在氧化过程中处于优势地位,亚油酸百分含量下降约3%,油酸百分含量不及亚油酸,反应速率慢,因此油酸百分含量上涨2.5%,亚麻酸百分含量仅有小幅下降;亚麻籽油中亚麻酸百分含量最高,反应速率又最快,因此亚麻酸百分含量下降4.05%,亚油酸百分含量小幅上涨0.3%,油酸百分含量上涨2.4%。虽然在食用油高温加热过程中,有些饱和脂肪酸的百分含量有所上涨,但也仅仅是因为这些脂肪酸氧化损失较少,在其他不饱和脂肪酸损失较多的情况下,这些饱和脂肪酸占有的百分含量升高了,并非这些饱和脂肪酸含量有所增加,因此从变化趋势上看,油茶籽油中油酸的氧化明显高于其他两种油中油酸的氧化,玉米油中亚油酸的氧化明显高于其他两种油中亚油酸的氧化,亚麻籽油中亚麻酸的氧化明显高于其他两种油中亚麻酸的氧化。

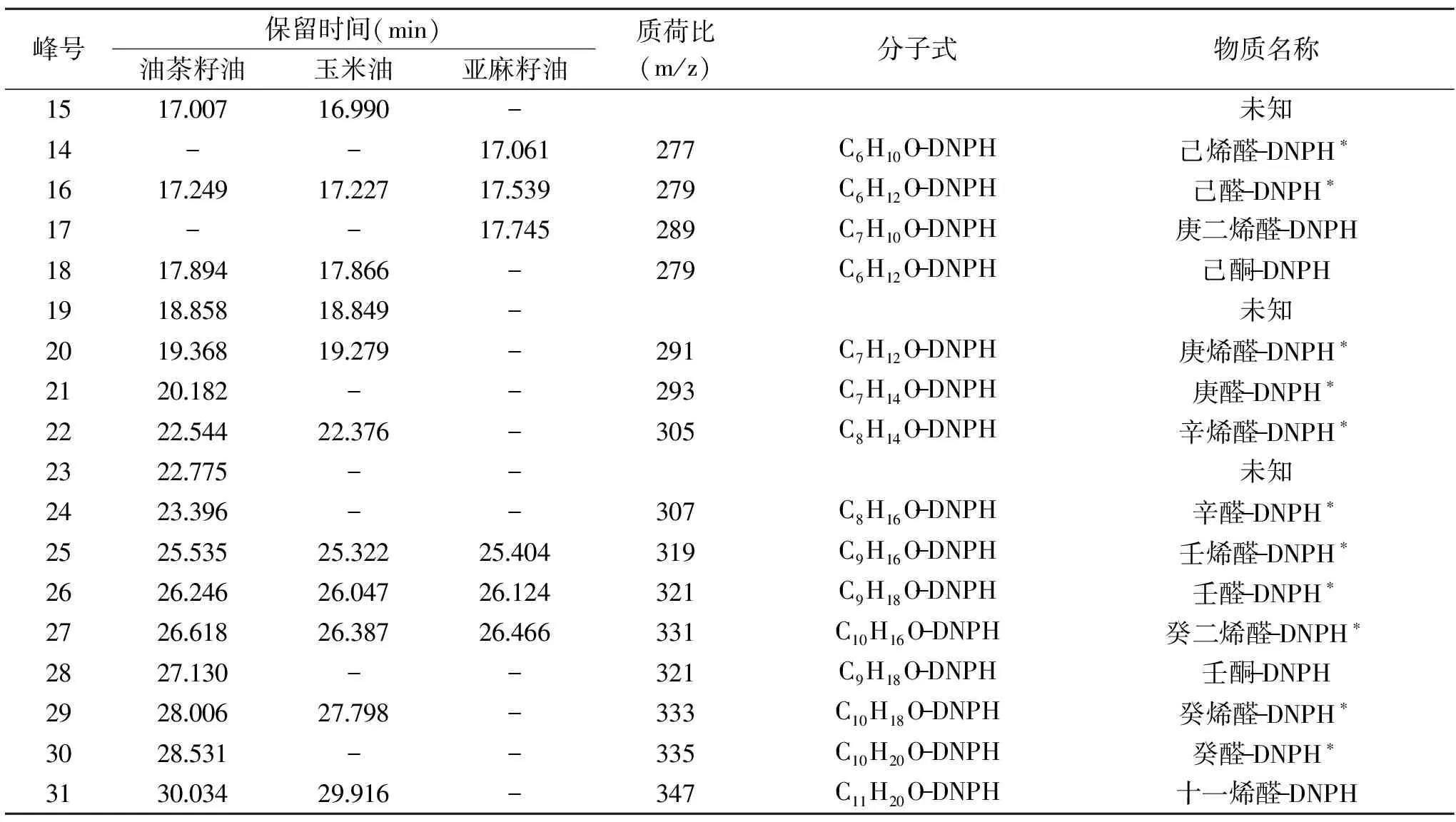
表3 LCMS-IT-TOF定性结果Table 3 LCMS-IT-TOF qualitative result
2.2 羰基化合物的定性结果
将油茶籽油、玉米油和亚麻籽油高温加热加速氧化24 h后,进行衍生化处理,得到衍生后的样品进行LCMS-IT-TOF测定,得到360 nm波长下的DAD图,见图1。

图1 油茶籽油(a)、玉米油(b)和亚麻籽油(c)的DAD色谱图Fig.1 DAD chromatogram of camellia seed oil(a),corn oil(b)and flaxseed oil(c)
通过对油茶籽油、玉米油和亚麻籽油的DAD图进行分析,确定每一个峰所对应的质荷比(m/z),再与各种已知的羰基化合物的质荷比(m/z)进行比对,初步得到3种食用油中所含全部羰基化合物的种类,见表3。
通过LCMS-IT-TOF分析测定,一共有32个峰被检出,通过对质荷比(m/z)的校对[23],我们可以确定第一个峰(1.62 min)对应物质为衍生试剂DNPH,后续31个有效峰中,共确认出26种羰基化合物-DNPH,分别是甲醛-DNPH、乙醛-DNPH、丙烯醛-DNPH、丙酮-DNPH、丙醛-DNPH、丁烯醛-DNPH、丁酮-DNPH、丁醛-DNPH、戊烯醛-DNPH、戊醛-DNPH、戊酮-DNPH、己烯醛-DNPH、己醛-DNPH、己酮-DNPH、庚二烯醛-DNPH、庚烯醛-DNPH、庚醛-DNPH、辛烯醛-DNPH、辛醛-DNPH、壬烯醛-DNPH、壬醛-DNPH、壬酮-DNPH、癸二烯醛-DNPH、癸烯醛-DNPH、癸醛-DNPH、十一烯醛-DNPH。
通过观察3种食用油的DAD色谱图发现,由于3种食用油中均含有油酸、亚油酸和亚麻酸,因此彼此间的峰型有很多共同点,但仔细观察后发现3种食用油DAD图在一些峰的峰面积上还是略有不同,为了更直观的比较三种食用油中产生羰基化合物的区别,将其中15种主要醛的峰面积进行了比较,如图2所示。
续表

图2 三种食用油主要醛峰面积比较Fig.2 Comparison of main aldehyde peak areas of three edible oils
注:“-”表示未检出,*代表已与标准品进行比对。油茶籽油和玉米油在20 min前较为相似,但20 min后油茶籽油产生的羰基化合物的种类明显多于玉米油,并且在峰面积上也明显高于玉米油,结合两种油在脂肪酸组成上的差异以及脂肪酸的变化情况,可以得出油酸可能是20 min以后出现的辛醛、辛烯醛、壬烯醛、壬醛、壬酮、癸烯醛、癸醛和十一烯醛中某些羰基化合物的前体物质;玉米油和亚麻籽油相比15 min前的羰基化合物种类基本相同,但亚麻籽油在8~13 min之间的峰面积明显高于玉米油,由于在衍生化时取用的油样质量大致相同,所以亚麻酸可能是8~13 min中出现的丙烯醛、丙醛、丙酮、丁烯醛、丁醛和丁酮中某些羰基化合物的前体物质,与此同时,亚麻籽油中含有一种在油茶籽油和玉米油中都没有出现的庚二烯醛,所以可以猜测庚二烯醛与亚麻酸密切相关;而玉米油在15~20 min这段时间内出现的戊醛、戊酮、己烯醛、己醛、己酮和庚烯醛以及26 min左右出现的癸二烯醛的峰面积明显高于其他两种油,因此亚油酸很可能是这其中某些羰基化合物的前体物质。
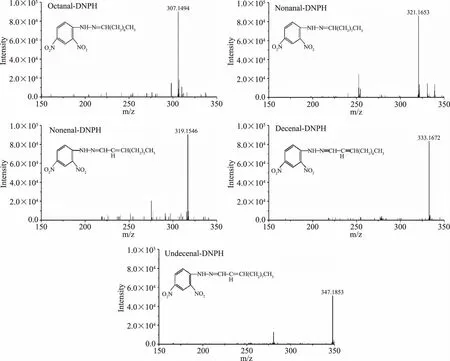
图3 油茶籽油5种特征羰基化合物质谱图Fig.3 Mass spectrometry of 5 characteristics carbonyl compounds of camellia seed oil注:左1辛醛-DNPH,右1壬醛-DNPH,左2壬烯醛-DNPH,右2癸烯醛-DNPH,左3十一烯醛-DNPH。
由图2可知,油茶籽油中辛醛、壬烯醛、壬醛、癸烯醛和十一烯醛的峰面积远远高于其他两种油,因此推测这5种羰基化合物是油茶籽油(高油酸油)中的特征羰基化合物,见图3。Min等[24]研究油酸自动氧化产生的氢过氧化物继续分解主要产生癸烯醛和辛醛,Kanavouras[25]研究油酸自氧化产生的辛醛和癸烯醛远高于其他脂肪酸,这与本文测得结果一致,同时本文还发现十一烯醛也是油酸氧化中非常重要的特征烯醛,油酸在氧化过程中,过氧基会在C8、C9、C10、C11位形成,进一步裂解后形成辛醛、壬醛、壬烯醛、癸烯醛和十一烯醛[26]。
由图2可知,在玉米油中戊醛、戊酮、己醛、庚烯醛和癸二烯醛的峰面积均高于其他两种油,虽然没有大幅领先油茶籽油,但考虑到油茶籽油中亚油酸也发生了大量氧化,甚至高于其油酸的氧化,因此油茶籽油中也会含有较高含量的亚油酸生成的羰基化合物,但玉米油中油酸的氧化程度远不及油茶籽油,因此由油酸氧化生成的羰基化合物含量就明显低于油茶籽油,这也是区分油茶籽油和玉米油特征醛的关键。综上所述,这5种羰基化合物是玉米油(高亚油酸油)中的特征羰基化合物,见图4。可见亚油酸在氧化过程中,过氧基会在C9、C12、C13、C14位形成,进一步裂解后形成戊醛、戊酮、己醛、庚烯醛和癸二烯醛。Frankel[27]报道亚油酸及高亚油酸油的氧化产物多为戊醛、己醛、庚烯醛和辛烯醛,与本文基本相符,除辛烯醛含量较少外,其他几种醛均为特征醛,除此之外,本文还发现癸二烯醛含量较高,Patsioura等[28]研究表明,亚油酸的一种含有10位和12位双键的氢过氧化物继续分解生成共轭二烯,这也极有可能是产生较多癸二烯醛的原因。Martínez等[23]研究发现,亚油酸最主要的特征醛之一,己醛的氧化途径是通过13-氢过氧化物衍生而来。
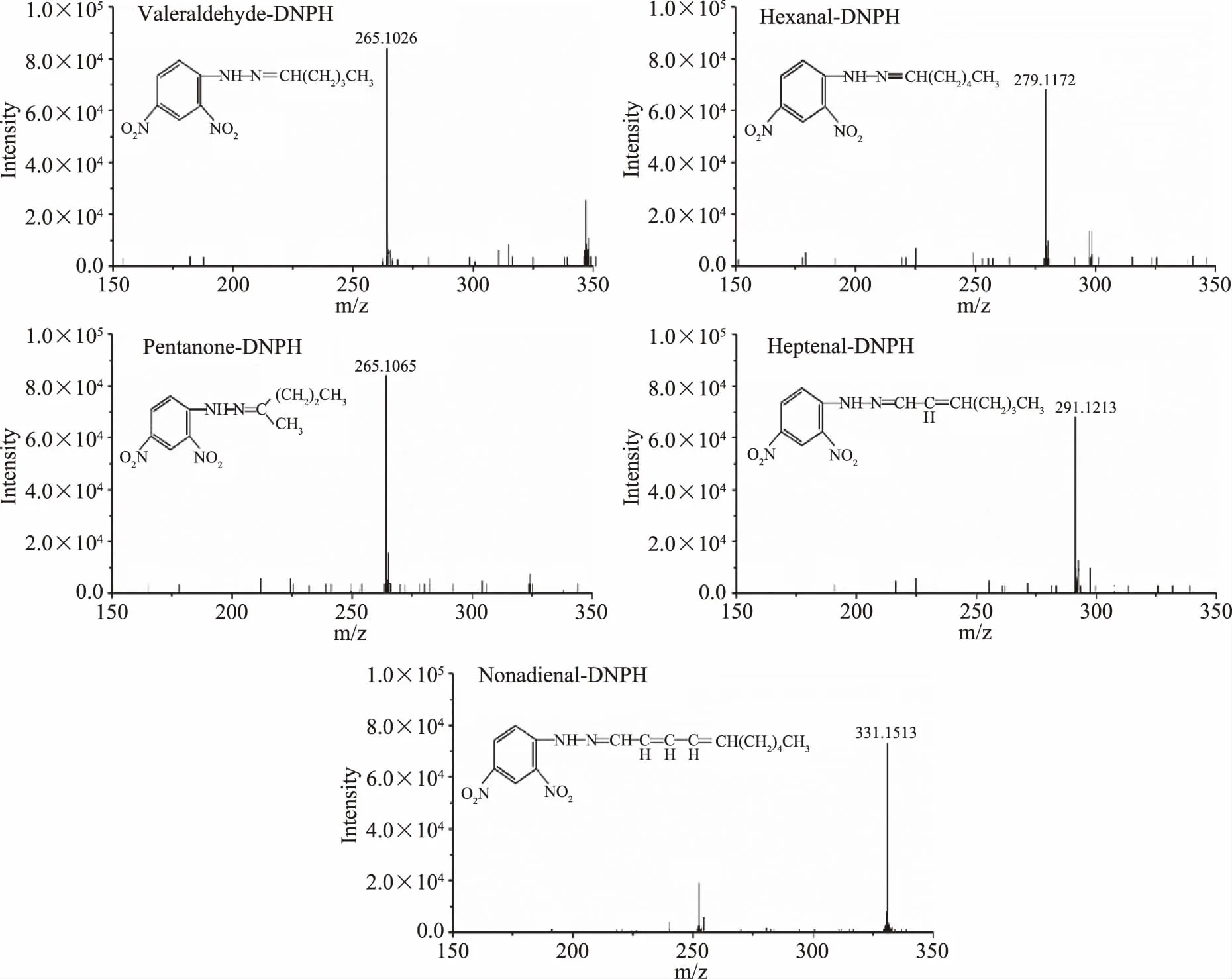
图4 玉米油的5种特征羰基化合物质谱图Fig.4 Mass spectrometry of 5 characteristics carbonyl compounds of corn oil 注:左1戊醛-DNPH,右1戊酮-DNPH,左2己醛-DNPH,右2庚烯醛-DNPH,左3癸二烯醛-DNPH。
由图2可知,亚麻籽油中丙酮、丙醛、丁酮、丁醛峰面积远远高于油茶籽油和玉米油,而庚二烯醛更是仅存在于亚麻籽油中,因此这5种羰基化合物是亚麻籽油(高亚麻酸油)中的特征羰基化合物,见图5。可见亚麻酸在氧化过程中,过氧基会在C12、C15、C16位形成,进一步裂解后形成丙酮、丙醛、丁酮、丁醛和庚二烯醛。与ω-6脂肪酸衍生的羰基化合物相比,来自ω-3脂肪酸的氢过氧化物通常产生具有较短链长的羰基化合物[29]。对于链烷醛形成的模式,丙醛(C3链烷醛)仅由ω-3脂肪酸产生,而己醛(C6链烷醛)主要来自ω-6脂肪酸。丙醛和己醛的形成分别对应于ω-3和ω-6脂肪酸的第一个n位双键的断裂,与此同时反式-2,4-庚二烯醛也被Suh报道,在ω-3脂肪酸中被检测到[30],而反式-2,4-癸二烯醛在ω-6脂肪酸中被观察到。

图5 亚麻籽油的5种特征羰基化合物质谱图Fig.5 Mass spectrometry of 5 characteristics carbonyl compounds of flaxseed oil注:左1丙醛-DNPH,右1丙酮-DNPH,左2丁醛-DNPH,右2丁酮-DNPH,左3庚二烯醛-DNPH。
3 结论与讨论
本研究通过对油茶籽油、玉米油和亚麻籽油高温加热前后的脂肪酸测定,得到三种食用油不同的脂肪酸组成以及变化情况,再利用LCMS-IT-TOF对三种加热后油样产生的羰基化合物进行定性分析,得到每种油产生的全部羰基化合物。由于三种食用油的脂肪酸组成存在差异,导致三种食用油高温加速氧化后产生的羰基化合物种类略有不同,对比三种食用油所产生的羰基化合物的种类和峰面积,找出了不同脂肪酸组成的食用油氧化后产生的特征羰基化合物。高油酸食用油的特征羰基化合物为辛醛、壬烯醛、壬醛、癸烯醛、十一烯醛;高亚油酸食用油的特征羰基化合物为戊醛、戊酮、己醛、庚烯醛、癸二烯醛;高亚麻酸食用油的特征羰基化合物为丙醛、丙酮、丁醛、丁酮、庚二烯醛。将特征羰基化合物产量的高低作为一个新指标,判断该脂肪酸类型食用油的氧化程度高低,具有一定的科学性,并且可以与传统的酸价、过氧化值及茴香胺值一同对油脂氧化程度做出一个更全面、更准确的判断。与此同时,根据这些特征羰基化合物的种类,可以判断油酸氧化主要在8、9、10、11号碳位产生氢过氧化物,亚油酸主要在9、12、13、14号碳位产生氢过氧化物,亚麻酸主要在12、15、16号碳位产生氢过氧化物。氢过氧化物继续裂解产生不同的羰基化合物,这也证明脂肪酸组成对于所产生羰基化合物的种类起到决定性作用。
