成人粪便中长双歧杆菌长亚种的分离鉴定及多位点序列分型分析
2019-11-27刘瑞娜赵鹏昊孟祥晨
刘瑞娜,周 雪,梁 玉,贺 菁,赵鹏昊,赵 桉,孟祥晨
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
双歧杆菌是人类肠道最早定殖的微生物之一,能够维持宿主肠道的微生态平衡,具有合成多种维生素、促进机体免疫机能等重要生理功能,在保持机体健康方面起重要作用[1-2]。出生一周的婴儿肠道中双歧杆菌含量可达肠道菌群的90%以上[3-4],成人肠道中双歧杆菌含量只占肠道菌群的3%~10%,普遍低于婴儿。双歧杆菌在婴儿肠道和成人肠道中不仅存在数量上的差异,而且菌种组成差异也较大。婴儿肠道中以B.breve,B.longumsubsp.longum,B.longumsubsp.infantis和B.bifidum为主[5],而成人肠道中则以B.adolescentis,B.catenulatum,B.pseudocatenulatum和B.longumsubsp.longum为主[6]。其中长双歧杆菌在各个年龄段人群中都存在[7]。
双歧杆菌基因的种间相似度极高,可达87.7%~99.5%,因此,对双歧杆菌的分型鉴定提出了更高要求。多位点序列分型(Multilocus Sequence Typing,MLST)技术是1998年Maiden等提出,近年来发展较快的一种分子分型方法[8]。一般选择6~8个编码蛋白的管家基因进行测序,将每一组不同的等位基因的排列组合作为一个基因型构成等位基因图谱(Alleles profile),分析等位基因图谱同时进行聚类分析,根据位点序列的不同赋予不同菌株序列类型(sequence typing,ST),达到对菌株进行多位点精确区分[9]。Marco等[10]比较了双歧杆菌常见种的模式菌株的7个管家基因(clpC、dnaB、dnaG、dnaJ1、purF、rpoC和xfp)串联建立的系统发育树,比单基因建树结果更全面、合理,表明基于7个保守的管家基因的MLST技术较传统的基于16S rDNA序列的分子分型方法,对于Bifidobacterium有着相对更高的分辨能力。Alexis等[11]对包括长双歧杆菌、两歧双歧杆菌、动物双歧杆菌及短双歧杆菌的119株Bifidobacterium进行clpC、purF等7个管家基因的MLST分析,共获得104个ST型,在长双歧杆菌、两歧双歧杆菌、短双歧杆菌间区分度达到了99%,具有精确菌株分型的能力。Yanokura等[12]通过扩增片段长度多态性(amplified-fragment length polymorphism,AFLP)和多位点序列分型技术将25株长双歧杆菌精确鉴定到亚种,同时发现并报道了一个长双歧杆菌新亚种。
近几年,国内对成人粪便中长双歧杆菌长亚种的多位点序列分型分析尚有空白。本研究以健康成人粪便为研究对象,采用纯培养技术分离其中的长双歧杆菌长亚种,进一步利用16S rDNA、hsp60和MLST技术分析分离得到的长双歧杆菌长亚种的基因多态性,为深入研究长双歧杆菌长亚种在机体健康中的作用和功能奠定基础。
1 材料与方法
1.1 材料与仪器
长双歧杆菌长亚种标准菌株ATCC 15707 购自中国微生物菌种保藏中心(CGMCC);L-半胱氨酸盐酸盐 天津光复精细化工研究所;引物 吉林省库美生物科技有限公司;TIANGEN细菌基因组DNA提取试剂盒、DNA Marker、dNTPs 天根生化科技有限公司;Taq DNA聚合酶 北京康润诚业生物科技有限公司;琼脂糖 Sigma公司;改良MRS培养基:柠檬酸氢二胺2.0 g、胰蛋白胨10.0 g、乙酸钠5.0 g、Tween-80 1.0 g、葡萄糖20.0 g、蛋白胨5.0 g、硫酸锰0.25 g、牛肉膏5.0 g、酵母粉5.0 g、硫酸镁0.58 g、三水磷酸氢二钾2.0 g、L-半胱氨酸盐酸盐0.5 g、蒸馏水1 L、pH=7.2;预还原液:L-半胱氨酸盐酸盐 3.0 g、大豆蛋白胨2.0 g、蒸馏水1 L、pH=7.2;粪便稀释液:KH2PO44.5 g、Na2HPO46.0 g、L-半胱氨酸盐酸盐0.5 g、吐温-80 0.5 g、蒸馏水1 L、pH=7.2。
BCN1360型生物洁净工作台 上海佳胜实验设备有限公司;光学显微镜 麦克奥迪实业集团有限公司;LJQ-F2厌氧培养罐 自行设计;SPX-150B型生化培养箱 上海佳胜实验设备有限公司;微量台式离心机 美国Beckman公司;9700 PCR扩增仪 美国Applied biosystem公司;DYY-10C型电泳仪 北京市六一仪器厂;UVP凝胶成像系统 美国UVP公司。
1.2 实验方法
1.2.1 粪便采集与菌株的分离纯化
1.2.1.1 粪便采集 参考张秋雪等[13]的方法采集健康成人的粪便样品,采集对象在采集样品前两周均未服用过抗生素类药物,未使用益生菌制品且无胃肠病史。取新鲜粪便样品立刻放入加有预还原液[14]的无菌取样管中,封好放入冰盒内迅速带回实验室进行双歧杆菌菌株的分离。
1.2.1.2 菌株的分离纯化 将粪便样品用稀释液[15]10倍梯度稀释,在10-4、10-5、10-6、10-7稀释度下分别取100 μL涂布于mMRS固体培养基中,37 ℃厌氧培养48~72 h后,选取光滑、凸起、边缘水润的白色或乳白色菌落镜检。将呈V、Y或两端钝圆的杆状形态菌落划线于mMRS培养基中,分别在有氧条件和严格厌氧条件(菌落划线平板置于自制可密封厌氧罐中,真空泵抽真空后充入由80%氮气、10%氢气和10%二氧化碳组成的混合气体,重复操作两次)下37 ℃培养72 h,剔除需氧和兼性厌氧菌。选取仅在厌氧条件生长且革兰氏染色为阳性的菌落,重复划线纯化,直至获得镜检为纯菌株为止。
1.2.2 生理生化试验 将1.2.1.2中获得的分离株分别进行甲基红试验、过氧化氢酶试验、氧化酶试验、明胶液化试验、吲哚试验、硝酸盐还原试验及运动性试验[16-17]。
1.2.3 分离菌株基因同源性分析 选择甲基红试验阳性,过氧化氢酶、氧化酶试验、明胶液化、吲哚和硝酸盐还原试验结果均为阴性,且无运动性的分离菌株进行基因同源性分析。
1.2.3.1 基因组DNA的提取 按照TIANGEN细菌基因组DNA提取试剂盒说明书的步骤提取分离菌株基因组DNA,-20 ℃保存备用。
1.2.3.2 分离菌株16S rDNA序列同源性分析 16S rDNA扩增反应体系(50 μL)为:DNA模板1.0 μL;上游引物(10 μmol/L)2.0 μL;下游引物(10 μmol/L)2.0 μL;Taq DNA Polymerase(2.5 U/μL)0.5 μL;10×Taq DNA polymerase Buffer(Mg2+plus)2.5 μL;dNTP(2.5 mmol/L)4.0 μL;ddH2O 38 μL。其中上下游引物序列27F为5′-AGAGTTTGATCCTGGCTCAG-3′,1492R为5′-GGTTACCTTGTTACGACTT-3′[13]。
PCR扩增反应程序为:94 ℃预变性4 min;94 ℃变性30 s,53 ℃退火1 min,72 ℃延伸1 min,30个循环;最后72 ℃延伸7 min。
1.2.3.3 分离菌株hsp60同源性分析 hsp60基因扩增反应体系同16S rDNA基因扩增体系。其中上游引物为hspF3(5′-CTGGTGAAGGAGGTCGCCAA-3′),下游引物为hspR4(5′-CCATATCCTGCAGCAT AGCCTT-3′)[18]。

表1 长双歧杆菌长亚种MLST扩增引物Table 1 The MLST primers for Bifidobacterium longum subsp. longum
hsp60基因PCR反应条件:94 ℃预变性5 min;第一阶段包括94 ℃变性60 s,62 ℃退火60 s,72 ℃延伸90 s,4个循环;第二阶段包括94 ℃变性60 s,60 ℃退火60 s,72 ℃延伸90 s,21个循环;第三个阶段包括94 ℃变性60 s,58 ℃退火60 s,72 ℃延伸90 s,15个循环;最后72 ℃延伸7 min。
1.2.3.4 PCR扩增产物分析 PCR反应完毕之后,将PCR产物进行1.5%的琼脂糖凝胶电泳。电泳后,将凝胶置于紫外灯下观察。16S rDNA扩增产物获得约1500 bp左右的条带,hsp60扩增产物获得约650 bp左右的条带,且条带清晰无杂带后,将扩增产物送吉林省库美生物科技有限公司进行双向测序。
1.2.3.5 分离株多位点序列分型分析 看家基因扩增体系与16S rDNA基因扩增体系相同。其中每个看家基因所用上下游引物信息如表1所示[11]。
看家基因扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃或60 ℃退火30 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸10 min。其中看家基因clpC、fusA、gyrB、purF、rplB退火温度为60 ℃,ileS和rpoB退火温度为55 ℃[11]。
PCR扩增反应完毕之后,将扩增产物进行1.5%琼脂糖凝胶电泳。将电泳后的凝胶置于紫外灯下观察。若七个看家基因条带均单一清晰无杂带,送PCR产物测序。
为提高多位点序列分型的准确性,将看家基因进行双向测序,去除测序起始端与引物结合不稳定的序列[19]。经测序及数据处理后,最终用于MLST分析的7个看家基因序列长度分别为:clpC:603 bp、fusA:666 bp、gyrB:627 bp、ileS:489 bp、purF:591 bp、rplB:357 bp、rpoB:501 bp[11]。
将测序所获得的序列运用MEGA 6.0软件,采用Neighbor-Joining方法进行同源性分析,自展值(bootstrap value)分析设置重复取样1000次,并对分离菌株构建系统发育树。
2 结果与分析
2.1 分离菌株形态及生理生化试验结果
2.1.1 分离菌株的菌落菌体形态 从12个健康成人粪便中分离得到24株双歧杆菌疑似菌株。菌落白色或乳白色,半透明或不透明,光滑,凸圆,边缘整齐。24株分离株革兰氏染色均为阳性,显微镜下菌体排列不规则,菌体形态呈V形、Y形、哑铃形或两端大小不一等形态(图略)。
2.1.2 生理生化试验结果 24株分离株均为专性厌氧菌,甲基红试验阳性,过氧化氢酶、氧化酶试验、明胶液化、吲哚和硝酸盐还原试验结果均为阴性,且均无运动性。
2.2 分离菌株基因同源性分析
2.2.1 16S rDNA同源性分析 24株分离株PCR扩增产物经1.5%琼脂糖凝胶电泳后,在1500 bp左右处有明亮单一条带(图1),满足测序要求,将样品进行测序。将得到的测序结果在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中进行BLAST比对,寻找数据库中与目的基因序列同源性最高的已知分类地位的菌种,确定目的基因的归属。比对结果显示:其中14株分离菌株与长双歧杆菌的同源性均达到99%,有3株分离株与假小链双歧杆菌同源性达到99%,其余7株分离株与两歧双歧杆菌同源性达到99%。
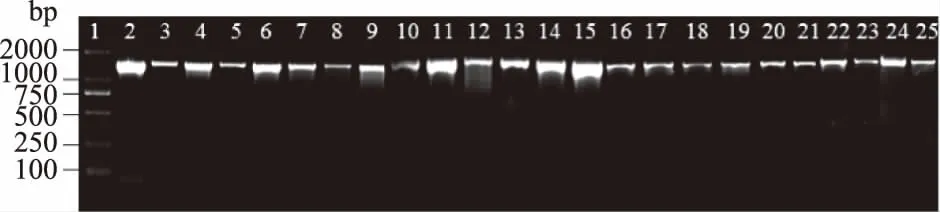
图1 分离菌株16S rDNA PCR电泳图谱Fig.1 Electrophotogram of the 16S rDNAPCR products of the isolates注:图谱中泳道1~25从左到右依次为:2000 bp DNA Ladder Marker、菌株H1、G3、Z4、Y2-1、Y2-2、Y3、Y8、S1、S5、S6-3、S7、M4、M5、M8、W1、W2、W3、W8、T4、T6、B1、B4、T3-1、T9-1。

图2 基于16S rDNA基因序列构建长双歧杆菌系统发育树Fig.2 Phylogenetic tree of Bifidobacterium longum based on 16S rDNA gene sequences
选取16S rDNA基因同源性99%以上的双歧杆菌模式菌株序列,运用MEGA6软件对分离得到的24株分离菌株构建系统发育树(图2)。结果显示其中14株分离菌株(G3、H1、S1、S7、M4、M5、W1、W3、W8、Z4、T4、T6、Y2-1、Y2-2)均与长双歧杆菌长亚种ATCC15707亲缘关系最近,初步判定为长双歧杆菌。
2.2.2 hsp60同源性分析 上述14株长双歧杆菌的hsp60基因经PCR扩增后电泳,在650 bp左右处均有明亮单一条带(图3),满足测序要求,将样品进行测序。
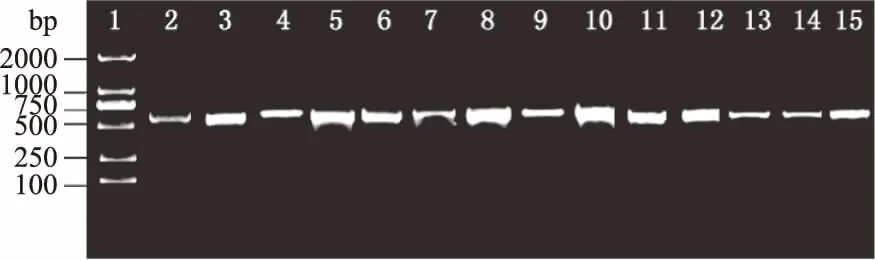
图3 长双歧杆菌hsp60基因的PCR电泳图谱Fig.3 Electrophotogram of the hsp60 genePCR products of the Bifidobacterium longum strains注:图谱中泳道1~15从左到右依次为:2000 bp DNA Ladder Marker、菌株H1、G3、Z4、Y2-1、Y2-2、S1、S7、M4、M5、W1、W3、W8、T4、T6。
将测序结果在NCBI进行BLAST比对,与数据库中已知菌株的hsp60基因序列进行对比。选取hsp60基因同源性99%以上的双歧杆菌模式菌株序列,运用MEGA 6.0软件对14株分离菌株构建系统发育树(图4)。
基于hsp60基因构建的系统发育树中,14株分离菌株均与Bifidobacteriumlongumsubsp. longum JCM1217亲缘关系最近,结合16S rDNA结果判断14株分离菌株均为长双歧杆菌长亚种。其中M4、M5及W3与其余10株分离菌株有更远的进化距离。其余的10株分离株中,Y2-1与Y2-2,S1、T4、W1及Z4亲缘关系更近。
2.3 长双歧杆菌长亚种MLST分析
2.3.1 看家基因电泳及测序结果 选取7个看家基因进行长双歧杆菌长亚种的MLST分析,根据文献[11]的方法设计引物并对看家基因进行扩增。14株长双歧杆菌长亚种的7个看家基因PCR扩增后电泳,在相应位置均有明亮单一条带(图5),为提高MLST的准确性,将看家基因扩增产物进行双向测序。
2.3.2 长双歧杆菌长亚种的看家基因分型 以B.longumsubsp.longumATCC 15707为参考菌株,通过7个看家基因对14株长双歧杆菌长亚种进行MLST分型分析。在7个看家基因的等位点上,赋予每个不同的序列以不同的编号,每一组不同的看家基因编号的排列组合构成该菌株的等位基因图谱,将其作为一个基因型,从而每个独特的基因型对应了一个序列型(ST)[20]。14株长双歧杆菌长亚种分离株共分为10个ST型,且均与B.longumsubsp.longumATCC 15707为不同的ST型(表2)。
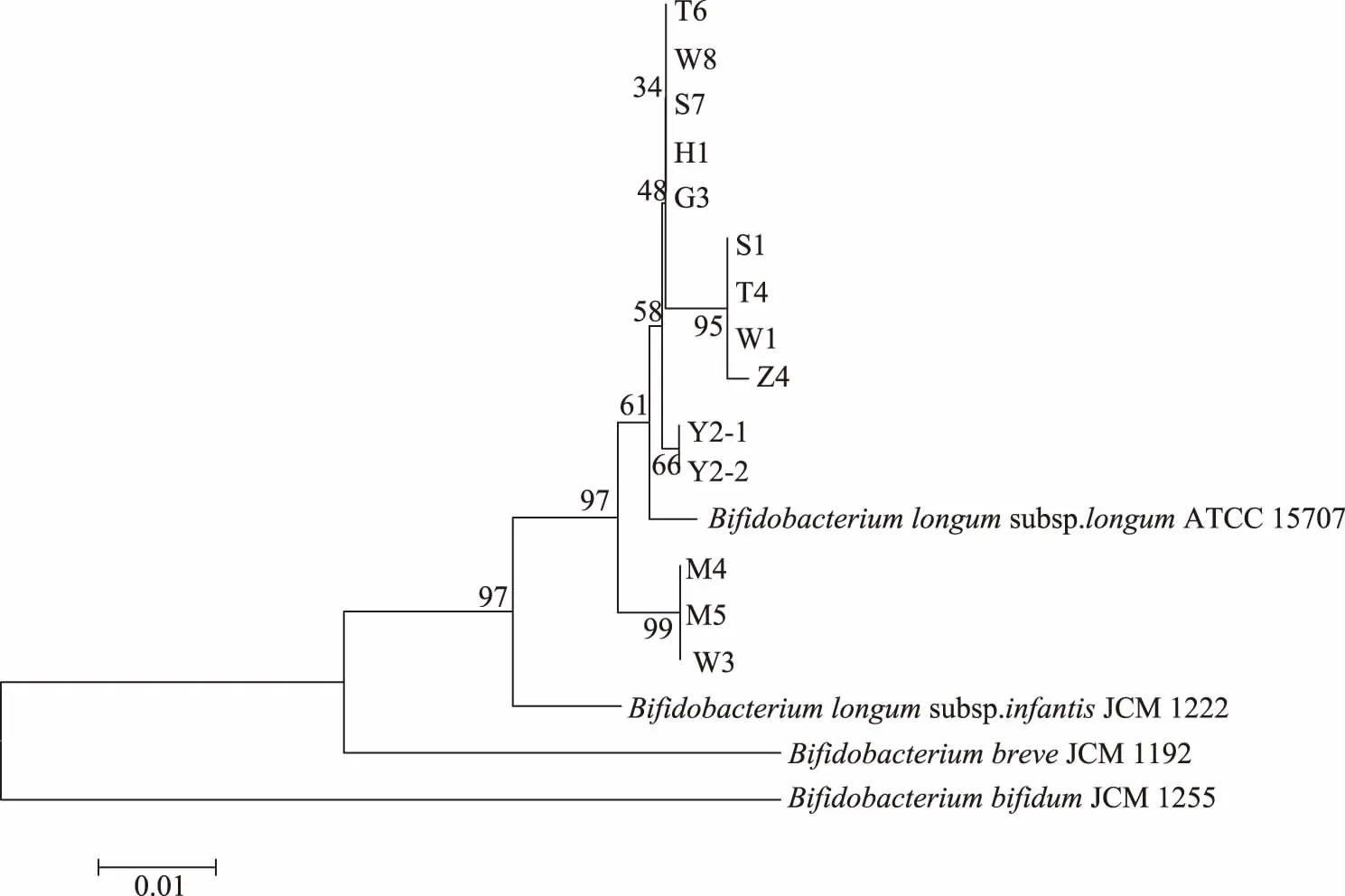
图4 基于hsp60基因序列构的建长双歧杆菌系统发育树Fig.4 Phylogenetic tree of Bifidobacterium longum based on hsp60 gene sequences

表2 14株长双歧杆菌长亚种等位基因图谱Table 2 Alleles profiles of 14 Bifidobacterium longum subsp. longum strains
2.3.3 长双歧杆菌长亚种等位基因系统发育树的构建 分别将14株菌的7个看家基因序列按照clpC-fusA-gyrB-ileS-purF-rplB-rpoB顺序连接起来,对分离株构建联合基因系统发育进化树(图6)。由系统发育树可以看出:分离所得14株长双歧杆菌长亚种菌株中,分离自Y个体的菌株Y2-1和Y2-2为同一ST型,分离自S个体的菌株S1和S7为同一ST型,分离自M个体的菌株M4与M5为相同ST型,分离自T个体的菌株T4及T6为相同ST型,但分离自同一W个体的W1、W3、W8为三种不同ST型。
3 讨论
本研究在对分离菌株进行分子鉴定的过程中发现,16S rDNA基因同源性分析结果与hsp60基因同源性分析结果一致,但hsp60基因同源性分析进一步展示出了分离菌株间的进化距离,而且显示出了更高的分辨率。从图4可以看出,菌株M4、M5和W3与其他分离株及B.longumsubsp.longumJCM1217之间进化距离上有差异,三株分离株之间进化距离无差异。菌株Y2-1和Y2-2以及菌株S1、T4、W1和Z4虽然在长双歧杆菌长亚种聚类中,但存在进化距离的差异,其中菌株Y2-1和Y2-2之间进化距离无差异,菌株Z4和S1、T4、W1之间有进化距离的差异。这一结果说明hsp60基因同源性分析优于16S rDNA序列分析[13]。已有文献表明hsp60基因结构具有高度保守性,在双歧杆菌中分布广泛,是适用于双歧杆菌在种或亚种水平上进行鉴定及系统发育分析的准确、便捷的首选基因[21]。

图5 长双歧杆菌长亚种菌株MLST等位基因PCR电泳条带图Fig.5 PCR electrophoresis bands of the MLST alleles of Bifidobacterium longum subsp. longum strains注:其中 a~n分别代表分离菌株G3、H1、M4、M5、S1、S7、T4、T6、W1、W3、W8、Y2-1、Y2-2、Z4。每个图谱中泳道M~7从左到右依次为:2000 bp DNA Ladder Marker、clpC、fusA、gyrB、ileS、purF、rplB、rpoB。
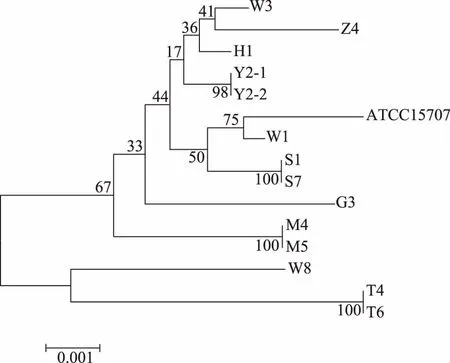
图6 长双歧杆菌长亚种菌株等位基因系统发育树Fig.6 Phylogenetic tree of allelic genes ofBifidobacterium longum subsp. longum strains
长双歧杆菌长亚种菌株MLST分析发现,分离株7个看家基因等位基因数在4~9之间,gyrB基因包含最多的9个等位基因,clpC和purF基因都含有4个最少的等位基因。看家基因的等位基因数量反映该基因的遗传多样性[22],表明7个看家基因中clpC和purF基因较稳定,基因多样性变化最小。来源于不同个体(Z、H、G)的3株长双歧杆菌长亚种形成了3个ST型,来源于同一个体Y(Y2-1、Y2-2)、S(S1、S7)、M(M4、M5)、T(T4、T6)的8株B.longumsubsp.longum为4个基因型,即分离自同一个体的菌株属于同一ST型,与张秋雪等[13]对婴儿粪便中长双歧杆菌长亚种MLST分析结果一致。本研究中分离自同一W个体的3株分离株(W1、W3、W8)形成了3个ST型,与婴儿源肠道中该菌种的MLST分析结果相比,成人源肠道该菌种具有更明显的基因多态性。有研究表明长双歧杆菌长亚种在人体中的定植受环境因素和宿主生理状况及宿主基因型影响[23-24],这为解释这一现象提供了理论依据,表明不同个体的长双歧杆菌长亚种之间存在较大的遗传多样性。
4 结论
本研究从12个健康成人粪便样品中分离鉴定得到14株长双歧杆菌长亚种菌株。经多位点序列分型分析发现,14株长双歧杆菌长亚种分离株为10个基因型,分离自同一个体的分离株多为同一基因型,也出现了同一个体得到几种不同ST型的情况,此结果说明不同人源成人肠道中长双歧杆菌长亚种基因型差异较大,且存在基因多态性。
猜你喜欢
——和田盘羊
