异硫氰酸苄酯、乳酸链球菌素和麝香草酚复配物的抑菌活性
2019-11-27班芳芳胡梁斌莫海珍赵岩岩李红波
班芳芳,胡梁斌,莫海珍,赵岩岩,李红波,周 威
(河南科技学院食品学院,河南新乡 453003)
金黄色葡萄球菌(Staphylococcusaureus)和大肠杆菌(Escherichiacoli)是常见的食源性致病菌,可导致食物中毒。金黄色葡萄球菌是人类化脓感染中最常见的革兰氏阳性病原菌,它能引起从呼吸系统到皮肤的各种感染[1]。大肠杆菌是生活在人类肠道中兼性厌氧的革兰氏阴性菌。一些特殊血清型的大肠杆菌会导致严重的肠道和外源性感染,引起肠道(肠炎、腹泻或痢疾)或肠外疾病(尿路感染、败血症或脑膜炎)[2]。近年来由于抗生素的滥用,大肠杆菌和金黄色葡萄球菌耐药频率增加,特别是一些多重耐药(Multi drug resistance,MDR)菌,如耐甲氧西林(Methicillin-resistantS.aureus,MRSA)[3]。耐药菌感染问题已经给人们带来了严峻的挑战。
开发新药是解决以上问题的出路,其中天然活性成分由于低毒及良好的抑菌活性受到研究者的青睐。而对于那些抑菌作用相对较弱的生物活性物质,各种成分之间的复配是增强抑菌作用的一种很好的方式[4-5]。本实验中所用的天然活性成分分别为异硫氰酸苄酯(Benzyl isothiocyanate,BITC)、麝香草酚(Thymol)和乳酸链球菌素(Nisin),它们都是经联合国粮食和农业组织(The Food and Agriculture Organization of the United Nations,FAO)和世界卫生组织(World Health Organization,WHO)批准可在食品中使用的一种食品添加剂。BITC是从金莲花和水芹及其他的一些十字花科植物中分离得到的,可以通过诱导细菌膜完整性的丧失来控制细菌的感染[6]。Thymol是广泛存在于百里香属、罗勒属、牛至属、香薄荷属、延布拉属和美国薄荷属等唇形科植物精油的主要单萜酚,易挥发,具有抗氧化剂[7]、抗炎[8]、抗病毒[9]、抗肿瘤[10]、抗菌作用[11]。Thymol的杀菌机理在于它可使细胞膜发生膜穿孔,导致细胞内容物的泄露[12]。Nisin是从乳球菌中分离出来的一种无味、无色、低毒的天然抗菌肽,其对革兰氏阳性菌具有较高的抗菌活性,比如李斯特菌、金黄色葡萄球菌、蜡样芽孢杆菌、植物乳杆菌、滕黄微球菌和黄色微球菌[13-18]。但是这三种活性成分之间的复配及复配后的抑菌作用尚未有人研究,本文将采用复配的方法来研究它们对金黄色葡萄球菌和大肠杆菌的抑菌效果。利用棋盘法将异硫氰酸苄酯、乳酸链球菌素和麝香草酚两两之间进行复配,并结合基于LA理论非参数模型的FICI模型和BI理论非参数模型的ΔE模型对抑菌结果进行评价,以期为天然活性成分的抑菌研究提供理论基础。
1 材料与方法
1.1 材料与仪器
金黄色葡萄球菌ATCC25923(S.aureusATCC25923)、大肠杆菌MG1655(E.coliMG1655) 美国宾西法尼亚大学;Nisin、Thymol、BITC和DMSO Sigma公司。
ZWY-1102C恒温培养振荡箱 中国智城分析仪器制造有限公司;BE-9010微孔板恒温振荡器 海门市其林贝尔仪器制造有限公司;多功能酶标仪 赛默飞世尔科技(中国)有限公司;SW-CJ-2F D双人单面垂直净化工作台 中国苏州智净净化有限公司;78-1型磁力加热搅拌器 江苏金坛市中大仪器厂;Pico 17高速离心机 赛默飞世尔科技(中国)有限公司;WFJ 7200型可见光分光光度计 尤尼柯(上海)仪器有限公司;HVE-50高压灭菌器 Hirayama Manufacturing Corporation;PL303电子天平 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 菌种活化S.aureusATCC25923和E.coliMG1655的活化:将保存在-80 ℃冰箱中的S.aureusATCC25923和E.coliMG1655取出,取少许菌液冰碴分别在TSB和LB固体培养基上进行划线接种,37 ℃静置、过夜培养。
1.2.2 天然活性成分单用的抑菌活性测定 挑取S.aureusATCC25923和E.coliMG1655单克隆于无菌的TSB和LB液体培养基中,并在37 ℃、200r/min的条件下进行过夜培养,然后按照体积比200∶1(TSB液体培养基∶菌液)进行转接,待其OD600=0.8~1.0时,调菌液OD600=0.1,然后在此基础上稀释100倍备用。将BITC与Thymol用DMSO溶剂稀释;Nisin用0.02 mol/L的稀盐酸稀释,分别配制成不同梯度浓度的溶液,即BITC为0、2、4、8、16、32、64、128 μg/mL;Thymol为0、8、16、32、64、128、256、512 μg/mL;Nisin为0、8、16、32、64、128、256、512 μg/mL。体系中DMSO的剂量均不高于1%。最后将配置好的一系列梯度浓度的活性成分分别吸取5 μL加至含有195 μL菌液稀释液的96孔板中(200 μL体系),于37 ℃的恒温培养箱培养24 h,通过酶标仪测定600 nm波长下96孔板中各菌孔的OD600值,计算细菌生长率。
生长率(%)=(各试验孔OD值/空白对照孔OD值)×100。
1.2.3 天然活性成分两两联用的抑菌活性测定 药物相互作用模型。为了评估3种天然活性成分对两种菌株的体外相互作用,本文采用基于两种无交互理论的非参数化方法LA理论和BI理论对结果进行分析[19]。

BI模型:BI方程所描述的理论可用等式Ii=IA+IB-IA×IB来表示,Ii是药物A和B理论上非相互作用结合的抑菌率,IA和IB是药物A和B单用时的实际抑菌率。而I=1-E,E是生长率,通过替换到原方程,方程推导如下:Ei=EA×EB,Ei是药物A和B理论上非相互作用结合的生长率,EA和EB是药物A和B单用时的实际生长率。不同浓度组合相互作用的类型可以通过药物在不同浓度下理论和实际生长百分比之间的差异(ΔE)来描述。若平均ΔE>0,则有95%的可能性说明此浓度组合有协同作用;相反,若平均ΔE<0,则有95%的可能性说明此浓度组合有拮抗作用。而不同浓度组合的总体联用效果可以通过显著协同(∑SYN)和拮抗(∑ANT)相互作用的总和百分比来评价。若显著相互作用总和小于100%,被认为是弱相互作用;显著相互作用在100%~200%,被认为是中等相互作用,显著相互作用在200%以上,被认为是强相互作用。
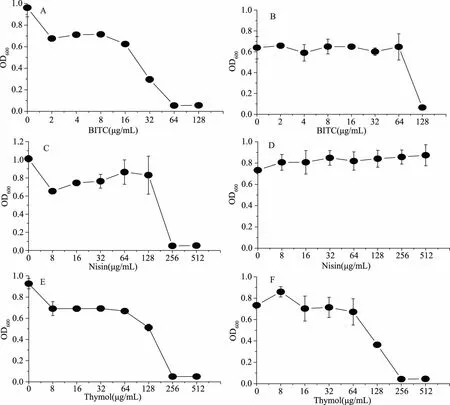
图1 BITC、Nisin与Thymol分别对S. aureus ATCC25923和E. coli MG1655的最小抑菌浓度Fig.1 MIC of BITC,Nisin and Thymol against S. aureus ATCC25923 and E. coli MG1655注:A、C、E分别为BITC、Nisin、Thymol对S. aureus ATCC25923的最小抑菌浓度;B、D、F分别为BITC、Nisin、Thymol对E. coli MG1655的最小抑菌浓度。
在96孔板每个孔内加入190 μL菌液稀释液,然后将稀释好的BITC与Nisin各吸取5 μL,按照棋盘法进行交叉组合。Thymol与Nisin、Thymol与BITC也分别进行同样的交叉组合,并将活性成分组合后的96孔板放至37 ℃的恒温培养箱内培养24 h,然后测量各个96孔板的OD600值,并根据以上的评价模型对结果进行评价。
1.3 数据处理
使用Excel软件进行数据处理和绘图,其中的最小抑菌浓度曲线由OriginPro 8.5软件绘制。每个处理组进行三次平行实验。
2 结果与分析
2.1 BITC、Nisin与Thymol单用时的抑菌作用
利用微量稀释法测定BITC、Nisin和Thymol分别对S.aureusATCC25923和E.coliMG1655的最小抑菌浓度。由图1可以看出,BITC、Nisin和Thymol对S.aureusATCC25923最小抑菌浓度分别为64、256、256 μg/mL;而对E.coliMG1655的最小抑菌浓度分别为128、>8、256 μg/mL。
2.2 BITC、Nisin与Thymol两两联用时的抑菌效应
BITC、Nisin和Thymol单用及联用时的抑菌活性结果如表1所示。BITC、Nisin与Thymol单用时对S.aureusATCC25923的IC50分别是32、128和128 μg/mL。当BITC、Nisin与Thymol两两联用时,BITC的使用浓度由32 μg/mL降至最低8 μg/mL;Nisin的使用浓度由128 μg/mL最低降至8 μg/mL;Thymol的使用浓度由128 μg/mL降至最低32 μg/mL。BITC、Thymol与Nisin单用时对E.coliMG1655的IC50分别是64、384和16384 μg/mL。当BITC、Thymol与Nisin两两联用时,BITC的使用浓度由64 μg/mL最低降至16 μg/mL;Nisin的使用浓度由128 μg/mL最低降至8 μg/mL;Thymol的使用浓度由384 μg/mL降至最低64 μg/mL。结果表明,三种天然活性成分两两联用可以降低其各自的抑菌使用剂量。

表1 BITC、Nisin和Thymol单用及联用时的抑菌活性Table1 Antibacterial activity of BITC,nisin and thymol exposed alone and in combination
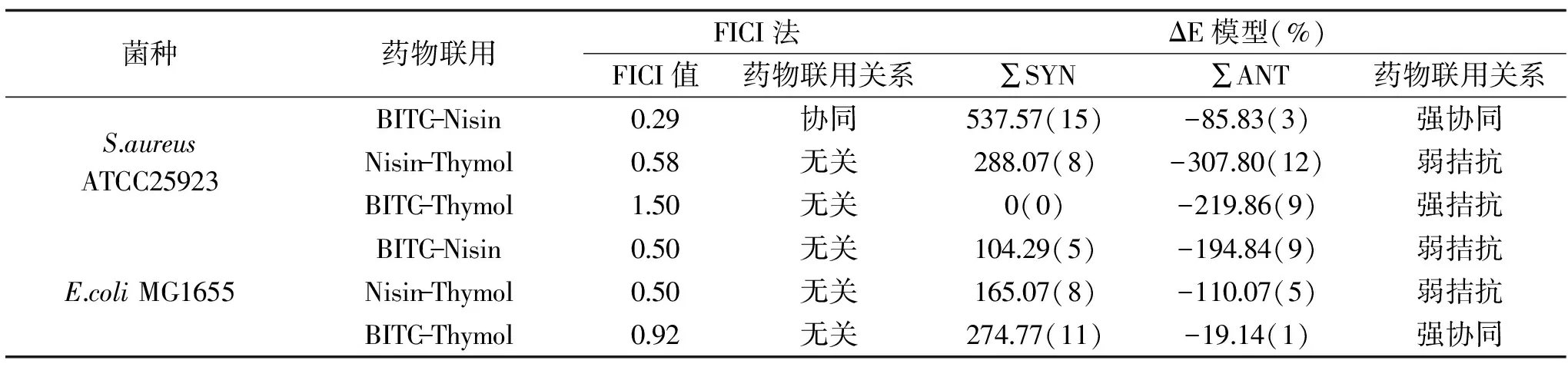
表2 Nisin、BITC与Thymol体外两两联用效果Table 2 In vitro interaction among BITC,nisin and thymol

表3 S. aureus ATCC25923经Nisin-BITC处理后的生存率Table 3 Survival rate of S. aureus ATCC25923 treated with Nisin-BITC compound
2.2.1 BITC-Nisin之间的抑菌效应 基于LA理论非参数模型的FICI法,通过计算可知,BITC-Nisin联用时对S.aureusATCC25923表现出协同抑菌效应(FICI指数小于0.5,如表2所示),对E.coliMG1655则无相互作用(FICI指数大于0.5,如表2所示),其协同抑菌效果分别如表3和图2A所示;基于BI理论非参数模型的ΔE法,可知BITC-Nisin联用对S.aureusATCC25923表现出强协同抑菌作用(∑SYN=537.57,表2),而对E.coliMG1655则表现出弱拮抗作用(∑ANT=85.83,如表2所示),分别如图2B和2C所示。两种评价模型表现出较好的一致性。
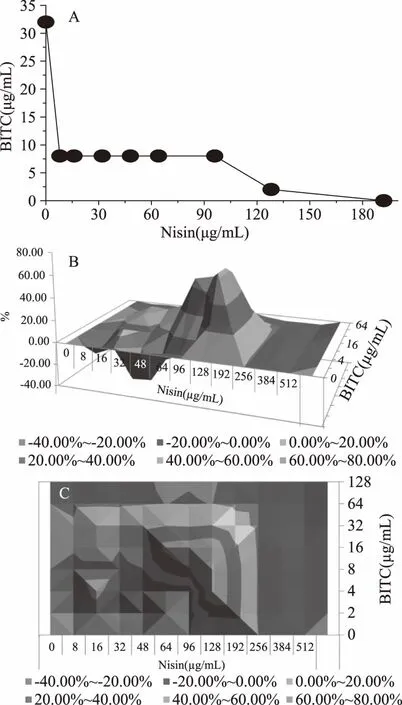
图2 BITC-Nisin对S. aureus ATCC25923的抑菌效应定量分析Fig.2 Quantitative analysis of antibacterial effect ofS. aureus ATCC2592 exposed to BITC and nisin注:A为基于LA理论非参数模型下的50%抑菌浓度等效点图;B和C分别为基于BI理论非参数模型下的BITC-Nisin抑菌的3-D立体指数图曲面图和俯视图。
2.2.2 Nisin-Thymol之间的抑菌效应 如表2所示,Nisin-Thymol联用对S.aureusATCC25923的FICI值为0.58,∑SYN=288.07,∑ANT=-307.80;对E.coliMG1655的FICI值为0.5007,∑SYN=165.07,∑ANT=-110.07。无论是利用FICI法还是ΔE法对结果进行模型评估,Nisin-Thymol联用对S.aureusATCC25923和E.coliMG1655均未表现出协同作用,即Nisin-Thymol联用并没有提高Nisin或Thymol对S.aureusATCC25923和E.coliMG1655的抑菌效应。
2.2.3 BITC-Thymol之间的抑菌效应 当利用FICI法进行模型评估时,BITC-Thymol联用对S.aureusATCC25923和E.coliMG1655也均未表现出协同作用(FICI值均大于0.5),而当利用ΔE法进行模型评估BITC-Thymol联用对S.aureusATCC25923表现出强拮抗作用(∑SYN=0,∑ANT=-219.86);对E.coliMG1655表现出强协同作用(∑SYN=274.77,∑ANT=-19.14),两种模型评价的结果不一致。
3 讨论
为提高天然活性成分对食源性致病菌金黄色葡萄球菌和大肠杆菌的抑菌效果,本文采用棋盘法并结合数学评估模型研究了其两两联用对S.aureusATCC25923和E.coliMG1655是否具有协同抑菌作用。结果表明,Nisin-BITC联用对S.aureusATCC25923表现出了很好的协同效应。除了Nisin-BITC组合,其他组合均未表现出协同抑菌效果,这可能是因为两者抑菌机制的不同所导致的。Nisin是一种由核糖体合成,后经翻译修饰的含有34个氨基酸的抗菌肽,该多肽含有一个硫化双丙氨酸,4个β-甲基-硫化双丙氨酸环和一些不常见的残基,如脱氢丙氨酸、脱氢酪氨酸[22-24]。其抗菌活性与它和细菌细胞质膜上阴离子脂质的相互作用有关,从而导致等离子体膜的扰乱。Nisin阴离子脂质相互作用形成的孔隙会导致三磷酸腺苷(ATP)、氨基酸、预积累的铷或重要离子流失,导致细胞死亡[15,25],它和细胞质膜的相互作用由两种不同的机制产生。第一种机制,在微摩尔范围内,Nisin结合膜上的阴离子脂质表现出一种低亲和力的渗透;第二种机制中,在摩尔范围内,Nisin通过特异性识别与细胞靶膜中的脂质II相互作用,然后由4个脂质II分子和8个Nisin分子组成的脂质II依赖通路形成孔隙[11,15]。脂质II介导的孔复合体比无脂质II形成的孔更稳定[26]。而BITC也会诱导细菌膜完整性的丧失,但是其破膜作用只表现在革兰氏阴性菌上,它对革兰氏阳性菌只表现出了抑制作用,这很有可能就是BITC和Nisin发挥协同作用的主要原因。它们在抑菌过程中的协同机制还有待验证和探索。
对于联合用药评估模型的方法,除了基于LA理论非参数模型的FICI法[20]和BI理论非参数模型的ΔE法[27],还有同样基于LA理论全参数浓度效应响应曲面法和BI理论半参数浓度效应响应面方法。E是药物浓度为DA和DB(自变量)时的OD值(因变量);Emax未加药物处理的空白对照组的最大OD值;IC50,A和IC50,B分别是药物A和B抑制50%菌量时的浓度,在数值上是Emax的50%;mA和mB分别是药物A和B浓度效应曲线(Hill系数)的斜率;α是用来描述天然相互作用的参数。当参数α为正且95%置信区间不含0时,有显著协同作用,当参数为负且95%置信区间不含0时,有显著拮抗作用。E、D、Emax、IC50和m跟上述药物A和B参数相同。当ΔE为正且95%置信区间不包含0时,称显著协同作用;当ΔE为负且95%置信区间不含0时,称显著拮抗作用。
相关数据表明,BITC、Thymol和Nisin单用的使用量超出一定范围时具有毒性作用。TOXNEP数据库(https://toxnet.nlm.nih.gov/)中ChemIDplus库的数据显示,Thymol在小鼠中静脉注射的LD50>110 mg/kg时会出现嗜睡,运动失调;BITC在小鼠中皮下注射的LD50>150 mg/kg时会导致癫痫发作;Nisin在小鼠中静脉注射的正常使用剂量LD50为100 mg/kg,超出此剂量可能会存在潜在毒性作用。但是三者相互之间复配后的毒性数据尚无收录,也无相关文献报道。复配物之间若存在协同作用,会降低各使用成分的浓度,理论上会降低各自的毒性。李宏等发现[28]将含油橄榄叶提取物与化学杀菌剂二氯苯氧氯酚复配后可能存在协同抑菌作用,其复配物的毒性实验结果为无毒。顾松山等[29]发明了一种含有苯噻菌酯和灭菌唑的灭菌组合物,取得了非常显著的协同增效作用,且经大量实验证明,复配后对哺乳动物毒性未有增加。这都与理论相符,但本文所研究的三种活性成分相互之间的复配物的毒性是否具有协同作用仍需进一步的研究。
4 结论
本文结果表明,异硫氰酸苄酯复配物-乳酸链球菌素的FICI值为0.29<0.5,∑ΔE值的绝对值为451.74%>200%,评价结果为强协同作用;乳酸链球菌素-麝香草酚复配物的FICI值为0.58>0.5,∑ΔE值的绝对值为19.73%<100%,评价结果为弱拮抗作用;异硫氰酸苄酯-麝香草酚复配物的FICI值为1.50>0.5,∑ΔE值的绝对值为219.86%>200%,评价结果为强拮抗作用。除了乳酸链球菌素-异硫氰酸苄酯复配物对金黄色葡萄球菌ATCC25923具有强协同抑菌作用,其他组合协同抑菌效果均不明显。本研究为控制食源性致病菌S.aureus的感染提供了一个天然活性成份复配的配方,即Nisin和BITC复配时的IC50浓度均为8 μg/mL。
