白藜芦醇对绵羊卵母细胞体外成熟的影响
2019-11-27努日比娅姆麦麦提托合提阿尔曼海热宋玉坤刘国世阿布力孜吾斯曼
努日比娅姆·麦麦提托合提,张 博,赵 茜,阿尔曼·海热,宋玉坤,刘国世,阿布力孜·吾斯曼*
(1.新疆农业大学动物科学学院动物胚胎工程实验室,新疆乌鲁木齐 830052;2.中国农业大学动物科学技术学院,北京 100193)
随着哺乳动物体外受精-胚胎移植、转基因、细胞浆内单精子显微注射等技术的不断发展,对高质量卵母细胞及胚胎的需求日益增加,体内排出卵母细胞供不应求[1]。未成熟卵母细胞体外成熟(IVM)是提高胚胎体外生产效果的关键一步。卵母细胞在体外成熟过程中易受外界环境影响,其中活性氧(ROS)造成的损伤是降低细胞成熟质量的主要原因,并可引起胚胎发育停滞[2]。向培养基中添加适量抗氧化剂能够改善体外培养微环境,是促进卵母细胞成熟获得高质量细胞的重要途径之一[3]。白藜芦醇(Resveratrol,RES)是一种天然的高效抗氧化剂,能够避免过多ROS 引起的氧化损伤,促进卵母细胞体外成熟与胚胎体外发育[4]。猪卵母细胞IVM 液中添加RES能够维持其氧化还原平衡,促进细胞体外成熟[5]。山羊卵母细胞IVM 液中添加RES 显著提高细胞内谷胱甘肽(GSH)水平,最终改善孤雌生殖和手工克隆胚胎发育潜力[6]。绵羊[7]、牛[8]卵母细胞IVM 液中分别添加RES 能够促进细胞体外成熟,提高受精率、囊胚率及囊胚平均细胞数。目前,在国内尚未报道RES 对绵羊卵母细胞核质成熟的影响。因此,本实验旨在研究不同浓度RES 对绵羊卵丘细胞扩展和卵母细胞第一极体排出及细胞质内ROS 和GSH 水平的影响,探究RES 卵母细胞抵抗氧化应激能力,促进卵母细胞体外成熟的调控机制,为卵母细胞体外成熟的研究提供参考。
1 材料与方法
1.1 材料 促卵泡素(FSH)、促黄体素(LH)、雌二醇(E2)、无脂肪酸-BSA、肝素钠、透明质酸酶等购自Solarbio 公司;RES、TCM199、聚乙烯醇(PVA)、HEPES、HEPES-Na、酚红、NaHCO3、葡萄糖、乳酸钠、丙酮酸钠、青霉素、链霉素、矿物油、无机盐等均购自美国Sigma 公司;CMF2HC,H2DCFDA 购自Invitrogen 公司。
1.1.3 试剂配制 采卵液:9.5 g/L TCM199,4 g/L BSA,2500 U/L 肝素钠,5 mmol/L NaHCO3,0.01 g/L 酚红,10 mmol/L HEPES,10 mmol/L HEPES-Na,100 mg/L青霉素,100 mg/L 链霉素,4℃保存。
体外成熟基础液:9.5 g/L TCM199,6 g/L BSA,500 U/L FSH,500 U/L LH,1 mg/L E2,25 mmol/L NaHCO3,5.5 mmol/L 乳酸钠,2 mmol/L 丙酮酸钠,1.5 mmol/L葡萄糖,0.1 g/L 青霉素,0.1 g/L 链霉素。用0.22 μm 的微孔滤膜过滤,4℃保存。
0.1% 透明质酸酶:1 g/L 透明质酸酶,9.5 g/L TCM199,2.1 g/L NaHCO3,-20℃保存。
DPBS:8 g/L NaCl,0.2 g/L KCl,0.05 g/L KH2PO4,2.17 g/L Na2HPO4·7H2O,0.13 g/L CaCl2·2H2O,0.1 g/L MgCl2·6H2O;pH 调至7.2~7.4,在4℃保存。
Tyrodes medium:8 g/L NaCl,0.2 g/L KCl,0.2 g/L CaCl2·2H2O,0.1 g/L MgCl2·6H2O,0.05 g/L NaH2PO4,1 g/L NaHCO3,4℃保存。
DPBS-PVA:1 g PVA 热溶于1 L DPBS 中。
荧光染色工作液:10 μmol/L H2DCFDA(ROS),10 μmol/L CMF2HC(GSH),现配现用。
配制RES 浓度:对照组为基础培养液;实验组在基础培养液中添加0.5、2.0、5.0 μmol/L RES 配成不同RES 浓度的IVM 液,4℃保存。
1.2 实验方法
1.2.1 卵母细胞收集及体外培养 将采自新疆乌鲁木齐市新华凌羊屠宰场的绵羊卵巢装在含双抗38.5℃的生理盐水中,在2~4 h 内运送到实验室,用生理盐水轻缓清洗3 遍。将38.5℃预热的适量采卵液倒入90 mm 的塑料培养皿中,将清洗完的卵巢(5~10 个)放置此培养皿中,用眼科镊和23 号的手术刀片进行卵泡轻柔紧密割卵,从而使卵母细胞流入采卵液。在体视显微镜下,挑选出卵丘颗粒细胞紧密包围和细胞质均匀的卵母细胞。用洗卵液清洗3 次,移入已预热70 μL 的成熟培养滴中,在38.5℃、5%CO2的饱和湿度培养箱中进行体外成熟24 h。
1.3 实验设计
1.3.1 添加不同浓度RES 对体外成熟绵羊卵丘扩展率和卵母细胞核成熟的影响 使用含有不同浓度RES(0、0.5、2.0、5.0 μmol/L)的IVM 培养基成熟绵羊卵母细胞24 h,并观察卵丘扩展率情况,统计第一极体形成率。将收集的卵母细胞随机分为4 组,分别进行3 次重复。
1.3.2 添加不同浓度RES 对体外成熟绵羊卵母细胞细胞质中ROS 和GSH 含量的影响 使用含不同浓度RES(0、0.5、2.0、5.0 μmol/L)的IVM 培养基成熟绵羊卵母细胞24 h,透明质酸酶去除颗粒细胞后,H2DCFDA(检测ROS)或CMF2HC(检测GSH)进行细胞质染色,在荧光倒置显微镜下采集绿、蓝色荧光图像,采用Image-pro plus 软件进行分析其积分光密度(IOD)和荧光 面积(AREA),计 算平均密度(MOD,MOD=IOD/AREA),即为平均荧光强度。平均荧光强度值反映细胞内ROS 和GSH 水平。将卵母细胞随机分为4 组,分别进行5 次重复。
1.4 观察指标及方法
1.4.1 观察卵丘细胞扩展情况 卵母细胞IVM 24 h 后,在体式显微镜下直接观察拍照。采用Vanderhyden B C[9]的分级方法,将卵丘细胞扩展分为G1、G2、G3、G4 级。G1 级:没有扩展,通常卵丘细胞已经贴壁,卵母细胞已经发黑;G2 级:最外1~2 层颗粒细胞有扩展;G3 级:卵丘细胞呈蓬松状态,外侧的几层细胞扩展,开始呈放射冠,部分未扩展;G4:包括放射冠在内全部扩展开来,细胞间粘性较弱,而且外周部分细胞已开始脱落。并把G3,G4 级扩展定为卵丘扩展状态;G1、G2 级扩展定为卵丘未扩展状态。扩展率为G3,G4 级扩展细胞个数占总细胞个数的百分率。
1.4.2 观察第一极体的排出情况 将IVM 24 h 以后的卵母细胞在0.1%的透明质酸酶里用移液枪反复吹打,脱掉卵丘和颗粒细胞,吹打时间控制在30s 内,脱完颗粒的卵母细胞用洗卵液洗3 次,在体视显微镜下观察第一极体排出情况。
1.4.3 卵母细胞胞质内ROS 和GSH 的检测 通过H2DCFDA和CMF2HC 荧光染料检测细胞内ROS 和GSH 水平。将成熟24 h 后脱去颗粒细胞的卵母细胞用PVA-DPBS洗涤,然后放入含有10 μmol/L H2DCFDA(检测ROS)或10 μmol/L CMF2HC(检测GSH)的染色液中,并在37℃避光染色30 min。染色后适当洗涤,然后放入10 μL的PBS 液滴中,在装有蓝光/ 紫外线滤光片的荧光倒置显微镜上观察荧光及采集图像,所有拍照曝光时间参数为2.696 s(ROS)和1.493 s(GSH)。通过Image-pro plus 软件进行荧光强度分析。
1.5 统计分析 利用Image-pro plus 软件检测细胞内ROS 和GSH 荧 光 强 度,运 用Excel 和SPASS 23.0 的LSD 法进行单因素方差分析(ANOVA),以P<0.05作为差异显著性判断标准,结果采用平均数±标准误差表示。
2 结果
2.1 添加不同浓度RES 对卵丘细胞扩展率的影响 如表1 所示,与对照组相比,添加0.5 μmol/L RES 卵丘细胞扩展率有提高的趋势(P>0.05),浓度增至5.0 μmol/L RES时会显著降低卵丘扩展率。因此,添加0.5 μmol/L RES并不影响卵丘细胞扩展率。0.5 μmol/L RES 组卵母细胞第一极体排出率显著高于对照组和其他试验组,对照组和2.0 μmol/L 试验组之间无显著差异。随RES 浓度的增高卵母细胞第一极体排出率有下降的趋势,添加5.0 μmol/L RES 显著降低卵母细胞第一极体排出率。结果表明,5.0 μmol/L RES 对卵母细胞核成熟有抑制作用。
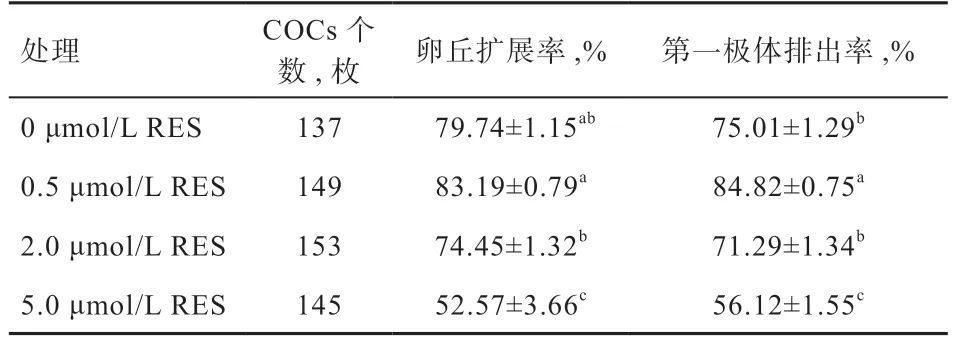
表1 不同浓度的白藜芦醇对绵羊卵丘细胞扩展的影响
2.2 添加不同浓度的白藜芦醇对卵母细胞质内ROS 水平的影响 如表2 和图1 所示,添加0.5 μmol/L RES 显著降低细胞胞质内ROS 含量;5.0 μmol/ RES 组的ROS 水平显著高于对照组。由此可知,添加0.5 μmol/L RES 可以显著改善IVM 绵羊卵母细胞氧化还原状态;5.0 μmol/L RES 对细胞成熟有负面作用。

表2 不同浓度的白藜芦醇对绵羊卵母细胞质内ROS 水平的影响
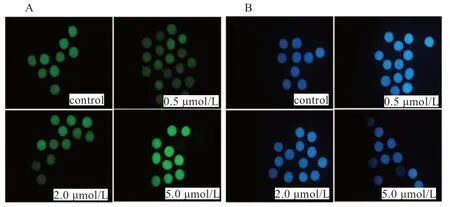
图1 白藜芦醇对成熟后卵母细胞ROS 和GSH 含量的影响(10x10)
2.3 添加不同浓度的白藜芦醇对细胞内GSH 水平的影响如表3 所示,IVM 液中添加0.5 μmol/L RES 显著提高卵母细胞胞质内GSH 含量,高浓度处理组5.0 μmol/L RES 细胞胞质内GSH 含量显著低于对照组;随RES 浓度增加绵羊卵母细胞内GSH 含量有逐渐下降的趋势。因此,最佳添加浓度0.5 μmol/L RES 可以显著增强绵羊卵母细胞IVM 的抗氧化能力,促进绵羊卵母细胞细胞质成熟。
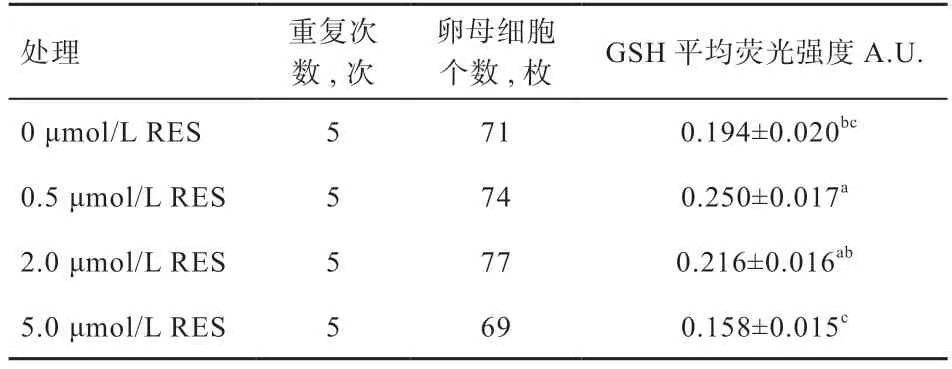
表3 不同浓度的白藜芦醇对绵羊卵母细胞质内GSH 水平的影响
3 讨 论
IVM 后卵母细胞排出第一极体是细胞核成熟的标志[10],细胞胞质内的GSH 含量是细胞胞质成熟程度的一个特异性指标[11]。RES 属于高效抗氧化剂,在细胞内发挥着重要作用。本研究表明,在绵羊卵母细胞IVM 培养液中添加不同浓度RES 对卵母细胞核质成熟有显著影响。在IVM 液中添加0.5 μmol/L RES 显著改善卵母细胞体外成熟能力,促进卵丘细胞扩展及第一极体的形成;高浓度5.0 μmol/L RES 试验组显著降低细胞核成熟率。此结果与Zabihi 等[7]研究结果相同,浓度为0.5 μmol/L RES 对绵羊卵母细胞核成熟的效果最佳,高浓度5.0 μmol/L RES 有抑制细胞体外成熟的趋势。Liu 等[12]研究发现在老龄小鼠和人类卵母细胞成熟液中添加1.0 μmol/L RES 显著提高第一极体排出率,显著改善纺锤体和染色体的正常形态;此外,增强老龄小鼠卵母细胞中SIRT1、CAT、SOD1 和GPX4 等基因的表达模式。Wang 等[8]研究表明,1.0 μmol/L RES 能显著促进牛卵丘扩展和极体形成,提高卵母细胞体外受精后囊胚率、孵化囊胚率和囊胚细胞数。
本研究报道,0.5 μmol/L RES 显著降低细胞胞质内ROS 含量,提高GSH 含量,从而提高卵母细胞体外成熟能力。高浓度5.0 μmol/L RES 增加胞质内ROS 含量,而降低卵母细胞质量。Mukherjee 等[6]得到了相同的研究结果,在IVM 培养基中添加0.25 μmol/L 和0.5 μmol/L RES 可促进山羊卵母细胞细胞质成熟,减少细胞ROS含量并提高细胞GSH 含量。而Li 等[13]研究报道,添加2.0 μmol/L RES 不仅改善猪体外热应激条件的卵母细胞核成熟,而且提高卵母细胞GSH 水平,降低ROS水平,并可上调卵母细胞内SIRT1 基因的表达量。Kwak 等[14]研究得出,适宜浓度的RES 能够增加细胞内GSH 含量并降低ROS 含量,从而提高猪卵母细胞体外成熟和体外受精胚胎的发育潜能,同时调节卵母细胞成熟相关基因的表达。在猪卵母细胞玻璃化冷冻保存液中添加RES 对未成熟卵母细胞的损伤及卵母细胞内ROS 和GSH 含量无影响,但在玻璃化冷冻后的猪卵母细胞IVM 液中添加2.0 μmol/L RES 显著提高存活卵母细胞发育到囊胚期的发育能力[15]。陈培芳[16]研究表明,低氧培养条件下,适量浓度的RES 显著提高小鼠2-细胞、4-细胞和囊胚内抗氧化相关GPX 1、Mn-SOD、PRDX3、GLS2等基因的表达。添加1.0 μmol/L RES能够诱导牛卵母细胞孕激素分泌和降低胞内ROS 水平、提高GSH 水平,并可能通过SIRT1 途径提高牛卵母细胞成熟及体外受精后发育效率[8]。有研究报道[17],RES可下调囊胚中促凋亡相关Caspase-3、Bcl-2等基因的表达,上调Bax基因的表达,进而预防细胞凋亡,及阻止因此引起的胚胎发育损伤。本实验结果与前人研究结果差异可能与不同种类动物细胞在不同条件下对RES 的敏感性有关。目前,RES 对绵羊早期胚胎发育及卵母细胞凋亡mRNA 水平的影响是本实验下一步的研究计划。
4 结 论
绵羊卵母细胞IVM 液中添加0.5 μmol/L RES 能够促进卵丘细胞的扩展及第一极体的形成,而提高卵母细胞核成熟。同时,降低细胞内ROS 含量及提高GSH 含量,并通过提高细胞抵抗氧化能力促进细胞胞质成熟及提高细胞胞质质量;高浓度5.0 μmol/L RES 对绵羊卵母细胞成熟有抑制作用。
