下调BAP31基因表达抑制结直肠癌细胞增殖侵袭及Wnt/β-catenin信号
2019-11-27李玉山孙建明李菊兰
李玉山 孙建明 李菊兰
(1武威市中医院,甘肃 武威 733000;2武威市凉州区西关街社区卫生服务中心)
结直肠癌的发生发展过程复杂,涉及基因表达过度、基因突变等〔1,2〕。B细胞受体相关蛋白(BAP)31基因定位于Xq28,属于BAP家族成员之一,在1994年被首次鉴定,是内质网上不可缺少的跨膜蛋白,在进化上保守,且在各个组织表达广泛,以往研究发现,BAP31可介导小细胞小泡蛋白、主要组织相容性复合体(MHC)-Ⅰ等分子离开内质网以囊泡形式向其他细胞器运输〔3〕;也可参与细胞凋亡的调节〔4〕。近些年的研究发现,不同组织中BAP31表达水平并不相同,在人体正常组织低表达或不表达(除睾丸组织外),大多数恶性黑色素瘤BAP31高表达,可能是该病免疫治疗的靶点〔5〕。结直肠癌细胞中BAP31表达明显高于结肠上皮细胞,miR-451a调控BAP31诱导结直肠癌细胞凋亡〔6〕。BAP31对结直肠癌细胞增殖侵袭的影响及机制研究的尚未明确。本研究通过RNA干扰技术抑制结直肠癌细胞BAP31表达,观察细胞的增殖及侵袭能力,并进一步研究其作用机制。
1 材料方法
1.1主要试剂和仪器 RPMI1640培养基、胎牛血清(FBS)均购自美国Gibco;细胞计数试剂盒(CCK)8试剂盒购自日本同仁公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自碧云天生物技术研究所;Transwell侵袭小室购自美国Corning公司;BAP31、β-catenin、增殖细胞核抗原(PCNA)、基质金属蛋白酶(MMP)-2和甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购自美国Abcam;LipofectamineTM 2000购自美国Invitrogen;酶标仪购自美国Thermo。
1.2细胞及培养 正常结肠上皮细胞NCM460及结直肠癌DLD-1,HT29,SW620和 HCT116细胞均购自美国ATCC。细胞在含10%FBS的RPMI1640培养液中,于37℃、5%体积分数CO2培养箱中常规培养传代。实验为生长至对数期的细胞。
1.3Western印迹 RIPA裂解液适量提取细胞总蛋白,BCA法测定样品蛋白浓度,每孔30 μg上样蛋白,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白分离后转移至聚偏氟乙烯(PVDF)膜,以5%的脱脂奶粉封闭转好的膜1 h,洗膜,加BAP31、β-catenin、PCNA、MMP-2和内参GAPDH抗体(皆为1∶1 000稀释),4℃摇床孵育过夜,洗膜,加已配置好的1∶2 000稀释的辣根过氧化物酶(HRP)标记的二抗,室温摇床孵育1 h,增强化学发光法(ECL)显色,显影、定影。以目的蛋白与GAPDH灰度值比值为各蛋白的相对表达量。实验重复3次。
1.4siRNA转染 根据GeneBank中提供的BAP31基因的cDNA序列,依据siRNA设计原则,设计针对BAP31的特异性siRNA及阴性对照siRNA,分别命名为si-BAP31组和NC组,由上海吉玛合成纯化。转染前1 d接种 HCT116细胞于6孔板,密度为1×105个/孔,观察到细胞生长融合达80%~90%时,参照LipofectamineTM2000说明,制备siRNA-Lip2000混合物,并将混合物加入至6孔板,同时设置空白对照组,仅加入脂质体,于培养箱内孵育5~6 h,更换为含血清及抗生素的培养基,继续培养48 h。收集细胞,用于后续实验研究。
1.5CCK8法检测细胞活力 取生长至对数期的HCT116细胞,胰酶消化后以5×103个/孔接种于96孔板,每孔200 μl,于培养箱内常规培养24 h,转染si-BAP31和NC,并设置空白对照组,每组设置5个复孔,分别收集转染后24、48和72 h的细胞,加入CCK8试剂,每孔10 μl,37℃孵箱1.5 h后于450 nm处使用酶标仪测定吸光度值(A值)。实验重复3次。
1.6Transwell小室检测细胞侵袭能力 Matrigel胶铺在Transwell小室的上室面,室温风干。取生长至对数期的HCT116细胞,参照1.4分组及转染方法制备成不含血清的单细胞悬液100 μl(约1×105个细胞),加入到Transwell小室的上室内,下室加入含FBS的RPMI1640培养液600 μl,培养箱内常规培养,48 h后,取出小室,4%的多聚甲醛固定20 min,0.1%的结晶紫染色20 min,棉签轻轻擦拭干净小室内的细胞,随机选择5个视野,倒置显微镜观察穿膜细胞数,取均值,实验重复3次。
1.7统计学方法 采用SPSS21.0软件进行方差分析,SNK-q检验。
2 结 果
2.1BAP31在结直肠癌细胞表达 以正常结肠上皮细胞NCM460为对照细胞,Western印迹检测结直肠癌DLD-1,HT29,SW620和 HCT116细胞中BAP31的蛋白表达(0.232±0.025、0.316±0.030、0.278±0.029、0.488±0.051)均显著高于在NCM460细胞的表达(0.078±0.008,P<0.05)。见图1。
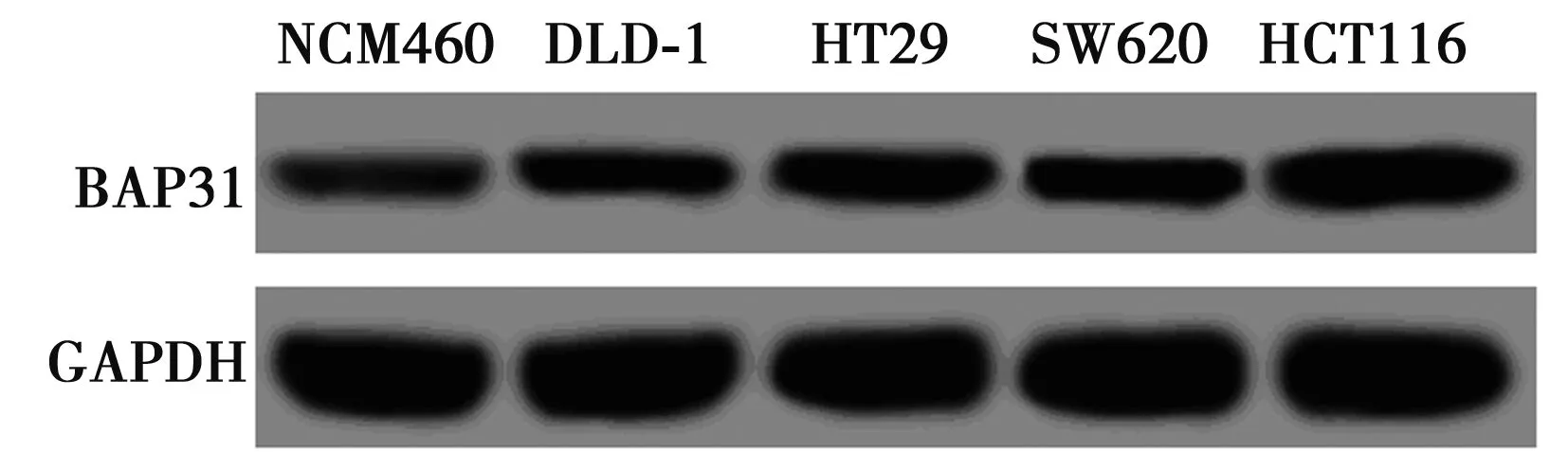
图1 BAP31在结直肠癌细胞表达
2.2si-BAP31转染HCT116细胞效果 si-BAP31组BAP31表达(0.108±0.011)显著低于空白对照组(0.658±0.052,P<0.05),NC组BAP31表达(0.669±0.055)与空白对照组差异无统计学意义(P>0.05)。见图2。

图2 si-BAP31转染的HCT116细胞BAP31的蛋白表达
2.3si-BAP31转染抑制HCT116细胞活力 与NC组比较,si-BAP31组在24、48和72 h的细胞活力均显著降低(P<0.05)。见表1。

表1 si-BAP31对HCT116细胞活力的影响
与NC组比较:1)P<0.05,下表同
2.4si-BAP31转染抑制HCT116细胞侵袭能力 空白对照组穿膜细胞数(202.4±7.1)个、NC组(198.9±6.7)个、si-BAP31组(116.5±3.2)个。与NC组比较,si-BAP31组细胞侵袭能力显著降低(P<0.05)。
2.5si-BAP31转染抑制HCT116细胞Wnt/β-catenin信号通路 与NC组比较,si-BAP31组β-catenin、PCNA和MMP-2的蛋白表达均显著降低(P<0.05)。见图3,表2。

图3 si-BAP31转染对HCT116细胞β-catenin、PCNA和MMP-2蛋白表达的影响

组别β-cateninPCNAMMP-2空白对照组0.572±0.0460.188±0.0200.162±0.017NC组0.591±0.0500.196±0.0230.157±0.015si-BAP31组0.142±0.0161)0.102±0.0101)0.082±0.0901)
3 讨 论
BAP31在进化上高度保守,在哺乳动物的细胞中广泛存在,参与新生蛋白内质网生产和分泌过程〔7〕。有研究表明,结直肠癌DLD-1,HT29,SW620和 HCT116细胞中BAP31表达明显高于结肠上皮细胞,且在HCT116细胞表达最高〔6〕,本研究结果与前人〔6〕一致。因此,选择HCT116细胞为研究对象。RNA干扰(RNAi)是近些年发展起来的一种在转录后阻断基因表达的新技术,能特异性、高效性的抑制基因表达,与其他基因阻断技术比较有更多的优势,目前已广泛应用于肿瘤治疗、基因功能研究等方面〔8,9〕。有研究表明,抑制宫颈癌中BAP31表达能降低细胞增殖、侵袭和迁移能力,并阻滞细胞于G0/G1期〔10〕。BAP31对结直肠癌细胞增殖侵袭的影响尚未明确。本研究表明BAP31表达参与结直肠癌的侵袭过程。肿瘤的侵袭转移对患者的预后造成严重的影响,明确肿瘤侵袭转移机制,并探究抑制机制将为肿瘤患者带来福音。Wnt/β-catenin是Wnt信号通路中的经典信号途径,参与细胞的增殖、凋亡等过程,多种肿瘤中处于激活状态,其激活可导致肿瘤发生〔11~13〕。β-catenin为Wnt/β-catenin信号的关键分子,可通过与细胞膜上的钙黏蛋白和细胞骨架结合发挥细胞结构维持及黏附作用。结直肠癌组织中β-catenin异常堆积,而β-catenin的过表达与肿瘤浸润深度及局部去分化有关〔14〕。也有研究表明,抑制β-catenin表达可降低结直肠癌发生发展〔15〕。肿瘤细胞侵袭转移能力与蛋白酶降解ECM、基底膜能力密切相关。MMPs是一组重要的蛋白酶,在肿瘤侵袭及转移过程中发挥重要作用,MMP-2为MMPs家族成员之一,在包括结直肠癌在内的多种肿瘤中表达升高,而抑制其表达可降低癌细胞的侵袭及迁移能力〔16,17〕。PCNA是合成DNA不可缺少的因子,其表达水平可反应出细胞的增殖状态,目前已作为细胞增殖活性检测的指标〔18〕。本研究结果提示BAP31抑制结直肠癌增殖侵袭的机制可能通过下调Wnt/β-catenin信号途径。
