传统老坛自然发酵泡菜中真菌群落结构多样性分析
2019-11-26吕嘉枥晁倩文刘秉坤
吕嘉枥, 晁倩文, 刘秉坤, 罗 潇
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
泡菜是不同蔬菜经多菌群微生物发酵而成的发酵食品,不同地域条件、发酵方式、原辅料等对菌群均有一定影响,进而对其风味和质量产生影响[1].因此,对泡菜菌群的研究具有重要的理论与实际意义.目前,对泡菜中菌群的研究大多集中在细菌方面,主要通过传统分离方法、通量测序法和PCR-DGGE等方法,研究细菌群落组成、优势菌群及其与产品质量的关系[2-8].泡菜中乳酸菌种类及含量直接影响到泡菜的质量,发酵过程中乳酸积累导致坛内pH降低,从而抑制一些腐败菌的生长[9,10],而且乳酸菌对于发酵泡菜的品质形成发挥多重作用,如增进营养价值、改善食品风味等,对产品质量的提高起到了重要作用[11-19].
但是,传统泡菜发酵的菌群除了细菌的主要作用以外,还有其他菌群的参与.已有研究报道,在泡菜发酵前期或取样和加样导致的发酵坛内氧分压较大时,有利于酵母菌的生长,且发酵过程中的有益酵母菌有利于泡菜品质和风味的形成,影响产品的质地和储藏[20],但是酵母菌较多时,泡菜感官明显降低[21].
例如,高术杰[22]对人工发酵蔬菜的研究进展进行分析,论述了泡菜中酵母菌的研究进展,结果表明,发酵前期酵母菌属主要为异常汉逊酵母、德式酵母、罗斯酵母等,随着发酵时间增长,酵母菌成倍增长;孟霞等[23]采用18S rDNA对青菜泡菜样品真菌菌群进行研究,发现德巴利世酵母和假丝酵母在发酵前期占主要优势.近期,李恒等[2]采用高通量测序方法分析了连续发酵20代泡菜母水真菌群落结构多样性,结果表明酿酒酵母属和假丝酵母属为主要的优势菌,其中酿酒酵母属随着连续发酵次数的增加丰度由91%上升至99%.可见,泡菜中真菌种群的显著差异直接影响产品的质量及其安全性等[24,25].张勇等[26]采用26S rDNA对传统发酵浆水中酵母菌进行研究,结果表明主要有地霉属、毕赤酵母属、阿氏丝孢酵母、解脂假丝酵母、伊萨酵母.
因此,本研究为揭示陕西西安地区市售泡菜产品中真菌菌群结构多样性,以具有代表性的市售传统老坛自然发酵泡菜为试验样品,采用Illumina Miseq 高通量测序技术,分析其真菌群落结构多样性,为进一步研究泡菜发酵过程中真菌菌群结构对其质量及其安全性的影响奠定基础.
1 材料与方法
1.1 供试样品
通过前期工作对在西安不同地区采集的30个泡菜样品中的菌群形态的显微观察和感官评定,本研究试验样品的选取是根据样品中菌群形态多样性、采样地点分布、配方中的蔬菜主料和添加的辅料组成以及感官等方面,选取了其中的5种泡菜样品.其编号及配方如表1所示.

表1 五种市售传统发酵泡菜样品
1.2 试剂
FastDNASpin Kit for Soil试剂盒:Mpbio公司;AxyPrepDNA试剂盒:AXYGEN公司;2×TaqPCR MasterMix染料:Biomed公司;NEBNext Ultra II DNA Library Prep Kit试剂盒:NEB; AMPureXP试剂盒:Beckman Coulter公司;Agilent DNA 1000 Kit试剂盒:KAPA;HT DNA-Extended Range LabChip试剂盒:PerkinElmer;MiSeqReagent Kit v3 (600 cycle)(PE300)试剂盒:Illumina;MiSeq Reagent Kit v2 (500cycle)试剂盒:Illumina.
1.3 仪器与设备
高通量二代测序仪,MiSeq,illumina公司;凝胶成像分析系统,JY04S-3C,北京君意东方电泳设备有限公司;核酸电泳仪,JY600C,北京君意东方电泳设备有限公司;冷冻离心机,5430R,Eppendorf公司.
1.4 实验方法
真菌群落结构多样性分析:分别采用PCR扩增ITS1(ITS 1-ITS 2)区基因片段并进行Illumina高通量测序分析真菌群落结构多样性.
1.4.1 基因组DNA的抽提
采用基因组提取试剂盒,参照说明书,提取样品总DNA,然后利用1%琼脂糖凝胶电泳进行检测.
1.4.2 PCR扩增及Illumina测序
对样品基因组扩增ITS1(ITS1-ITS2)区,引物序列为5'-CTTGGTCATTTAGAGGAAGTAA-3′和5′-TGCGTTCTTCATCGATGC-3′.
25μLPCR扩增反应体系:DNA样品X(30 ng),Forward Primer(5 uM)1μL,Reverse Primer(5 uM)1μL ,BSA(2 ng/μL)3μL,2xTaqPlus Master Mix 12.5μL,ddH2O (7.5-X)μL.
扩增程序:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,32个循环;72 ℃最终延伸7 min,4 ℃保温.每个样品3个重复,将同一样本的PCR产物混合后用1%琼脂糖凝胶电泳检测.
PCR产物合并:参照电泳初步定量结果,将PCR产物检测定量,之后按照每个样本的测序量要求,进行相应比例的混合.
Miseq文库构建及Miseq测序:将合并的PCR产物按照建库试剂盒说明书进行文库制备,针对已构建文库,用试剂盒进行Miseq测序.
1.4.3 生物信息学统计分析
对Miseq测得的fq数据根据PE测序的overlap关系将成对的序列拼接(merge)成一条序列.同时对序列质量及拼接效果进行质控过滤,根据序列首尾两端的barcode和引物区分样品,并调整序列方向.用usearch按照97%相似性序列进行OTU聚类(不含单序列)[27,28],得到代表序列再将其全部序列按照97%相似度map到OTU上形成OTU列表.进一步对微生物测序进行深度分析,并依次在kingdom(界) 、phylum(门)、class(纲) 、order(目) ,family(科) 、genus(属) 、species(种) 分类水平上统计各个发酵蔬菜样品的群落组成(α群落结构多样性),包括计算Chao,Ace,Shannon,Simpson指数,分析细菌群落丰度和群落结构多样性并计算Coverage评估测序深度[29];根据多个样本中所共有及特有的OTU数目,绘制韦恩图,并结合属水平上的菌群组成柱状图、核心属分布热图、属水平下样本聚类树与柱状图组合分析图,分析菌群的群落结构多样性[29].
2 结果与讨论
2.1 PCR扩增产物
分别对5种传统发酵泡菜样品的总基因组进行提取,并针对ITS1(ITS1-ITS2)区基因片段进行PCR扩增,根据不同测序数据类型选用不同的参考数据库用usearch软件去除嵌合体,通过mothur去掉长度较小的tags;首先对测得的fq数据进行过滤处理,过滤read尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的read;然后根据PE测序的overlap关系将成对的序列拼接(merge)成一条序列.其每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱,2%琼脂糖电泳检测,结果如图1所示.
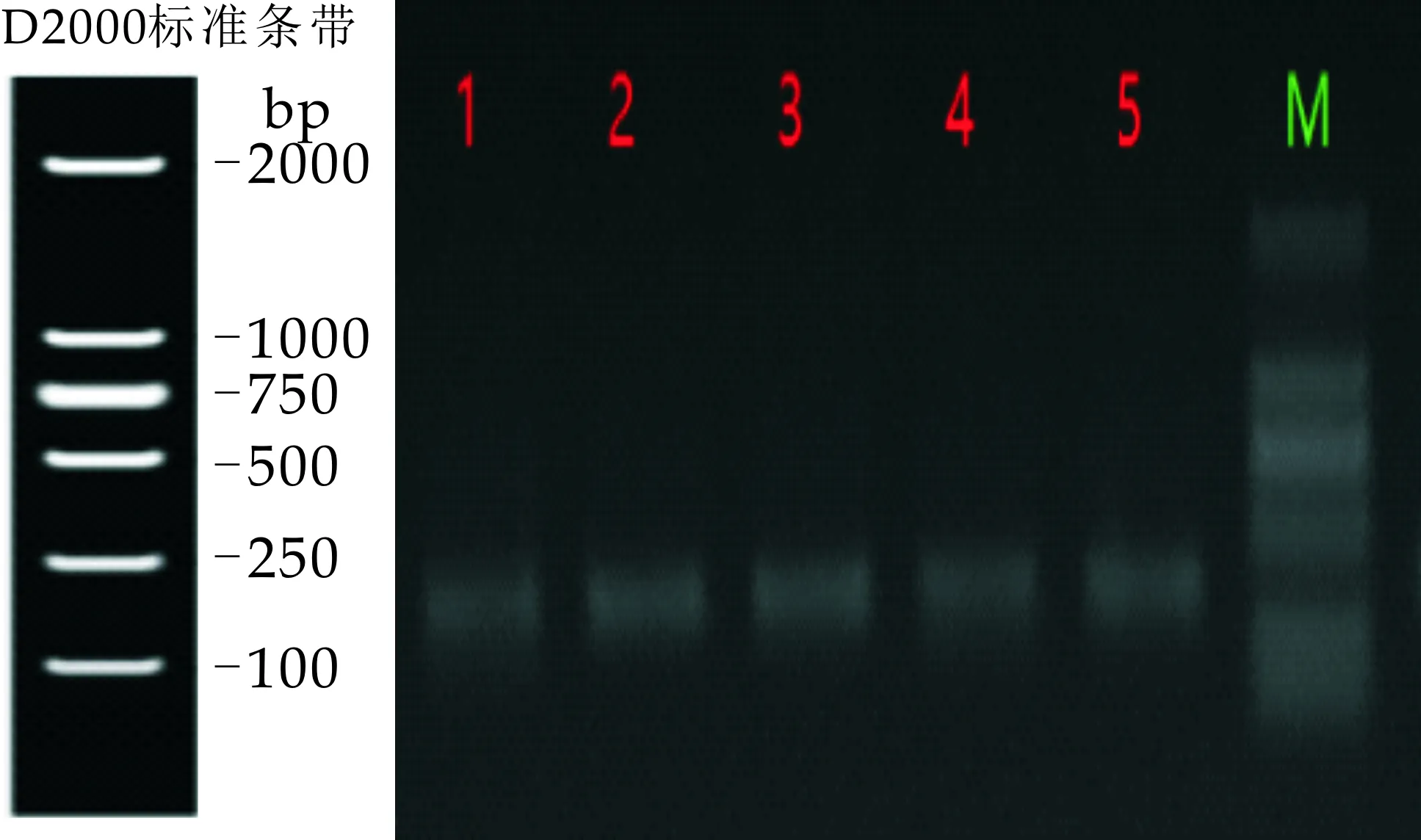
图1 五种传统发酵泡菜样品真菌基因组PCR产物电泳图
由图1可知,五种样品在250~500 bp对应的位置都有清晰的条带,证明PCR产物目的条带大小正确,浓度合适,为后续实验的准确性提供了保障.
2. 2 真菌群落α-群落结构多样性分析
通过单样品的多样性分析(Alpha多样性)可以反映微生物群落的丰度和多样性[29],其中Chao1即菌种丰富度指数,用以估计群落中的OTU数目.五种传统发酵泡菜样品真菌群落α-群落结构多样性分析见表2所示.
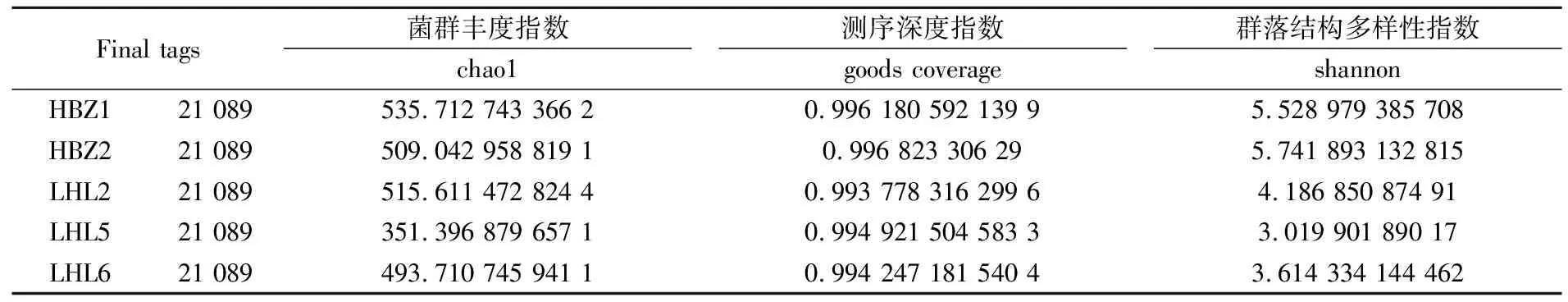
表2 五种传统发酵泡菜样品中真菌群落结构多样性指数
由表2可知,测试的五种样品,测序深度均在0.993以上,能够代表各样品中真菌种群的真实情况.真菌菌群落群落结构多样性指数(OTUs、Chao、Shannon)对比表现出明显的差异,结果为HBZ1样品的菌群丰度指数最高,其次是HBZ2和LHL2,样品LHL5、LHL6的菌群丰度指数最低.表明HBZ1样品中真菌菌群较多,HBZ2、LHL2次之,LHL5、LHL6较少.
2.3 OTUs统计及分类学分析
OTU(Operational Taxonomic Units)通常对97%的相似水平下的OTU进行生物信息统计分析.本实验对五种样品的有效数据进行聚类总共得到580个OTUs,样品共有OTU 165个,分为7个门、22个纲、62个目、118个科、178个属、321个种.
2.4 样品OTU分布Venn图
Venn图[30]可用于统计多个样本中所共有和独有的OTU数目,可以比较直观的表现环境样本的OTU数目组及其样本或分组之间的重叠情况.分析五种样品共有OTU,采用R语言工具统计和作图绘制OTU分布Venn图,结果如图2所示.由图2可以看出,五种样品共有OUT 165个,两两样品间也存在共同的OTU.其中HBZ1、HBZ2、LHL2、LHL5、LHL6特有OTU分别为10、6、9、5、2个.
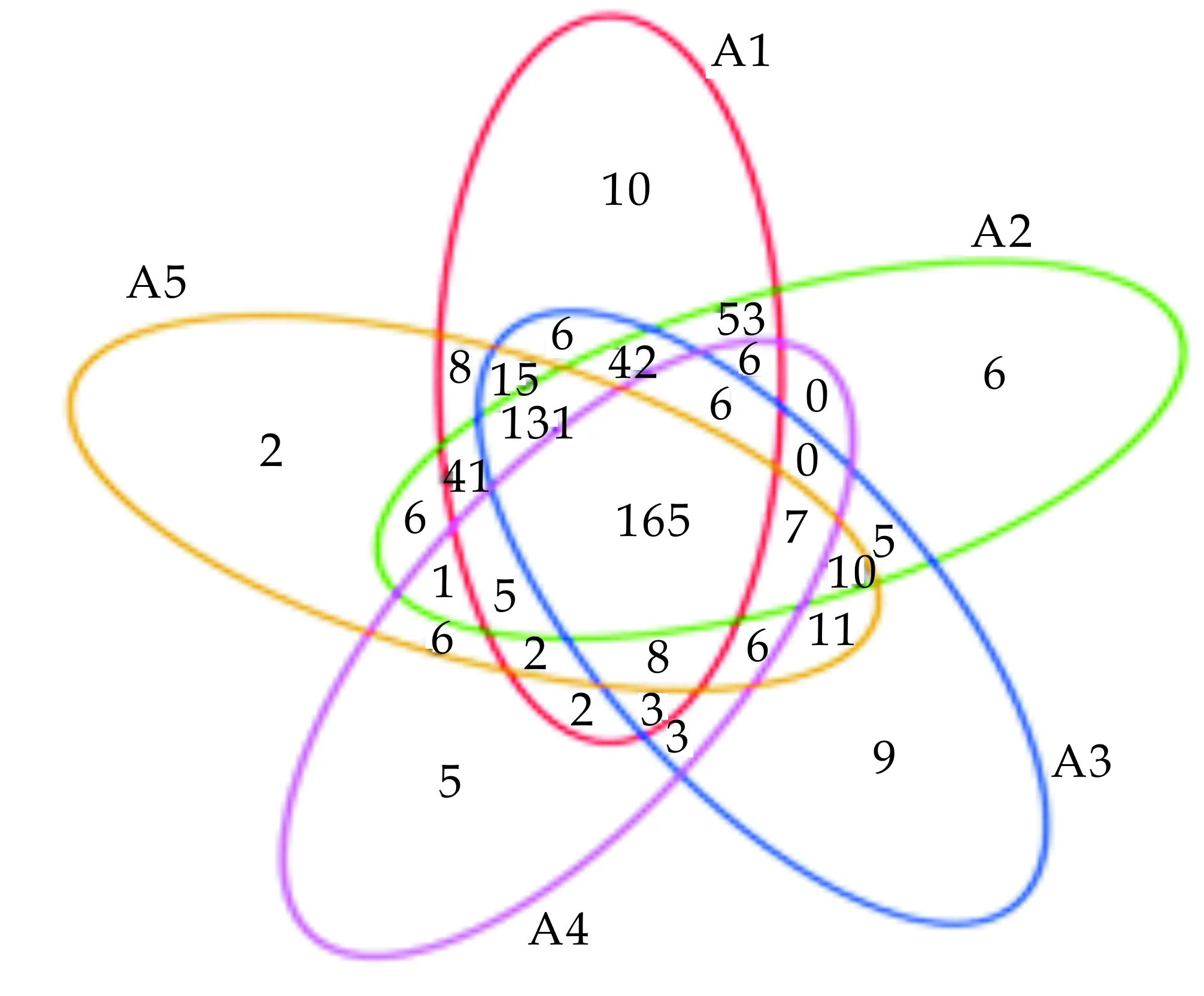
图2 五种传统发酵泡菜样品OTU分布Venn图
2.5 五种传统发酵泡菜样品真菌群落结构分析
根据分类学分析结果,可以得知一个或多个样本在各分类水平上的分类学比对情况.因此,可以使用统计学的分析方法,观测样本在不同分类水平上的群落结构[31].采用R语言作图工具,本文从门、纲、目、科、属等五个水平上作柱状图,五种样品在不同水平上的真菌组成结果如图3~7所示.
在门分类水平上,五种样品共注释到明确地位的7个门的真核微生物,分别是Ascomycota(子囊菌门)、Chytridiomycota(壶菌门)、Glomeromycota(球囊菌门)、Rozellomycota、Basidiomycota(担子菌门)、Olpidiomycota、Mortierellomycota(鞭毛菌门).优势菌占比情况如图3所示,其中Ascomycota占绝对优势,在HBZ1、HBZ2、LHL2、LHL5、LHL6中的丰度依次是82.72%、85.76%、89.16%、90.89%、77.32%,其次是Basidiomycota,在各样品中的丰度依次是9.83%、6.34%、8.65%、8.50%、20.24%.由检测结果可知,五种样品中的绝对优势菌群均为Ascomycota(子囊菌门),而HBZI和HBZ2菌群种类差别不大,说明在门水平上五种样品的菌群丰富度差别不是很显著.而李恒等[2]对四川地区泡菜研究结果表明,在泡菜发酵过程中,真菌群落在门水平上的变化规律为,Ascomycota占绝对优势,所占比例在达到99%以上,是泡菜中主要真菌群类,这与本文的研究结果较为相似.但是还有不足1%的其他门的真菌与本研究结果有一定差异,可能是地域、原辅料等不同所致.

图3 五种传统发酵泡菜样品在门的水平上的真菌组成
在纲分类水平上,五种样品共注释到明确地位的22个纲,还有未鉴定到纲水平的OTU.占比情况如图4所示.其中Saccharomycetes(酵母纲)占绝对优势,在HBZ1、HBZ2、LHL2、LHL5、LHL6中的丰度依次是39.12%、37.77%、74.45%、87.51%、60.29%;其次Sordariomycetes(粪壳菌纲)占优势,在上述各样品中的丰度依次是26.87%、31.39%、4.93%、1.56%、6.28%;Agaricomycetes(伞菌纲)占比仅次于Sordariomycetes,在各样品中的丰度依次为8.65%、5.18%、7.94%、3.26%、19.43%.此外还检测到丰度较低的其他纲的真菌等.表明五种样品在纲水平上的优势菌群较为相似,而在LHL2、LHL5和LHL6中菌群相对较少,且酵母菌占绝对优势,这可能主要是由于其中加入了花椒、白酒等辅料,且依据相关文献[32]可知,花椒、白酒等具有一定的抑菌作用,导致样品中菌群种类减少.
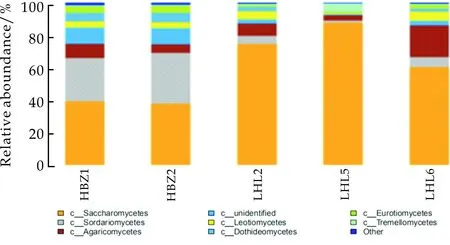
图4 五种传统发酵泡菜样品在纲的水平上的真菌组成
在目分类水平上,注释到明确分类地位的有62个目,占比情况如图5所示.其中Saccharomycetales(酵母菌目)占绝对优势,在HBZ1、HBZ2、LHL2、LHL5、LHL6中的丰度依次是39.12%、37.77%、74.45%、87.51%、60.29%;Hypocreales(竹盖菌目)占优势,在上述各样品中的丰度依次为17.12%、18.98%、3.35%、0.51%、4.43%;Thelephorales(革菌目)在LHL6中的丰度较高,为17.76%,在HBZ1中丰度为6.13%,在HBZ2中丰度为2.20%、在LHL2中的丰度为5.95%、在LHL5中的丰度为2.08%.Helotiales(柔膜菌目)在上述各样品中的丰度分别为3.03%、2.98%、4.61%、0.91%、5.16%;Pleosporales(隔孢腔菌目)所占丰度依次为3.47%、3.79%、2.25%、0.40%、1.53%;Sordariales(粪壳菌目)所占丰度依次是2.68%、3.22%、0.49%、0.04%、0.87%;由上述分析结果可知,HBZ1和HBZ2样品中菌群结构较相似,菌群结构较复杂,其主要原因是样品HBZ1中的辅料较多,这些辅料对菌群有促生长作用,样品HBZ2中的原料较多,除了莲花白以外,还加入了白萝卜和红萝卜,对菌群均有促生长作用.而LHL2、LHL5和LHL6中菌群丰富度相对较低,其中LHL5中菌群最少,因该样品中加入了花椒、红辣椒、鸡精这几种辅料,有资料表明,这几种辅料均有一定的抑菌性[32].
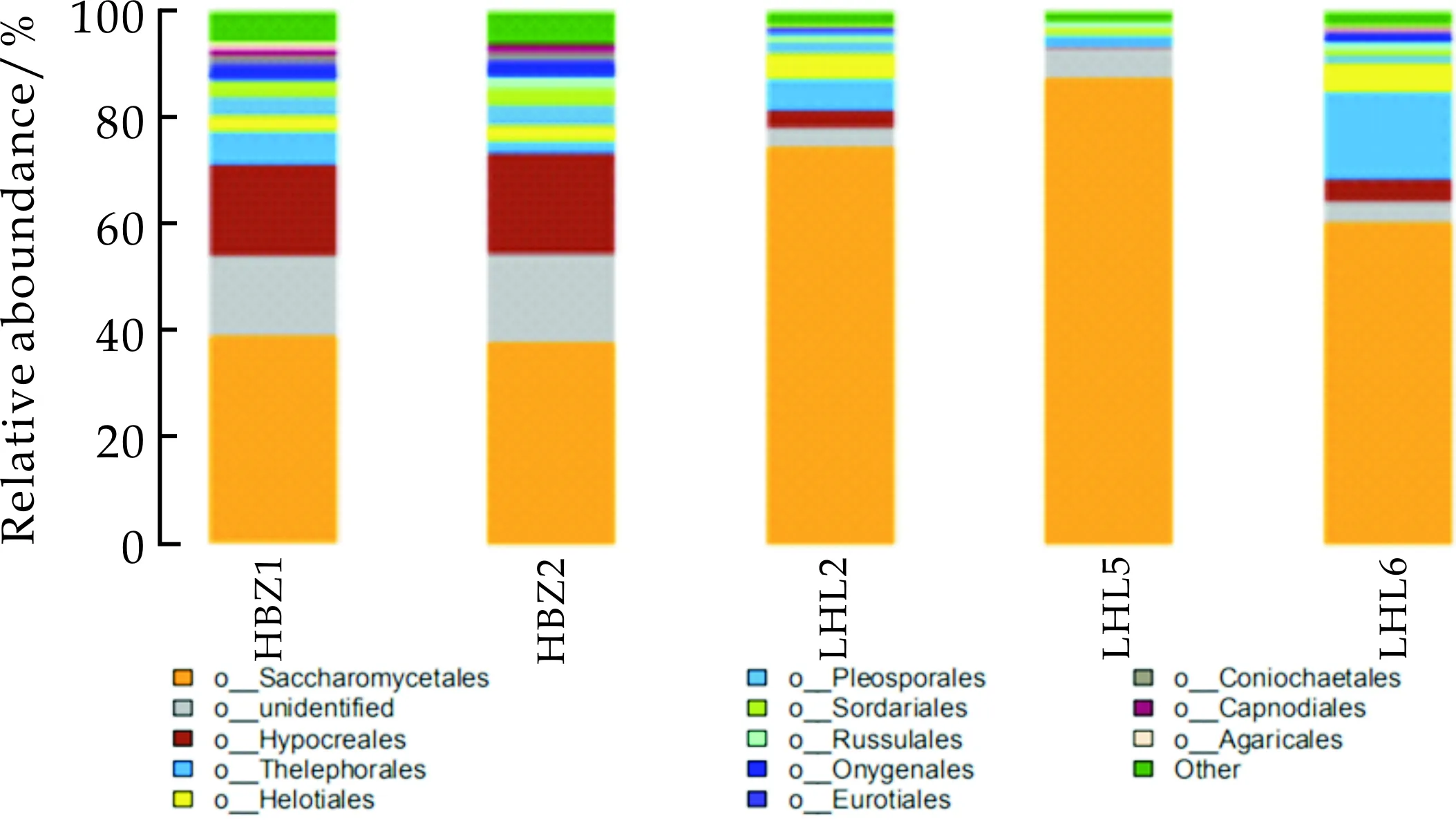
图5 五种传统发酵泡菜样品在目的水平上的真菌组成
在科分类水平上,被注释到明确分类地位的有118个科,占比情况如图6所示.其中Saccharomycetaceae(酵母菌科)在HBZ1、LHL2、LHL6占绝对优势,丰度分别为30.14%、57.78%、56.24%,在LHL5中占优势,丰度为28.70%;Dipodascaceae(双足囊菌科)在HBZ2、LHL2、LHL5中占优势,丰度分别为 10.17%、13.22%、28.80%;Pichiaceae(毕赤酵母科)在HBZ2中占绝对优势,丰度为26.37%,在HBZ1中占优势,丰度为6.02%;Thelephoraceae(革菌科)在各样品中占优势,在HBZ1、HBZ2、LHL2、LHL5、LHL6中的丰度依次是6.13%、2.20%、5.95%、2.08%、16.48%;Saccharomycetales fam Incertae sedis(酿酒酵母科)在LHL5中占绝对优势,丰度为24.79%;Nectriaceae(从赤壳科)在HBZ1、HBZ2中占优势,丰度分别为10.49%、11.54%;由上述分析结果可知,在科水平上,占绝对优势的为酵母菌科,但是在不同样品中丰度均不相同,其他科的真菌在不同样品中的丰度不尽相同,这与样品的主辅料成分有关.
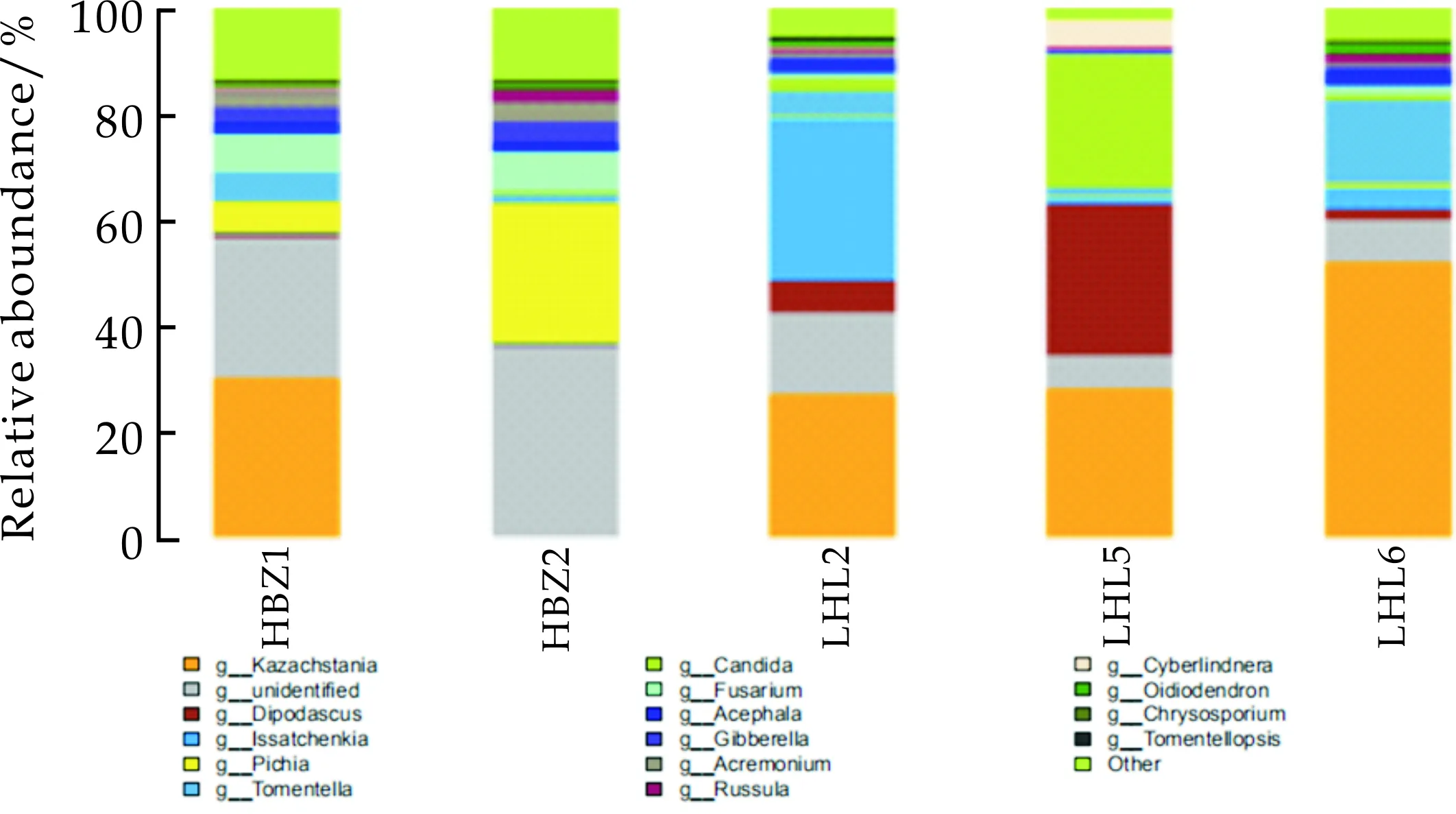
图6 五种传统发酵泡菜样品在科的水平上的真菌组成
在属分类水平上,被注释到明确分类地位的有178个属,占比情况如图7所示,核心属及其分类水平heartmap图如图8所示.其中Saccharomyces(酵母属)在HBZ1、LHL2、LHL5、LHL6中的丰度分别为29.82%、27.04%、27.79%、51.95%;Dipodascus(双足囊菌属)在LHL2、LHL5中占优势,丰度分别为5.79%、28.67%;Issatchenkia(伊萨酵母属)在LHL2、LHL5、LHL6中占优势,丰度分别为30.73%、0.91%、4.30%;Pichia(毕赤酵母属)在HBZ1 、HBZ2中占优势,丰度分别为6.02%、26.37%;Tomentella(革菌属)在各样品中的丰度分别为5.65%、1.78%、4.63%、2.00%、15.85%.Candida(念珠菌属)在LHL5中的丰度为24.79%;Fusarium(镰刀菌属)在HBZ1 、HBZ2中的丰度分别为6.88%、7.33%;表明在样品HBZ1、LHL2、LHLHL5和LHL6中的优势菌群仍然是酵母菌属,而在LHL2中并未检测到酵母菌属,这主要是LHL2中的原料与其余四种样品差异较大造成的,而其余优势菌群与科水平鉴定结果较为相似.
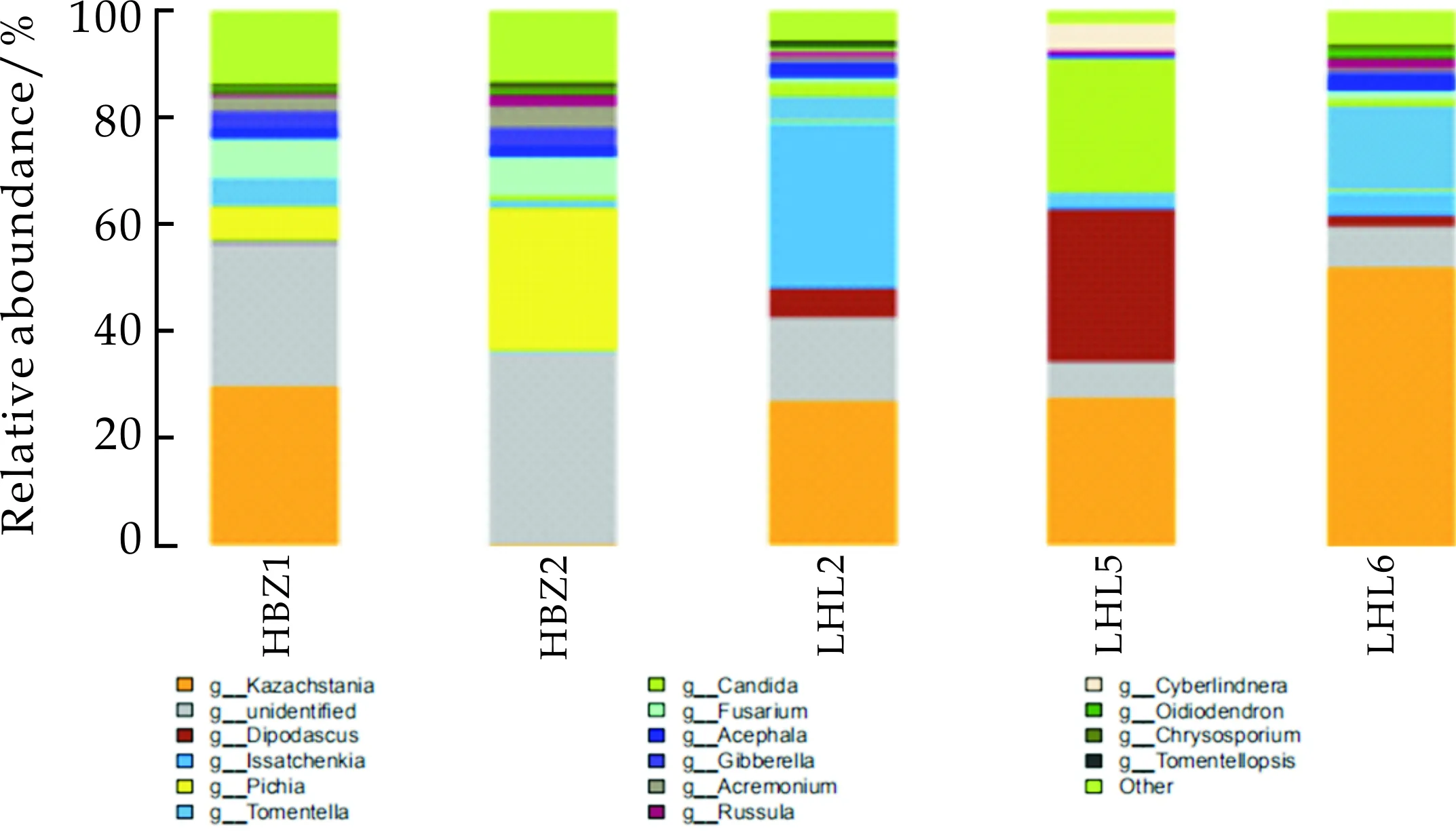
图7 五种传统发酵泡菜样品在属的水平上的真菌组成
图8显示了五种样品属水平下样本聚类树与柱状图的组合分析情况.由图8可知,在属水平,左侧的聚类结果一致,分为三大枝,其中HBZ1与HBZ2聚在一枝, LHL2、LHL5聚在同一枝,LHL6为一枝,说明HBZ1与HBZ2真菌组成在属水平上较为相似,LHL2、LHL5真菌组成在属水平上较为相似.
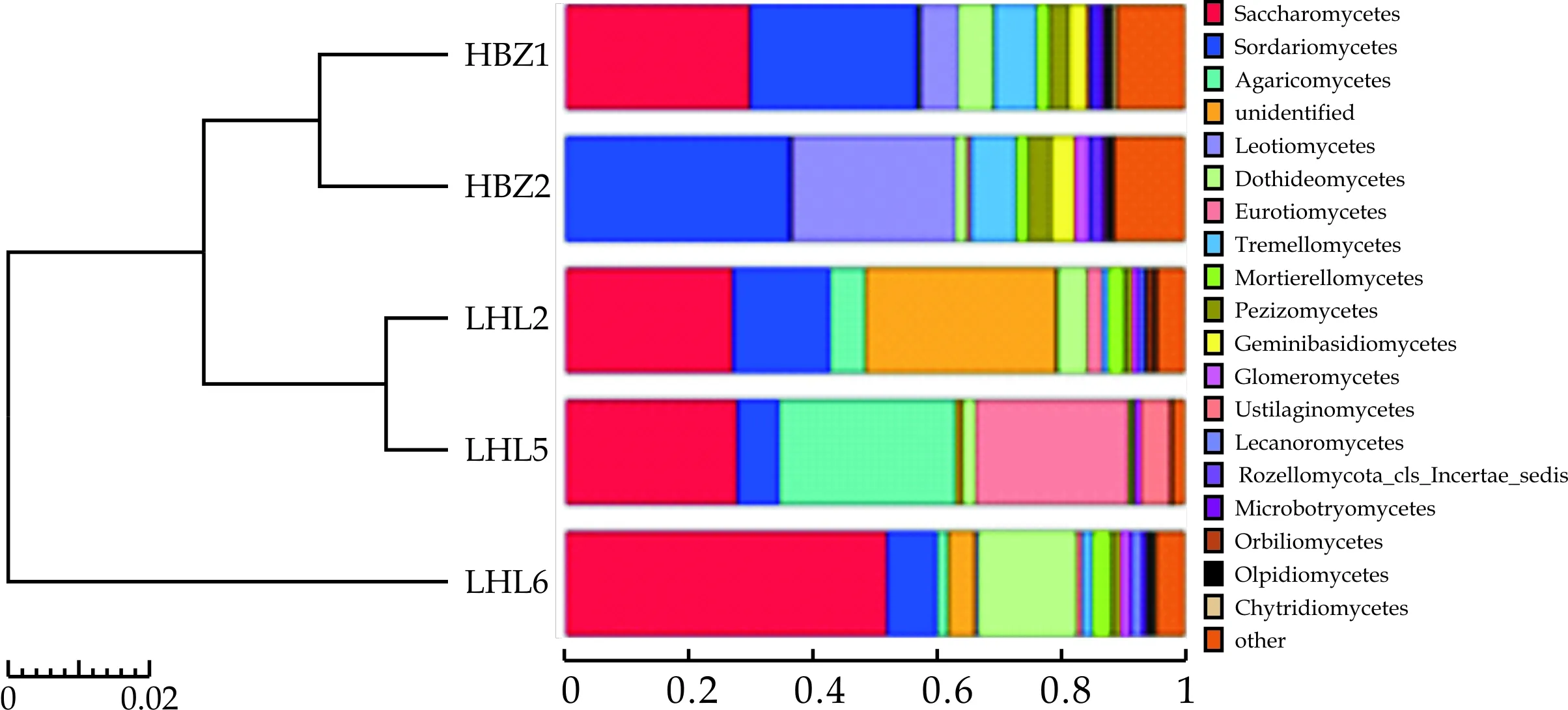
图8 真菌属水平下样本聚类树与柱状图组合分析图
Heatmap[33]可以用颜色变化来反映物种或样本间丰度相似性聚类,将聚类后数据表示在heatmap图上,采用R语言vegan包,vegdist和hclust进行距离计算和聚类分析;得到五种样品真菌核心属及其分类水平heartmap图如图9所示.图9中每一行代表不同的属,不同的颜色代表丰度不同,其中从蓝色到红色所代表的丰度值逐渐增加.从图9可以明显看出,不同真菌属在各样品中所占丰度不同.其中,Pichia毕赤酵母样品HBZ2中丰度较高,而Dipodascus(双足囊菌属)和Candida(念珠菌属)样品LHL5中丰度较高,而Kazachstnia(哈萨克斯坦酵母)在HBZ1、LHL2、LHL5和LHL6中丰度较高,Issatchenkia(伊萨酵母属)在LHL2丰度较高,Tomentella(革菌属)在LHL6中丰度相对较高,而在其他四种样品中丰度较低.这说明样品不同,其在属水平真菌核心属差别还是比较显著.

图9 真菌核心属及其分类水平heartmap图
3 结论
采用Illumina Miseq 高通量测序技术分析,研究了陕西省西安地区市售传统发酵泡菜样品HBZ1、HBZ2、LHL2、LHL5、LHL6的真菌群落结构多样性,结果共鉴定出了178属真菌.采样地点和原辅料不同对真菌菌群结构均有一定的影响.五种样品真菌群落结构有显著差异,但其中的优势真菌均为酵母菌, 70%以上的真菌在各样品中的丰度分别为,HBZ1中Saccharomyces(酵母属)29.82%、Pichia(毕赤氏酵母属)6.02% 、Fusarium(镰刀菌属)6.88%、Tomentella(革菌属)5.65%;HBZ2中Pichia(毕赤氏酵母属)26.37% 、Fusarium(镰刀菌属)7.33% 、Tomentella(革菌属)1.78%;LHL2Saccharomyces(酿酒酵母属)27.04%、Dipodascus(双足囊菌属)5.79% 、Issatchenki(伊萨酵母属)30.73%、Tomentella(革菌属)4.63%;LHL5 中Saccharomyces(酿酒酵母属)27.79% 、Dipodascus(双足囊菌属)28.67%、Issatchenki(伊萨酵母属)0.91%、Candida(念珠菌属)24.79%Tomentella(革菌属)2.00%;LHL 6中Saccharomyces(酿酒酵母属)51.95% 、Issatchenki(伊萨酵母属)4.30%、Tomentella(革菌属)15.85%.
