消癌平对肝癌细胞HepG2差异表达基因及可变剪接的影响
2019-11-25杨盛力陈景三
魏 柏, 杨盛力, 占 静, 陈景三
1.华中科技大学同济医学院附属梨园医院肿瘤科,湖北 武汉 430077;2.华中科技大学同济医学院附属协和医院肿瘤中心
基因的可变剪接(alternative splicing, AS)是指来自于同一个基因座位的mRNA前体在剪接过程中产生的多基因异构体现象,可变剪接增加生物体编码蛋白的多样性及调控基因表达的复杂性[1-3]。现已明确可通过AS来调控细胞的增殖、分化、迁移和凋亡。随着高通量测序技术的广泛应用,对肿瘤AS的研究也逐步深入,对异常剪接机制的认识为疾病的治疗提供了新的作用靶点[4-5]。
消癌平源于中药通关藤,具有消炎、清热解毒、散结止痛等功效,临床主要应用于治疗消化道肿瘤,且显示出良好前景,但对其抗癌作用仅仅做了一些初步的探索[6-8]。为进一步明确消癌平抗肿瘤的作用机制,本研究利用已有的癌症基因组数据,对消癌平作用肝癌细胞HepG2前后的差异表达基因(differentially expressed genes, DEG)和AS特征进行了比较分析,探讨差异剪接基因(differentially spliced genes, DSG)在消癌平治疗肝癌中的潜在作用机制,为后续研究消癌平抗肿瘤的分子机制提供新的思路。
1 材料与方法
1.1 材料人肝癌细胞株HepG2细胞购自中国典型培养物保藏中心;消癌平购自南京圣和药业有限公司(原液浓度为40 mg/L);RNA质检为Agilent RNA 6000 Nano试剂盒;胎牛血清,DMEM培养液,RNA提取试剂Trizol购自Life Technologies公司;转录测序委托华大基因公司采用Illumina HiSeq平台检测。
1.2 细胞系和细胞培养肝癌细胞株HepG2采用质量浓度为100 g/L胎牛血清的DMEM,置于37 ℃,体积分数为5%的CO2培养箱内培养,生长至60%~80%融合时用于后续实验。
本研究根据参考文献及本团队前期研究基础[9],以质量浓度为40 mg/L的消癌平作用24 h后的肝癌细胞作为实验组,以未处理的HepG2细胞作为对照组。
1.3 转录组测序分析采用Trizol法进行实验组和对照组的总RNA提取,利用Nanodrop检测RNA质量。测序部分委托华大基因采用Illumina HiSeq平台检测完成,主要包括RNA文库构建,测序数据过滤和比对。
1.4 DEG功能分析采用PossionDis算法进行DEG检测,通过控制错误发现率(false discovery rate, FDR)来决定P值的阈值,DEG默认定义为FDR≤0.001且倍数差异在2倍以上的基因,使用rMATS软件检测不同样品间的AS,AS和DEG检测通过基因本体(gene on tology, GO)和KEGG注释结果及官方分类。

2 结果
2.1 消癌平作用前后HepG2转录组测序过滤与参考基因组比对提取实验组和对照组细胞的总RNA,其A260/A280为1.7~2.2,RIN≥7.0,28S/18S>0.7,证实已提取到高纯度的RNA。转录组测序过滤后使用基因比对软件(Hierarchical indexing for Spliced Alignment of Transcripts, HISAT)比对到参考基因序列组,平均每个样本的比对率达76.19%,同时样品均匀的比对率表明样品之间的数据具有可比性(见表1)。

表1 消癌平作用前后HepG2细胞测序及比对数据Tab 1 Effect of Xiaoaiping on genome maping in HepG2 %
2.2 消癌平作用前后HepG2中DEG检测收集实验组和对照组的RNA,采用Illumina HiSeq测序平台进行高通量测序分析后,使用PossionDis算法进行差异基因检测。结果提示,本次转录组测序按照差异表达筛选标准得到DEG 608个,其中上调基因147个,下调基因461个(见图1)。

注:A:基因表达量分布图,颜色深浅表示不同表达量水平:FPKM≤1为极低表达水平的基因,FPKM 1~10为较低水平,FPKM≥10为中高表达水平;B:DEG量散点图。X和Y轴均代表基因表达量的对数值,红色代表上调的DEG,蓝色表达下调的DEG,灰色代表非DEG。
图1 消癌平作用HepG2前后DEG检测
Fig 1 Effect of Xiaoaiping on DEG expression distribution in HepG2
2.3 消癌平作用前后HepG2中DSG检测与参考基因组比对之后,利用rMATS检测实验组和对照组之间的差异剪接,对外显子(SE)选择性保留或切除、外显子3′端或5′端可变剪接(A3SS或A5SS)、内含子保留(RI)、相互排斥选择性外显子(MXE)这5种AS进行了统计(见图2),结果显示,实验组和对照组AS分别为19 265个和21 387个,且两组均以SE最多而RI最少。与此同时还发现实验组较对照组AS减少2 122个,两组变化均以SE减少最多而A3SS减少最少。
2.4 消癌平作用HepG2前后DSG的GO功能分析对实验组和对照组的DSG通过GO功能进行分类及富集分析。GO分为分子功能(molecular function)、细胞组分(cellular component)和生物过程(biological process)三大功能类,对三大功能类单独进行进一步的分类及富集分析(见图3)。其中生物过程相关的DSG 22个,主要涉及行为、生物黏附、生物调控等;细胞成分相关DSG 13个,主要涉及细胞、细胞连接、细胞部分、胞外区域等;分子功能相关的DSG有8个,主要涉及催化活性、分子功能调控、分子传导活性等。

图2 消癌平作用于HepG2前后AS数目

注:X轴代表GO功能分类,Y轴表示对应DEG数目。不同颜色代表不同剪接类型。
以AS差异最少的A3SS为例,进一步对实验组和对照组DSG做GO功能富集分析(见表2),从GO的生物学过程富集条目结果来看差异基因的AS能够显著调节生物学过程,将成为后续研究关注的重点。

表2 DSG的功能富集分析
续表2
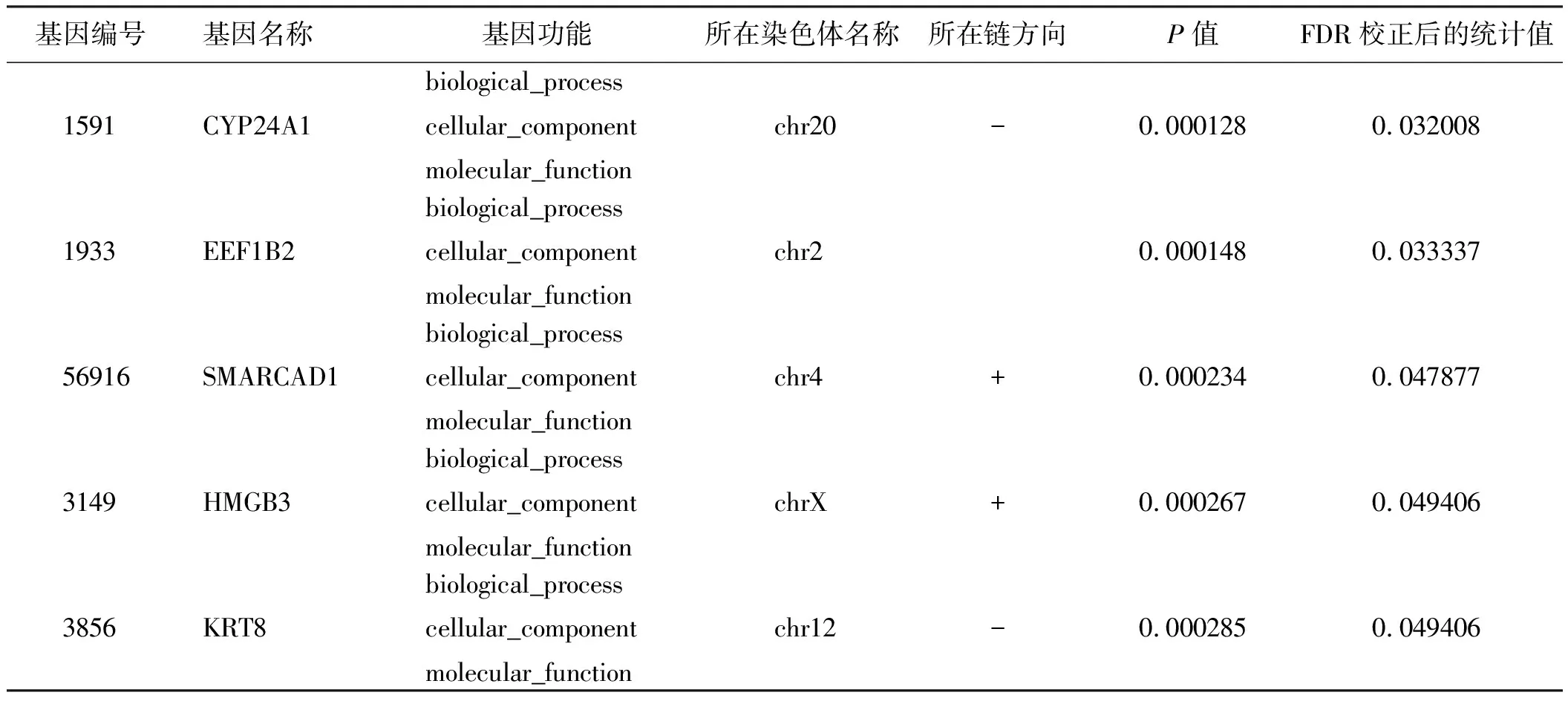
基因编号基因名称 基因功能所在染色体名称所在链方向P值FDR校正后的统计值1591CYP24A1biological_processcellular_componentmolecular_function chr20-0.0001280.0320081933EEF1B2biological_processcellular_componentmolecular_function chr20.0001480.03333756916SMARCAD1biological_processcellular_componentmolecular_function chr4+0.0002340.0478773149HMGB3biological_processcellular_componentmolecular_function chrX+0.0002670.0494063856KRT8biological_processcellular_componentmolecular_function chr12-0.0002850.049406
3 讨论
肝癌是多因素、多步骤、多基因、多突变的结果。既往研究表明,在肝癌的发生、发展过程中,许多基因的不同选择性剪接产物在肿瘤中的功能也大不相同,但对其调控的相关研究刚刚起步,针对剪接基因的药物是否提高肿瘤治疗疗效值得进一步探索[4,10-11]。
随着人类基因组计划的初步实现,及大规模高通量实验手段的日益完善,使得从基因组范围寻找可能的剪接基因成为可能。本研究利用RNA-seq技术检测了消癌平对肝癌细胞转录组的影响,筛选到消癌平处理前后肝癌细胞内DEG共608个,其中具有表达上调的基因147个,表达下调的基因461个,提示消癌平对肝癌细胞基因的影响以下调为主。
目前已发现了多种mRNA的AS[12-14],现已明确mRNA AS极大增加了真核生物基因表达的复杂程度和蛋白质功能的多样性,且与包括肿瘤在内的疾病的发生存在密切联系。本研究结果显示,实验组和对照组中有大量AS,且两组均以SE最多而RI最少,可见大量AS和肝癌细胞内剪接调控模式的复杂性相关。此外,实验组较对照组AS减少2 122个,可见消癌平相关的AS变化趋势和DEG相同,与此同时我们还发现两组变化均以SE为最多而A3SS最少为主,由此推测特异性剪接变异体的减少可能用以解释消癌平的抗肿瘤作用[15]。
进一步对A3SS这一可变剪接形式进行分析,DSG中最为明显的是RPL11、ACSL4、SEPT6等。核糖体蛋白L11(ribosomal protein L11,RPL11)是核糖体60S大亚基的重要组成部分,参与细胞周期阻滞、细胞凋亡及肿瘤发生等过程的调控。RPL11与抑癌蛋白ARF功能相类似,它能够与癌蛋白HDM2相互作用,激活P53抑痛蛋白的活性;与癌蛋白c-Myc相互作用,负反馈调控c-Myc的转录活性,由此推测RPL11本身可能具有肿瘤抑制功能[16]。ACSL4属于多基因编码家族酶,除了参与脂代谢,还通过PI3K/AKT、mTOR通路等调节肿瘤细胞生长增殖[17-18],已有报道过表达ACSL4和肝癌患者预后相关[19]。DEG和DSG生物学通路重叠比例很高,提示相应的生物学效应受到转录表达与外显子剪接两个水平的共同调控。上述变化一方面体现了DSG在肿瘤中的功能,另一方面也体现了消除DSG可能是消癌平作用于肝癌细胞靶点。
本研究中采用的芯片结果主要反映了基因在转录水平的变化,但数据类型和测序方式等对AS产生影响,因此具有一定局限性,尚需进一步研究。
本研究应用RNA-seq筛选了消癌平对肝癌细胞DEG及AS表达的影响,在基因功能分析中获取了消癌平可能参与抑制肿瘤相关的DSG,为深入探讨消癌平在肝癌中的作用提供了新的线索。
