茶条槭茎段组织培养与植株再生研究
2019-11-21杨兰芳张国禹黄桂云吴笛张定军李翩翩
杨兰芳 张国禹 黄桂云 吴笛 张定军 李翩翩
摘要 春季剪取茶条槭当年生枝条的带顶芽茎尖和带腋芽茎段以0.1%HgCl2分别消毒4、10 min最好;茶条槭当年生带芽茎段增殖培养基MS+TDZ 1.0 mg/L+NAA 0.2 mg/L上培养,增殖效果最好,生长良好,且兼顾了增殖与生根,缩短了培养周期。经生根的试管苗移栽于珍珠岩∶园土=1∶3基质中,植株生长健壮,成活率达90%。
关键词 茶条槭;带芽茎段;组织培养
中图分类号 S792.99 文献标识码 A
文章编号 1007-5739(2019)19-0128-02 开放科学(资源服务)标识码(OSID)
茶条槭(Acer ginnala)为槭树科槭属落叶树种,树形优美,叶形清秀,秋叶红艳,是一种极具开发价值的园林树种。此外,其木材可做细木;嫩叶经加工可代茶用,还可提取大量的没食子酸,广泛应用于医药、化工、食品、轻工、印染、军工等方面,尤其在医药上对治疗肝病有特效。由于茶条槭野生数量较少,加之掠夺性采收,目前已处于濒危状态。本试验以带腋芽茎段为外植体研究不同消毒时间、取材部位对无菌再生体系建立的影响,为解决茶条槭优良栽培种快繁、品种改良及遗传转化工作做好前瞻性的基础研究,同时为进一步利用基因工程手段改良提供基础材料。
1 材料與方法
1.1 试验材料
以长江珍稀植物研究所种质资源圃内株高3 m左右、胸径6 cm左右的茶条槭为研究对象,于4—5月剪取其主干基部或下部当年生萌条作为试验材料。
培养基均附加3%蔗糖、5 g/L琼脂以及不同浓度的植物生长调节剂。使用前,用1 mol/L NaOH将pH值调至5.8~6.0,并在122 ℃高温、高压条件下灭菌30 min[1]。培养温度、光照强度、光照时间分别为(24±2)℃、800~1 000 lx、13 h/d。
1.2 试验方法
1.2.1 外植体消毒时间的筛选。本试验于4月开展,为研究外植体不同部位及消毒时间对茶条槭污染率的影响,主要分为2个部分:以茶条槭茎尖为外植体,0.1%HgCl2消毒时间分别为3、4、5 min;以茶条槭带腋芽茎段为外植体,0.1%HgCl2消毒时间分别为8、10、12 min。进行单因素试验,通过设计梯度试验,观察并比较外植体不同部位、不同消毒时间的污染情况,包括污染率、死亡率及其萌芽率等情况。
试验方案:首先用软毛刷蘸取洗液仔细刷洗叶腋及表皮,用自来水冲洗1~2 h。在无菌条件下,将材料放入75%酒精溶液中浸30 s,无菌水冲洗1~2次,再用0.1%HgCl2溶液消毒,消毒后用无菌水冲洗3~5次。最后放于无菌滤纸上吸干水分,将消毒后的外植体接种到启动培养基上[2-3]。每瓶培养基3个外植体,每处理设10个重复。试验2周后统计污染率,4周后统计死亡率、萌发率。
1.2.2 试管苗增殖生根培养。腋芽萌发后,待其长至1~2 cm时,切下转入含有不同浓度的培养基继代培养,继代采用MS为基本培养基,以NAA、6-BA和TDZ为3因素进行正交试验L8(4×24)。每种处理接种10瓶,每瓶接种2个,重复3次。接种后,每周观察1次小芽的伸长、增殖等情况;40 d后,统计不同生长调节剂处理的试管苗增殖系数(每外植体形成1.0 cm 以上次生小芽的个数)、生根情况等数据。
1.2.3 试管苗移栽。将生根培养40 d的试管苗移到实验室内有散射光的自然条件下炼苗。1周后,取出生根小植株,洗净根部琼脂并剪去基部叶片,移栽于装有珍珠岩、营养土(二者按1∶3混合)的营养钵中。每盆1株,共移栽30株,每3~4 d浇透水1次。60 d后,统计成活率并记录其生长情况[4-6]。
2 结果与分析
2.1 不同消毒时间对不同部位外植体污染的影响
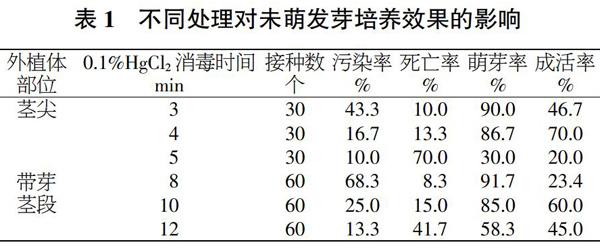
从表1可知,茶条槭茎尖用0.1%HgCl2消毒4 min时,污染率较低(16.7%),成活率最高(70.0%),其萌芽率也相对较高(86.7%);消毒时间为3 min时,成活率大幅下降(46.7%),污染率最高(43.3%);消毒时间为5 min时,成活率最低(20.0%),污染率最低(10.0%)。可见,用0.1%HgCl2对茎尖消毒时,消毒时间为4~5 min对茶条槭茎尖污染率的影响不大,但褐变死亡率随消毒时间的延长大幅提升。在对茶条槭带芽茎段消毒时,使用0.1%HgCl2消毒10 min成活率最高,可达到60.0%,污染率也相对较低,为25.0%,萌芽率也高;消毒8 min时,成活率最低,为23.4%,污染率最高(68.3%);消毒12 min时,污染率最低。随着消毒时间延长,褐变死亡率上升,成活率低。因此,在用0.1%HgCl2对茶条槭外植体消毒时,幼嫩茎尖的消毒时间控制在4 min较好,带芽茎段的消毒时间最好控制在10 min左右,其成活率和萌芽率都相对最高。
2.2 试管苗增殖生根培养
将腋芽萌发而来的无菌试管苗接种到不同的增殖培养基中后,其基部先是略有膨大,呈黄绿色,随后在部分培养基上,幼苗基部形成一定大小的团块状愈伤组织,2周左右,开始从基部和腋芽处分化出新芽。
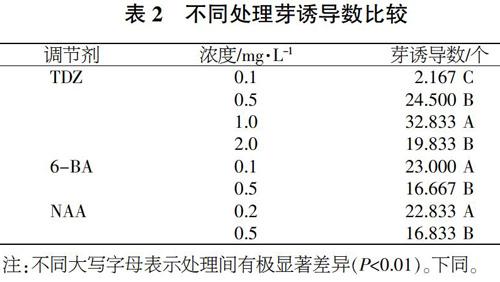
由表2可知,TDZ在1.0 mg/L的水平上较其他水平有极显著性差异,其芽的平均诱导个数为32.833个;TDZ含量为0.5 mg/L和2.0 mg/L时,其芽的平均诱导个数分别为24.500个和19.833个,二者差异不显著;含量为0.1 mg/L时,芽的平均诱导个数为2.167个。从6-BA的含量来看,0.1 mg/L芽诱导数极显著高于0.5 mg/L;从NAA的含量来看,0.2 mg/L芽诱导数极显著高于0.5 mg/L。由此得出,茶条槭诱导增殖的最好理论组合为NAA 0.2 mg/L、6-BA 0.1 mg/L、TDZ 1.0 mg/L。
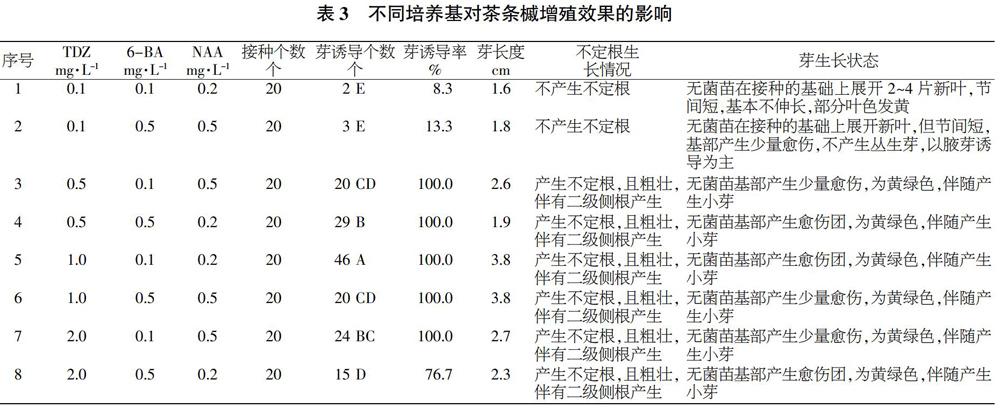
由表3可知,5号配方对芽的增殖效果极显著的高于其他组合。从丛生芽的诱导率方面,1、2号配方的增殖效果最差,诱导率仅8.3%、13.3%;其次是8号配方,其诱导率76.7%;3、4、5、6、7号配方,诱导率都是100.0%。芽诱导数方面,5号配方芽诱导个数最多,为46个;其次是4号配方,芽诱导个数为29个;再次是7号配方,芽诱导个数为24个;然后是3、6号配方,芽诱导个数均为20个;最后是1、2号配方,芽诱导个数分别为2、3个。在丛生芽的平均长度方面,5、6号配方芽长均为3.8 cm;然后依次是7号配方>3号配方>8号配方>4号配方>2号配方>1号配方,其芽长分别为2.7、2.6、2.3、1.9、1.8、1.6 cm。不定根的产生方面,本试验发现,茶条槭增殖是先产生不定根,有利于芽的增殖。在配方組合中发现,除1、2号配方不能产生不定根外,其他均能产生不定根。
由上述可知,在培养基MS+NAA 0.2 mg/L+6-BA 0.1 mg/L+TDZ 1.0 mg/L中,丛生芽的增殖效果相对较好,不仅增殖系数较高,幼芽生长也较快。但是在长期继代增殖过程中,激素的积累会导致试管苗生长状态有一些细微的改变,因而应根据实际情况灵活调整激素的浓度。
2.3 移栽
将生根培养40 d后,达移栽标准的试管苗移到培养室外,在自然光条件下炼苗3~7 d,在移栽前3~5 d打开瓶盖。移栽后浇透基质,放于2号PVC温室大棚养护管理(图1)。
从基质对移栽成活率的影响考虑,茶条槭是喜排水良好的砂质壤土的植物。因此,选择透气性较好、所含营养物质较多的园土与珍珠岩进行配比,以3∶1的比例混合拌匀作为移栽基质。茶条槭喜光,移栽后将其置于散射光丰富区域。移栽后1~3周,每天喷水1~2次,空气相对湿度保持在60%以上,但不要超过90%,温度保持在20 ℃左右。根据天气情况加遮荫网避免强光直射,降低棚温。移栽后2~3周,植株长出新叶后,适当除去温棚遮荫网,使其逐渐适应外界环境条件。移栽后苗高达到5 cm左右时,适当控制温棚温度及光强即可。移栽2个月后,统计成活率为90%,所有幼苗均生长良好。植株在营养钵中生长至高15~20 cm时,移至大田苗圃进行定植,目前仍生长良好,形态上未见任何变异。
3 结论与讨论
研究发现,一是以半木质化的幼嫩茎段作为外植体材料,具有萌发快、发生率高、褐化率低的特点;二是萌发早与萌发率高,通常接种1周左右可达到100%的萌发率;三是在茶条槭组织培养中,茎尖培养萌发率劣于茎段萌发率,且茎段中木质化程度越低,诱导率越高;四是材料的幼嫩程度决定其褐化程度,木质化严重的材料褐化也严重;五是光照对褐化有影响,在接种培养时,不改变其培养温度与湿度,适当降低其光照强度,对防止褐变有一定效果。
4 参考文献
[1] 董杰,齐凤慧,詹亚光.茶条槭悬浮培养体系的建立与没食子酸合成的优化条件[J].植物学通报,2008,25(6):734-740.
[2] 李岩岩.茶条槭(Acer ginnala)组织培养与快速繁殖技术研究[D].兰州:甘肃农业大学,2007.
[3] 李海燕.茶条槭(Acer ginnala Maxim.)组织培养及愈伤组织中没食子酸代谢调控的研究[D].哈尔滨:东北林业大学,2007.
[4] 李海艳,宋继园,董杰,等.茶条槭愈伤组织的再生体系建立及其没食子酸含量的测定[J].植物学通报,2008,25(2):212-219.
[5] 孟月娥,周子发,李艳敏,等.茶条槭的组织培养和快速繁殖[J].植物生理学通讯,2005,41(6):790.
[6] 李岩岩.茶条槭组织培养与快速繁殖技术研究[J].山东林业科技,2010(2):48-50.
