急性氨氮胁迫下大弹涂鱼解毒代谢途径的研究
2019-11-21杨洋孟繁星王日昕
杨洋 孟繁星 王日昕
(宁波大学海洋学院,宁波 315832)
在现阶段大规模集约化养殖过程中,粗放投喂方式导致的饵料残渣、饲料配比不均衡、饲喂密度大等因素使得养殖水体中氨氮含量超标[1]。氨氮在水体中的存在形式分为两种:离子态(NH4+)和非离子态(NH3),由于非离子氨是半径较小的亲脂性分子,极易扩散进入鱼体,导致血氨浓度升高、红细胞载氧能力下降,离子平衡紊乱,中枢神经系统受到干扰等不良影响,因此相较于NH4+,NH3对鱼体的毒害作用更大,常使鱼体表现出呼吸困难、反应迟缓、抽搐甚至衰竭而死亡[2]。已有大量研究表明氨氮对鱼类的毒性,如氨氮刺激下,虹鳟(Oncorhynchus mykiss)鳃组织结构发生严重的组织病理学病变,氧摄取功能严重受损[3];质子化的NH4+通过取代K+,干扰Na+/K+-ATPase(NKA)和Na+:K+:2Cl-共转运蛋白(NKCC)的正常运作而阻碍离子调节[4];通过抑制丙酮酸脱氢酶、异柠檬酸脱氢酶而干扰三羧酸循环,进而影响鱼体能量代谢[5-6]等。因此,对于氨氮胁迫对鱼体的损害机制和鱼体对氨氮环境的耐受机制的研究显得尤为重要。
目前,已有研究对常见淡水鱼[7]和现存气呼吸型海水鱼的氨氮耐受机制进行了研究,其机制主要包括:(1)降低蛋白质和氨基酸的分解代谢;(2)降低环境pH;(3)NH4+连续排泄 ;(4)NH3持续排泄;(5)合成无毒的谷氨酰胺;(6)合成尿素等[8-9]。其中降低蛋白质和氨基酸分解代谢的策略对于大弹涂鱼并不适用,这是由于弹涂鱼在陆生环境中需要利用蛋白质和氨基酸分解释放的能量来维持其跳跃和爬行等生命活动[10-11];同样,大弹涂鱼也不采用合成尿素的方式排泄氨,相关研究指出,尿素生成能力存在于软骨鱼类和大多数陆生脊椎动物中[12],在硬骨鱼中几乎检测不到鸟氨酸尿素循环(Ornithine-urea cycle,OUC)中关键酶的活性[13-14],已有研究证实,许氏齿弹涂鱼(Periophthalmodon schlosseri)是唯一一种具有完整OUC的弹涂鱼,但也只有4.6%的外源性氨被合成尿素[15]。近年来,一种疑似具有排氨作用的功能性蛋白逐渐被关注,2017年,Chen等[16]的一篇报道指出氨氮胁迫会影响攀鲈(Anabas testudineus)鳃中Rh蛋白(Rhesus-type ammonia transporter)mRNA和蛋白水平高表达,随着研究深入,愈来愈多学者倾向于认为Rh蛋白在排氨过程中起关键性作用,且与碳酸酐酶(Carbonic anhydrase,CA)、钠氢交换蛋白(Na+/H+exchangers,NHE)等存在联合作用[17-18]。
作为古老的气呼吸型鱼类,大弹涂鱼(Boleophthalmus pectinirostris)能够沿着潮汐带在软泥中建造洞穴,对于繁殖季节洞穴水中高氨的水环境具有极强的耐受性[19-20],是研究鱼类氨氮环境耐受性的重要生物学材料,对于研究鱼类如何提高逆境环境生存能力也具有重要价值。基于已有报道,本研究侧重于探究大弹涂鱼在氨氮胁迫下是否采用合成无毒谷氨酰胺这一策略以及是否利用Rh蛋白及其协同蛋白共同完成持续排氨,测定了急性氨氮胁迫条件下大弹涂鱼血氨浓度的变化,检测了氨代谢关键酶——谷氨酰胺合成酶(Glutamine synthetase,GS)在肝脏中的活性及GS基因mRNA表达量情况;同时检测鳃组织中CA,NHE3蛋白量及氨代谢相关基因CA15、NHE和Rhcg1的mRNA表达量情况,旨为鱼类氨解毒代谢机制的深入研究提供理论依据。
1 材料与方法
1.1 材料
大弹涂鱼购自浙江省宁波慈溪市龙山镇,实验开始前在宁波大学校内实验基地暂养7 d,暂养期间每天投喂饲料,并及时清理粪便和残饵,配置盐度为10的海水作为暂养用水,水温22.2±0.3℃,pH 为 7.61±0.08,溶氧量为 6.38±0.8 mg/L,24 h连续充气增氧。7 d后,挑选体质健康、大小均匀19.2±0.3 g的大弹涂鱼随机分配到6个塑料养殖桶(93 cm×60 cm×25 cm)内,每桶40尾。
1.2 方法
1.2.1 急性氨氮胁迫 参考大弹涂鱼的氨氮胁迫亚致死浓度[21]和预实验结果,通过直接向固定体积的海水中添加NH4Cl(分析纯,RG≥99.5%,M=53.49)配置出8 mmol/L的NH4Cl盐溶液为氨氮组实验用水,以不添加NH4Cl的海水作为对照组,每组设3个重复桶,每桶40尾鱼,实验用水体积固定为8 L使鱼浸没在水中,每24 h彻底更换用水,实验期间不投喂。
1.2.2 样品采集 在氨氮胁迫后0 h、12 h、24 h、48 h和72 h分别采样,每个时间点从每桶取3尾鱼。用MS222麻醉后将鱼置于冰面,用无菌注射器从尾静脉取血并加入1.5 mL的EP管中,于4℃冰箱中静置12 h后离心(5000 r/min,4℃,10 min),取上层血清移至新的离心管, 保存于-20℃冰箱备用。抽血后,在冰面上快速解剖取肝、鳃、肾等组织放在1.5mL的EP管并迅速投入液氮中暂存,后储存于-80℃超低温冰箱保存备用。
1.2.3 血氨浓度测定 血氨测定试剂盒购自南京建成生物公司,以血清为实验样本测定氨氮组和对照组的血氨含量,具体操作流程参照说明书,采用美谷分子仪器(上海)有限公司的Molecular Devices SpectraMax-i3x酶标仪测定630 nm吸光值后,利用如下公式计算血氨含量:血氨含量(μmol/L)=((测定OD-空白OD)/(标准OD-空白OD))×标准浓度(350 μmol/L)×样本测试前稀释倍数。
1.2.4 GS 酶活测定 取肝组织样,按组织质量(g):提取液体积(mL)为1∶9的比例加入提取液,冰浴匀浆。离心(8000×g,4℃,10 min)取上清,置于冰上用于GS酶活的测定。GS活性采用索莱宝生物科技有限公司的GS活性检测试剂盒测定,Molecular Devices SpectraMax-i3x酶标仪测定540 nm吸光值,计算求得酶活力值。
1.2.5 CA,NHE3酶联免疫(ELISA)分析测定 取鳃组织样,磷酸缓冲液(Phosphatic buffer solution,PBS)冲洗后,按组织质量(g):PBS(mL)为1∶9的比例加上预冷的PBS(50 mmol/L,pH7.4),冰浴匀浆。离心(5000×g,4℃,20 min)收集上清,分装一份待测,其余冷冻备用。CA,NHE3活性采用上海研谨生物公司的酶联免疫(ELISA)检测试剂盒测定。Molecular Devices SpectraMax-i3x酶标仪测定450 nm吸光值,绘制标准曲线,计算含量。
1.2.6GS、CA15、NHE和Rhcg1基因mRNA表达参照NCBI,GenBank中大弹涂鱼GS(XM_020921461),CA15(XM_020925341),NHE(XM_020941797),Rhcg1(KU229861.1) 基 因 cDNA序 列,Primer Premier 6.0软件设计特异扩增引物(表1),分别测定肝脏中GS基因及鳃组织中CA15,NHE,Rhcg1基因mRNA表达量。取肝、鳃组织在液氮中研磨成粉末,Trizol试剂提取组织总RNA,沉淀用DEPC溶解,检测RNA浓度和A260/A280值,琼脂糖凝胶电泳检测RNA完整性,TransScript All-in-one First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)试剂盒反转录合成cDNA,凝胶电泳图像呈单一明亮条带。实时荧光定量PCR采用SYBR Premix ExTaq试剂于罗氏LightCycler 480上进行分析,PCR体系为:95℃ 3 min;95℃ 10 s,57-61℃(不同引物退火温度不同)30 s,40个循环;95℃ 5 s。以β-actin作为内参基因,以2-ΔΔCt法计算基因的相对表达量。

表1 实验所用荧光定量PCR引物序列
1.2.7 统计分析 数据分析工作运用统计学软件SPSS 18.0 做单因素方差分析(one-way ANOVA),对数据进行方差齐性检验,并根据方差齐性检验结果分别进行LSD或Duncan 多重比较,分析组内差异显著性,用ORIGIN软件作图。
2 结果
2.1 氨氮胁迫对血氨浓度的影响
对照组中大弹涂鱼血清中血氨含量稳定在300 μmol/L左右,组内不同时间点的血氨含量无显著性差异(P>0.05);对于氨氮组,血氨含量随氨氮胁迫时间的推移,呈现先上升后下降的趋势,在12 h显著升高并达到最大值(P<0.05),随后在24 h显著下降并回落到基线附近后,血氨水平再无显著性变化(P>0.05)。对照组与氨氮组的血氨含量在各个时间点均有显著性差异(P<0.05),都表现为氨氮组的血氨含量显著高于对照组的血氨含量,尤其在12 h氨氮组的血氨含量为对照组的4倍,差异极显著(P<0.01)(图1)。

图1 氨氮胁迫下大弹涂鱼血氨含量的变化
2.2 氨氮胁迫对肝组织中GS酶活性的影响
在对照组中,肝脏GS活性在各时间点之间无显著性差异(P>0.05);在氨氮组中,肝脏GS活性在12 h开始出现上调趋势,并在24 h显著上升达到最大值(P<0.05),随后GS活性在48 h显著降低到基准值附近,直至72 h时GS活性再无显著性变化(图 2)。
2.3 氨氮胁迫对鳃中CA,NHE3蛋白含量的影响(ELISA)
2.3.1 对鳃中CA蛋白含量的影响 在对照组中,鳃中CA蛋白含量随时间变化而波动,但无显著性差异(P>0.05);在氨氮组中,鳃中CA蛋白含量随时间推移呈现先上升后下降的趋势,12 h和24 h时较0 h的CA蛋白含量显著升高(P<0.05),但二者之间并无明显差异(P>0.05),随后在48 h时CA蛋白含量进一步显著上升并达到最大值(P<0.05),而后CA蛋白含量显著下降(图3)

图2 氨氮胁迫下大弹涂鱼肝组织中谷氨酰胺合成酶活性变化

图3 氨氮胁迫下大弹涂鱼鳃组织中碳酸酐酶蛋白含量变化
2.3.2 对鳃中NHE3蛋白含量的影响 在对照组中,鳃中NHE3蛋白含量随时间变化而波动,但无显著性差异(P>0.05);在氨氮组中,鳃中NHE3蛋白含量在12 h时有下降趋势,但不显著(P>0.05),随着氨氮胁迫时间的推移NHE3蛋白含量在24 h显著上升并达到最大值(P<0.05),随后显著降低并在72 h恢复到初始蛋白含量附近(图4)。
2.4 氨氮胁迫对基因表达的影响
2.4.1 对肝中GS基因表达的影响 在对照组中,肝脏GS基因的表达量在12 h显著上升(P<0.05)而后趋于平缓的趋势,除0 h外,其他时间点GS基因表达量均无显著性差异(P>0.05),且均高于0 h 表达量3倍左右(P<0.05);在氨氮组中,肝脏GS基因的表达量呈先上升后下降的趋势,在12 h显著上升并在48 h进一步上升达到最大值(P<0.05),随后呈现下降趋势(图5)。
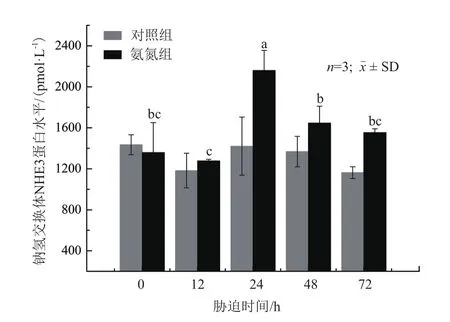
图4 氨氮胁迫下大弹涂鱼鳃组织中钠氢交换体蛋白含量变化

图5 氨氮胁迫下大弹涂鱼肝中GS基因的相对表达水平变化
2.4.2 对鳃中CA15基因mRNA的相对表达变化 在对照组中,鳃中CA15基因的相对表达量呈现缓慢上升而后下降的波动趋势,但总体并无显著性差异(P>0.05);在氨氮组中,鳃中CA15基因的相对表达量在24 h内有所波动,但无显著性差异(P>0.05),在48 h时表达量显著上升并达到最大值(P<0.05),高出0 h基因表达量2.5倍,随后呈现下降趋势(图6)。

图6 氨氮胁迫下大弹涂鱼鳃中CA15基因的相对表达水平变化
2.4.3 对鳃中NHE基因表达的影响 在对照组中,鳃中NHE基因的表达量对随时间变化而波动但无显著性差异(P>0.05);在氨氮组中,鳃中NHE基因的相对表达量呈现先上升后下降的趋势,并在24 h显著升高并达到最大值(P<0.05),随后,鳃中NHE基因的相对表达量在48 h有下降趋势,但相对表达量与24 h无显著性差异(P>0.05),最终在72 h显著降低到初始表达量(P>0.05)(图7)。
2.4.4 对鳃中Rhcg1基因表达的影响 在对照组中,鳃中Rhcg1基因的相对表达量随时间变化而波动但无显著性差异(P>0.05),在氨氮组中,鳃中Rhcg1基因的相对表达量呈先上升后下降的趋势,在48 h显著上升并达到最大值(P<0.05),随后呈下降趋势(图 8)。

图7 氨氮胁迫下大弹涂鱼鳃中NHE基因的相对表达水平变化
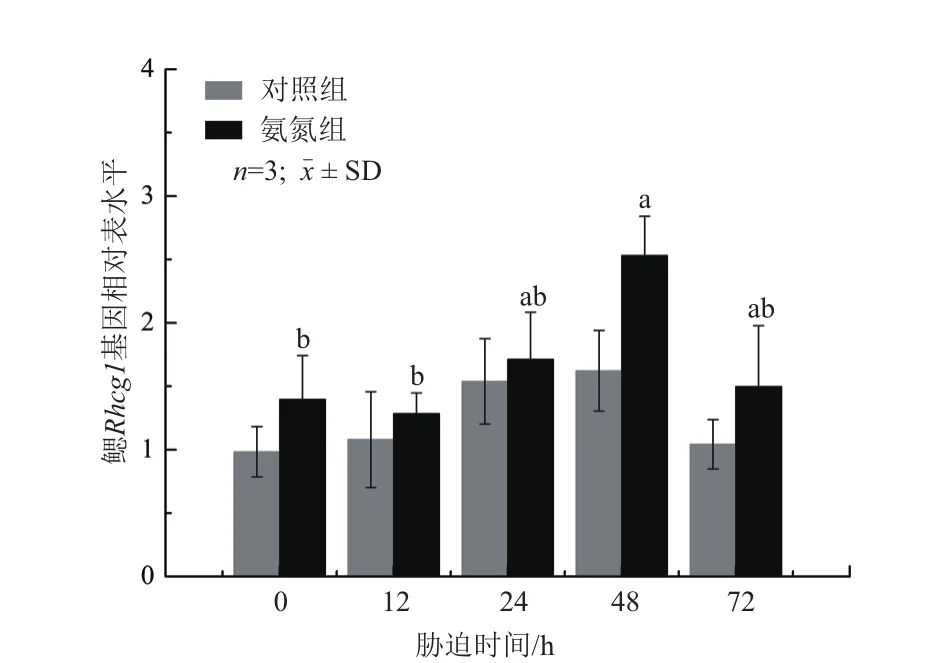
图8 氨氮胁迫下大弹涂鱼鳃中Rhcg1基因的相对表达水平变化
3 讨论
3.1 氨氮胁迫对GS酶活性及其编码基因表达量变化的影响
本研究表明,与对照组相比,急性氨氮胁迫下的大弹涂鱼血清中血氨浓度均有显著性升高,其中在12 h极显著升高,为对照组血清中血氨浓度的4倍。本胁迫实验主要通过添加NH4Cl至8 mmol/L的亚致死浓度[21]而使水体中的氨氮含量提高,高浓度的氨氮会对鱼体渗透压平衡、代谢活动造成影响,导致鱼体总氨氮排放量降低,多余氨氮的积累首先影响血氨含量[22]。因此本研究主要探究在亚致死浓度的NH4Cl胁迫下大弹涂鱼的氨氮耐受机制。检测发现,血氨浓度在氨氮胁迫12 h内急速升高,随后在24 h显著下降并回落到基准值,直至72 h血氨浓度均无显著性差异,表明大弹涂鱼具有一定的氨氮耐受能力,可以通过某种体内调节机制降低因受氨氮胁迫而升高的血氨浓度。
较早研究认为氨氮胁迫下GS活性提高导致的谷氨酰胺积累是造成鱼类死亡的关键因素之一,氨氮胁迫下鱼类脑组织中的谷氨酰胺积累造成星状胶质细胞肿胀,使得颅内压升高,最终导致鱼死亡[23];但Vander等[24]对鱼类额骨构造的分析表明,鱼类不同于哺乳动物,鱼类额骨有较多间隙,能够耐受较强颅内压。因此,谷氨酰胺的积累并不是造成鱼类在氨氮胁迫下死亡的原因,这使得有关氨氮胁迫为何会引起谷氨酰胺的积累以及谷氨酰胺的积累在鱼体中发挥了怎样的作用等问题又重新被重视起来。本研究结果表明,对照组GS基因表达量在12 h上调后再无显著性变化,而与其相对应的对照组GS酶活性却没有检测到显著性差异,考虑到由基因表达到蛋白合成是一个复杂的修饰与加工的过程,其中蛋白活化会受到磷酸化等多种不定因素的影响[25],酶的活性也会受到激活因子浓度及活性位点识别等多方面的影响,因此表现出基因表达量与酶活性不一致的现象,这也说明基因的mRNA丰度与其翻译产物的表达量不具有线性关系[26];在氨氮胁迫组中大弹涂鱼肝脏GS酶活性呈先上升后下降的趋势,且在24 h达到最大值,与其对应的GS基因表达量在12 h显著上升并在48 h进一步上升达到最大值,推测GS基因表达量在12 h显著上升促进了GS酶的合成,其酶活性显著提高并于24 h达到最大值,而后GS基因在48 h进一步上调却没有引起GS酶活性的上调,这一现象也可以用mRNA丰度与其翻译产物的表达量不具有线性关系来解释,
但氨氮胁迫导致的GS活性及其基因表达量的一系列变化似乎与大弹涂鱼血氨浓度变化存在一定的关联,可能存在当血氨浓度急速上升,GS酶活性提高将NH3和谷氨酸合成了中性、无毒的谷氨酰胺,从而降低血氨浓度缓解氨对鱼体的危害,提高了鱼体的氨氮耐受能力。近期研究指出,虹鳟(Oncorhynchus mykiss)不具备功能性尿素循环和尿素排泄能力,其在面对氨氮胁迫时主要通过GS将氨和谷氨酸转化成谷氨酰胺,再将谷氨酰胺存储起来,待恢复正常环境后作为能量来源调动使用[27]。与其结果类似,
大弹涂鱼同样不具备功能性尿素排泄能力,推测大弹涂鱼在受到高氨氮胁迫后,同样采用合成谷氨酰胺的方式降低内源性氨的积累。相关研究还见于中华乌塘鳢(Bostrichthys sinensis)[28]、金头鲷(Sparus aurata)[29]等,在导致鱼体氨中毒的不良环境胁迫下,
均检测到GS活性不同程度的上调。表明大弹涂鱼在氨氮胁迫下通过GS将氨合成中性、无毒的谷氨酰胺是其重要的氨代谢途径之一。
3.2 CA,NHE协助Rh蛋白进行氨的持续排泄作用
除了被转化成无毒的谷氨酰胺这一途径之外,氨废物还可以通过鳃组织上的氨转运蛋白排出体外。You等[20]对大弹涂鱼72 h氨氮胁迫后进行了鳃部转录组组学分析发现,胁迫后调控H+-ATPase酶的mRNA表达量显著升高,这一结果显示了大弹涂鱼酸排泄与氨氮排泄之间的正相关关系。CA是一种含锌金属酶,主要催化CO2+H2O↔HCO3-+H+这一可逆反应[30]。本研究中对急性氨氮胁迫后的大弹涂鱼鳃组织中CA的蛋白表达量及其编码基因CA15的相对表达量进行检测,结果表明,在48 h时CA蛋白表达量及其编码基因CA15的相对表达量均达到最大值,推测在CA作用下提供H+形成酸化层,使NH3质子化,协助Rh蛋白间接参与大弹涂鱼氨排泄过程。已有研究证实了作为模式动物的斑马鱼(Brachydanio rerio)鳃部H+-ATPase富集细胞(HR细胞)中存在CA特异性表达位点,表明CA参与了斑马鱼HR细胞的酸碱调节和Na+摄取这一过程[31]。尽管已有对海水鱼鳃部氨排泄功能的研究指出,酸化的边界层在高度缓冲的海水中的作用是微乎其微的[32],但对于离水后在滩涂上进行活动的大弹涂鱼来说,海水缓冲度降低,通过CA提供H+可能更有利于将Rh蛋白排出的NH3快速转化形成NH4+,降低氨氮以非离子氨的形式存在而对鱼体造成强毒性。
相关研究表明,H+分泌和Na+摄取机制与Rh蛋白排氨作用的实现具有功能性相关[33]。NHE是水环境和鱼体之间进行Na+/H+交换的载体,已经在多种鱼鳃组织中检测到其交换活性,几乎所有鱼体外的钠离子净流入和体内酸根离子的净流出(H+/NH4+)都是通过鳃组织中的NHE完成的[34]。本研究发现,急性氨氮胁迫下的大弹涂鱼鳃组织中NHE3的蛋白水平在胁迫后24 h显著升高并达到最大值,并且直至48 h蛋白表达量依旧显著高于初始状态,与之相对应的NHE基因mRNA的相对表达量也呈现出相似的变化趋势,推测钠氢交换蛋白可能行使了NH+4的排泄作用。这是由于在正常情况下NHE3行使Na+和H+的交换功能,但当鱼体内NH4+含量增多时,推测可能存在NH4+优先于H+通过NHE3排出体外的趋势以增强氨代谢这一功能性。之所以如此推测是由于在运输生理学领域通常认为小分子质量的分子如NH3,CO2是相对可渗透的,无需专门的运输工具或蛋白通道。但Wright等[35]在大弹涂鱼鳃组织中检测到了NH4+的活跃排泄位点,提出可能存在一种新的排氨模式,即在Na+/NH4+交换复合物的作用下进行离子氨的排泄,尤其检测到NHE2/NHE3表达量升高,如此更加印证了本研究的推论。而大弹涂鱼体内增多的NH4+可能是由于CA作用下提供的H+与NH3结合形成的,以降低鱼体内非离子氨的强氨毒性,因此推测大弹涂鱼在氨氮胁迫下能通过NHE3将NH4+排出体外以降低氨毒性。
尽管在众多研究中表明CA和NHE都与氨代谢功能性相关,本研究也得到了相似的结论,但其主要发挥促进NH4+的排泄功能,并不是鱼类主要的氨代谢方式。相关研究指出,鱼类主要氨代谢途径是通过鳃上皮细胞将氨氮废物以NH3的形式排出,而NH3的排出则涉及到氨转运蛋白的作用[36],随着氨转运蛋白(Rhesus-type ammonia transporter)具有运输氨的功能被发现[37],陆续在众多淡水鱼中发现具有类似编码Rh蛋白的核苷酸序列,如红鳍东方鲀(Takifugu rubripes)[38]、青斑河豚(Tetraodon nigroviridis)[39]、虹鳟(Oncorhynchus mykiss)[40]和红树林鳉鱼(Kryptolebias marmoratus)[41]等。同样也获取到了定位在大弹涂鱼鳃上皮细胞基底侧编码Rh蛋白的Rhcg1基因的cDNA序列,经检测,急性氨氮胁迫下的大弹涂鱼鳃组织中Rhcg1基因相对表达量呈现先上升后下降的趋势,并在48 h达到最大值,推测其促进了Rh蛋白的加速合成,促进氨废物以NH3的形式通过氨转运蛋白持续排出,从而阻止了血氨浓度的持续升高。Rh基因以多种形式存在编码合成Rh蛋白,如Rhag、Rhbg、Rhcg1和Rhcg2等,其中Rhcg1定位于鳃上皮细胞基底侧,是参与NH3排泄的关键基因,通过基因敲除技术获取无Rhcg1基因的斑马鱼,检测发现其Rh蛋白表达量显著下调且对排氨有显著抑制作用[42]。对虹鳟鳃组织中Rhag、Rhbg、Rhcg1和Rhcg2活性位点鉴定分析,提出虹鳟鳃中的Rh蛋白利用酸化的边界层形成有利的pH梯度,在血氨浓度升高时促进氨的快速代谢,进一步明确了Rh蛋白具有NH3气体排泄通道的作用且酸化层的形成对氨代谢至关重要[43]。对此,本研究推测大弹涂鱼通过鳃上皮细胞基底侧Rhcg1基因的高表达合成更多的Rh蛋白加快NH3排出,并在CA的作用下,释放H+协助Rh蛋白实现NH3排泄后的质子化,降低离子氨对鳃上皮细胞的损伤和以NH3形式存在的氨进一步扩散进入鱼体的可能性。同时,在鳃上皮细胞内,CA释放H+将膜内NH3质子化形成NH4+再通过NHE完成Na+/ NH4+的交换,最终实现在CA和NHE的共同作用下促进Rh蛋白高效排氨。
4 结论
本研究结果显示,急性氨氮胁迫会导致大弹涂鱼血氨含量显著升高,但其能迅速降低血氨水平,突出其具有重要的氨代谢途径以应对不良环境而做出适应性调节的能力。基于氨氮胁迫下血氨浓度、相关蛋白活性及表达量、氨代谢相关基因mRNA在不同组织中表达量的变化,推测大弹涂鱼主要通过两种主要方式进行氨代谢:一方面是加强氨的排泄,如在鳃上皮细胞基底外侧膜CA的作用下,释放H+协助Rh蛋白实现NH3排泄后的质子化降低氨氮毒性,同时在鳃上皮细胞内,CA提供H+将NH3质子化形成NH4+再通过NHE完成Na+/ NH4+的转运,最终实现在CA和NHE的共同作用下促进Rh蛋白高效排氨;另一方面是加强氨的转化作用,如通过肝脏中GS活性的提高加速合成无毒的中间产物(谷氨酰胺),避免氨在鱼体内过量积累。
