香远合剂对桥本氏甲状腺炎大鼠Th1/Th2细胞平衡的影响及意义①
2019-11-20肖新怀
肖新怀
(广州医科大学附属第二医院,广州510250)
桥本氏甲状腺炎是一种比较常见的内分泌疾病以及器官特异性自身免疫性疾病,也称为自身免疫性甲状腺炎[1],在桥本氏甲状腺炎的发病过程中Th1/Th2细胞的免疫失衡发挥重要作用,是Th1占优势的疾病[2];西医治疗桥本氏甲状腺炎具有一定效果,但西医治疗副作用大、容易复发,是临床治疗需要解决的难题之一;中医治疗桥本氏甲状腺炎疗效稳定,且无明显毒副作用,在临床桥本氏甲状腺炎治疗中得到医生的认可[3],香远合剂具有软坚散结、益气扶正、养心安神的功效[4],雷公藤在治疗自身免疫性疾病上具有较好疗效,本文建立实验性自身免疫甲状腺炎大鼠模型,以雷公藤作为阳性对照,观察香远合剂对其Th1/Th2细胞平衡的影响,探讨香远合剂对桥本氏甲状腺炎的治疗机制。
1 材料与方法
1.1材料 实验动物:7周龄、雌性、清洁级、体重(140~150)g、大鼠64只,购自北京生命科学研究所,动物许可证号SYXK(京)2015-0002。主要试剂:雷公藤多苷片(湖南千金协力药业有限公司),香远合剂(湖北民族学院附属民大医院药房),甲状腺球蛋白、完全弗氏佐剂、不完全弗氏佐剂(美国Sigma公司),TG-Ab、TPO-Ab、TSH、IFN-γ、IL-10 ELISA试剂盒(天津索罗门生物实验有限公司),伊红、苏木素(中国病理试剂成套中心),IFN-γ、IL-10、β-actin引物(上海生工生物工程公司设计合成),Trizol(美国MBI公司),β-actin抗体、IFN-γ单克隆抗体、IL-10单克隆抗体、HRP标记的山羊抗兔抗体、兔抗人IFN-γ多克隆抗体、兔抗人IL-10多克隆抗体、免疫组化试剂盒、BCA试剂盒(美国Tocris公司)等。
1.2方法
1.2.1动物分组及建立桥本氏甲状腺炎模型 将64只大鼠根据随机数字法分为对照组、模型组、雷公藤多苷片组、香远合剂组,每组16只。模型组、雷公藤多苷片组、香远合剂组建立动物模型,初次免疫时将甲状腺球蛋白溶解到生理盐水中制成浓度为2 mg/ml 的甲状腺球蛋白溶液,等体积和完全弗氏佐剂混合乳化成油包水制剂,第0天,在大鼠尾根和足垫皮下注射甲状腺球蛋白(100 μg),对照组大鼠同样部位注射等量生理盐水;加强免疫时在第2周,将浓度为2 mg/ml的甲状腺球蛋白溶液和不完全弗氏佐剂混合制成乳化剂,每只大鼠尾根和足垫皮下注射甲状腺球蛋白(100 μg),每周1次至第7周,期间给予高碘水(0.64 g/L碘化钠)喂养,对照组大鼠相同部位注射等量生理盐水,给予普通饲料和自来水喂养。
1.2.2各组大鼠处理 实验第6周开始,雷公藤多苷片组给予雷公藤多苷片(将雷公藤多苷片研磨成粉状并用温开水制成悬浊液)灌胃(剂量等同人每日用药量×0.018×5),1次/d至第10周;香远合剂组大鼠给予香远合剂(4 ml)灌胃,1次/d至第10周;模型组继续每周皮下注射造模至第10周。
1.2.3动物取材 实验结束后处死大鼠,经眼球取血离心后用于血清学检查;取大鼠甲状腺组织固定于福尔马林中进行病理分析。
1.2.4各组大鼠血清抗甲状腺抗体、甲状腺功能及血清IFN-γ、IL-10水平测定 采用ELISA法测定各组大鼠血清TG-Ab、TPO-Ab、TSH、IFN-γ、IL-10水平(实验步骤按照试剂盒说明书进行)。
1.2.5各组大鼠甲状腺组织HE染色 将各大鼠甲状腺标本常规脱水、透明、浸蜡,石蜡包埋后切成厚 4 μm切片,常规进行HE染色,显微镜下观察染色情况。
1.2.6各组大鼠甲状腺组织免疫荧光染色 将甲状腺切片于多聚甲醛固定液中固定4 h,PBS漂洗3次,加入小鼠抗CD45R(1∶500),于4℃孵育过夜。二抗采用Aleax 555标记的羊抗鼠IgG(1∶500),孵育30 min。于激光共聚焦显微镜拍照成像。
1.2.7各组大鼠甲状腺组织IFN-γ、IL-10 mRNA水平测定 将各大鼠甲状腺组织匀浆后,12 000 g离心15 min,取上清液提取甲状腺组织总RNA,采用RT-PCR法测定大鼠甲状腺组织IFN-γ、IL-10 mRNA水平,β-actin为内参对照,反应条件为94℃ 3 min;94℃ 45 min、46℃ 45 min、72℃ 45 min,共32个循环;72℃ 5 min。采用四星凝胶图像分析系统对IFN-γ、IL-10、β-actin产物条带密度进行半定量分析。
1.2.8各组大鼠甲状腺组织IFN-γ、IL-10蛋白水平测定 提取各组大鼠甲状腺组织总蛋白质,采用BCA法测定甲状腺组织总蛋白质浓度,采用Western blot测定甲状腺组织IFN-γ、IL-10蛋白水平。目标蛋白相对表达量=目标蛋白条带灰度值/β-actin条带灰度值。
1.2.9各组大鼠甲状腺组织IFN-γ、IL-10免疫组化染色 采用免疫组化SP法染色测定,具体操作严格按照说明书进行。阳性细胞为细胞中出现黄褐色或棕黄色颗粒,采用捷达801形态分析软件对结果进行平均光密度、灰度值、阳性面积进行测定,并计算相对表达量。

2 结果
2.1各组大鼠抗甲状腺抗体、TSH和细胞因子水平比较 各组大鼠TG-Ab、TPO-Ab、TSH、IFN-γ、IL-10、IFN-γ/IL-10比较差异均有统计学意义(P<0.05)。与对照组比较,模型组、雷公藤多苷片组、香远合剂组TG-Ab、TPO-Ab、IFN-γ、IFN-γ/IL-10升高(P<0.05),TSH、IL-10水平降低(P<0.05);与模型组比较,雷公藤多苷片组、香远合剂组TG-Ab、TPO-Ab、IFN-γ、IFN-γ/IL-10降低(P<0.05),TSH水平、IL-10升高(P<0.05);与雷公藤多苷片组比较,香远合剂组TG-Ab、TPO-Ab、IFN-γ、IFN-γ/IL-10降低(P<0.05),TSH、IL-10水平升高(P<0.05)。见表1。
2.2各组大鼠甲状腺组织HE染色比较 对照组大鼠甲状腺滤泡呈椭圆形或圆形,未见浆细胞和淋巴细胞浸润;模型组大鼠甲状腺滤泡排列紊乱,被大量破坏,滤泡周围有淋巴细胞浸润,滤泡内有浆细胞浸润;雷公藤多苷片组滤泡破坏减少,滤泡内及滤泡周围浆细胞和淋巴细胞浸润减少;香远合剂组大鼠甲状腺滤泡较雷公藤多苷片组减少,浆细胞和淋巴细胞浸润较雷公藤多苷片组减少。见图1。
本研究显示建模大鼠甲状腺自身抗体水平升高,甲状腺组织出现淋巴细胞浸润和滤泡结构破坏,表明建模成功。
2.3各组大鼠甲状腺组织CD45R免疫荧光染色结果 为了进一步证实甲状腺组织存在淋巴细胞浸润,利用抗大鼠CD45R抗体行免疫荧光染色,结果显示,与对照组相比,模型组大鼠CD45R表达显著增加。与模型组相比,雷公藤多苷片组和香远合剂组大鼠CD45R表达明显减少。见图2。
2.4各组大鼠甲状腺组织IFN-γ、IL-10、IFN-γ/IL-10 mRNA比较 各组大鼠甲状腺组织IFN-γ、IL-10、IFN-γ/IL-10 mRNA比较差异均有统计学意义(P<0.05)。与对照组比较,模型组、雷公藤多苷片组、香远合剂组IFN-γ、IFN-γ/IL-10 mRNA表达升高(P<0.05),IL-10 mRNA表达降低(P<0.05);与模型组比较,雷公藤多苷片组、香远合剂组IFN-γ、IFN-γ/IL-10 mRNA表达降低(P<0.05),IL-10 mRNA升高(P<0.05);与雷公藤多苷片组比较,香远合剂组IFN-γ、IFN-γ/IL-10 mRNA表达降低(P<0.05),IL-10 mRNA表达升高(P<0.05)。见表2。
2.5各组大鼠甲状腺组织IFN-γ、IL-10、IFN-γ/IL-10蛋白表达比较 Western blot结果显示,各组大鼠甲状腺组织IFN-γ、IL-10、IFN-γ/IL-10蛋白表达比较差异均有统计学意义(P<0.05)。与对照组比较,模型组、雷公藤多苷片组、香远合剂组IFN-γ、IFN-γ/IL-10蛋白表达升高(P<0.05),IL-10蛋白表达降低(P<0.05);与模型组比较,雷公藤多苷片组、香远合剂组IFN-γ、IFN-γ/IL-10蛋白表达降低(P<0.05),IL-10 蛋白表达升高(P<0.05);与雷公藤多苷片组比较,香远合剂组IFN-γ、IFN-γ/IL-10 蛋白表达降低(P<0.05),IL-10蛋白表达升高(P<0.05)。见表3和图3。

图1 各组大鼠甲状腺组织HE染色(×200)Fig.1 HE staining of thyroid tissue in each group of rats (×200)Note: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.
表1 各组大鼠抗甲状腺抗体、TSH和细胞因子水平比较
Tab.1 Comparison of antithyroid antibody,TSH and cytokine levels in each group
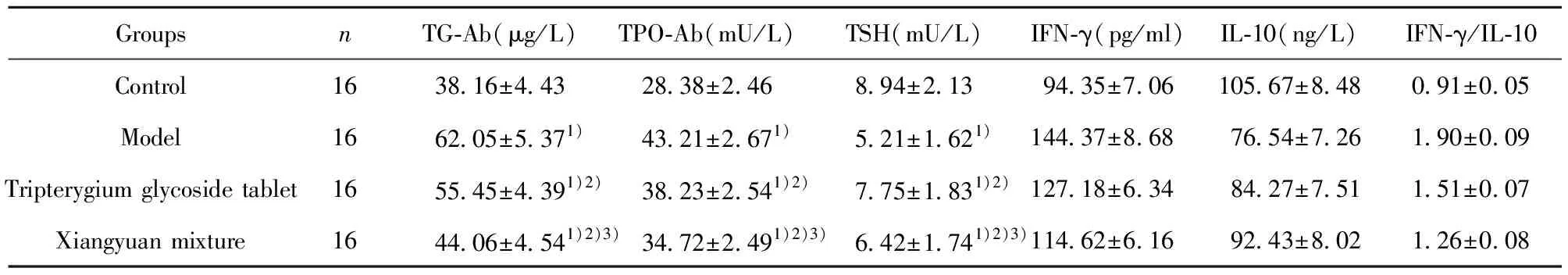
GroupsnTG-Ab(μg/L)TPO-Ab(mU/L)TSH(mU/L)IFN-γ(pg/ml)IL-10(ng/L)IFN-γ/IL-10Control1638.16±4.4328.38±2.468.94±2.1394.35±7.06105.67±8.480.91±0.05Model1662.05±5.371)43.21±2.671)5.21±1.621)144.37±8.6876.54±7.261.90±0.09Tripterygium glycoside tablet1655.45±4.391)2)38.23±2.541)2)7.75±1.831)2)127.18±6.3484.27±7.511.51±0.07Xiangyuan mixture1644.06±4.541)2)3)34.72±2.491)2)3)6.42±1.741)2)3)114.62±6.1692.43±8.021.26±0.08
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with tripterygium glycosides group,3)P<0.05.
表2 各组大鼠甲状腺组织IFN-γ、IL-10、IFN-γ/IL-10 mRNA比较
Tab.2 Comparison of IFN-γ,IL-10 and IFN-γ/IL-10 mRNA in thyroid tissue of rats in each group

GroupsnIFN-γIL-10IFN-γ/IL-10Control160.32±0.070.63±0.110.51±0.06Model160.81±0.121)0.27±0.081)3.01±0.091)Tripterygium glycoside tablet160.64±0.091)2)0.39±0.071)2)1.64±0.101)2)Xiangyuan mixture160.49±0.081)2)3)0.52±0.101)2)3)0.94±0.081)2)3)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with tripterygium glycosides group,3)P<0.05.
表3 各组大鼠甲状腺组织IFN-γ、IL-10、IFN-γ/IL-10蛋白比较(Western blot)
Tab.3 Comparison of IFN-γ,IL-10 and IFN-γ/IL-10 protein in thyroid tissue of each group of rats (Western blot)

GroupsnIFN-γIL-10IFN-γ/IL-10Control160.18±0.050.71±0.130.25±0.03Model160.67±0.091)0.38±0.071)1.76±0.071)Tripterygium glycoside tablet160.52±0.061)2)0.49±0.081)2)1.06±0.061)2)Xiangyuan mixture160.31±0.051)2)3)0.54±0.111)2)3)0.57±0.051)2)3)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with tripterygium glycosides group,3)P<0.05.
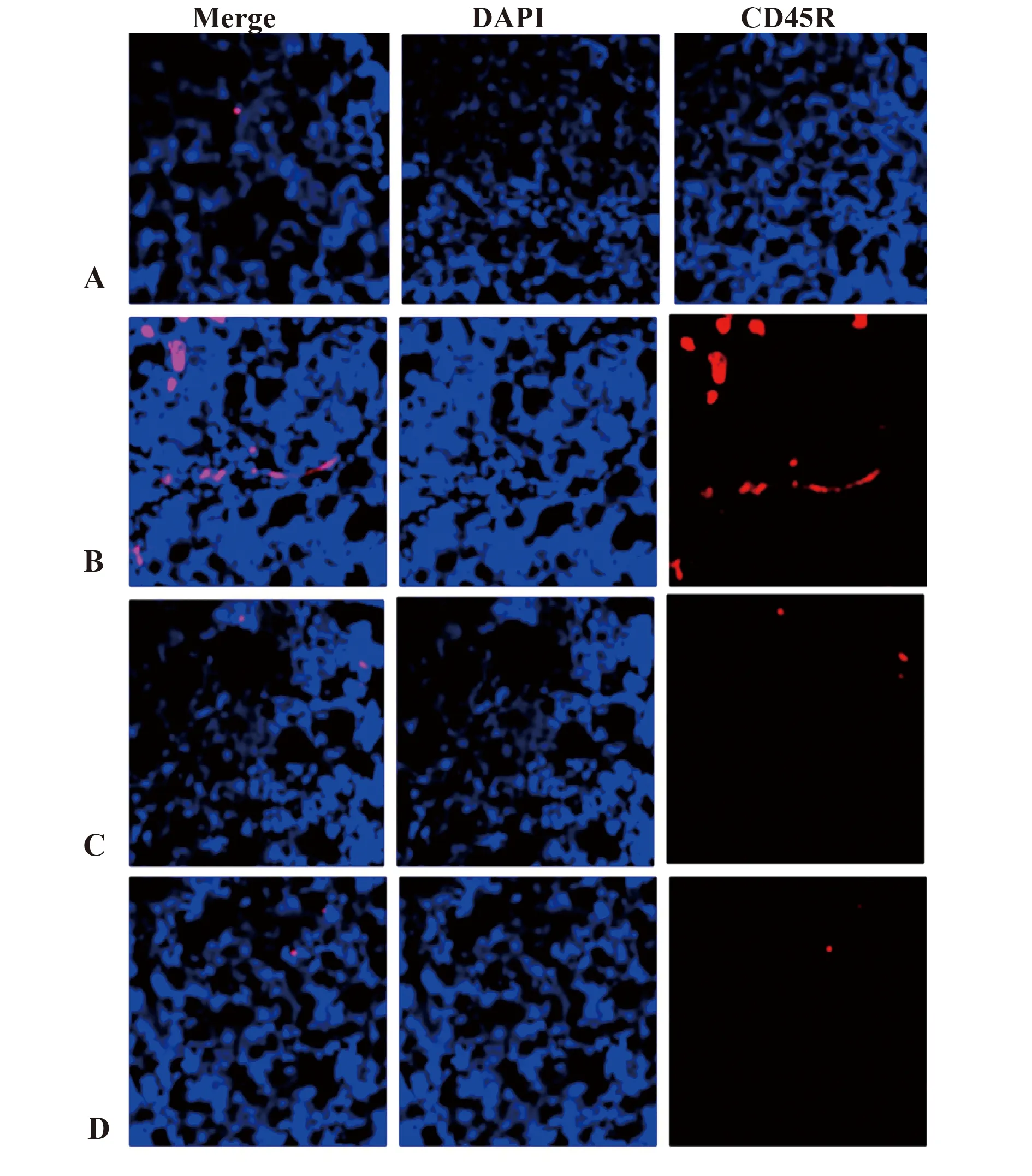
图2 各组大鼠甲状腺组织CD45R染色结果(×200)Fig.2 Immunofluorescent staining of thyroid tissue in each group of rats (×200)Note: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.

图3 3各组大鼠甲状腺组织IFN-γ蛋白、IL-10蛋白Western blot电泳图Fig.3 3 Western blot analysis of IFN-γ protein and IL-10 protein in thyroid tissue of rats in each groupNote: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.
2.6各组大鼠甲状腺组织IFN-γ、IL-10蛋白免疫组化染色 免疫组化结果显示,IFN-γ、IL-10蛋白阳性为细胞胞浆中出现黄褐色或棕黄色颗粒,模型组大鼠IFN-γ 染色最深,其次为雷公藤多苷片组,再次为香远合剂组,对照组IFN-γ染色最弱;模型组大鼠IL-10染色最弱,其次为雷公藤多苷片组,再次为香远合剂组,对照组IL-10染色最深,见图4、图5。各组大鼠甲状腺组织IFN-γ、IL-10、IFN-γ/IL-10蛋白相对表达量比较差异均有统计学意义(P<0.05)。与对照组比较,模型组、雷公藤多苷片组、香远合剂组IFN-γ、IFN-γ/IL-10蛋白相对表达量升高(P<0.05),IL-10蛋白相对表达量降低(P<0.05);与模型组比较,雷公藤多苷片组、香远合剂组IFN-γ、IFN-γ/IL-10蛋白相对表达量降低(P<0.05),IL-10蛋白相对表达量升高(P<0.05);与雷公藤多苷片组比较,香远合剂组IFN-γ、IFN-γ/IL-10 蛋白相对表达量降低(P<0.05),IL-10 蛋白相对表达量升高(P<0.05)。见表4。
表4 各组大鼠甲状腺组织IFN-γ、IL-10、IFN-γ/IL-10蛋白相对表达量比较(免疫组化染色)
Tab.4 Comparison of IFN-γ,IL-10 and IFN-γ/IL-10 protein relative expressin in thyroid tissue of each group of rats (immunohistochemical staining)

GroupsnIFN-γIL-10IFN-γ/IL-10Control group167.21±0.8514.63±1.740.49±0.21Model group1618.96±2.311)3.21±0.671)5.91±1.381)Tripterygium glycoside tablet group1614.35±1.421)2)6.78±1.121)2)2.12±0.821)2)Xiangyuan mixture group1611.73±1.161)2)3)10.96±1.311)2)3)1.07±0.471)2)3)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with tripterygium glycosides group,3)P<0.05.

图4 各组大鼠甲状腺组织中IFN-γ 免疫组化染色Fig.4 IFN-γ immunohistochemical staining in thyroid tissue of each group of ratsNote: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.

图5 各组大鼠甲状腺组织中IL-10免疫组化染色Fig.5 Immunohistochemical staining of IL-10 in thyroid tissue of each group of ratsNote: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.
3 讨论
桥本氏甲状腺炎和实验性自身免疫性甲状腺炎具有相同的病理学基础和临床表现,典型的病理特征包括甲状腺内有弥漫的浆细胞、淋巴细胞、巨噬细胞浸润以及产生特异性的TG-Ab、TPO-Ab抗体,最终引起甲状腺滤泡的破坏。本研究通过建立实验性自身免疫性甲状腺炎大鼠模型,发现建模大鼠甲状腺滤泡被破坏,出现大量浆细胞和淋巴细胞浸润,血清TG-Ab、TPO-Ab抗体水平显著升高,表明自身免疫性甲状腺炎大鼠模型建立成功。
祖国医学认为桥本氏甲状腺炎归属“瘿病”范畴,发病机制和饮食水土、情志失调、体质因素等有关,桥本氏甲状腺炎的气虚血瘀、气滞痰凝、肝郁化火等病理机制导致血瘀、痰凝、气滞壅结于颈前引起该病的发病[5],根据中医理论将中药结合当地民族药物组方研制成香远合剂,香远合剂包括172味中药,具有软件散结、益气扶正、养心安神的功效[6],在临床桥本氏甲状腺炎的治疗中具有较好效果[7]。雷公藤多苷片具有较好的抑制炎症反应、调节体液免疫和细胞免疫的作用,在治疗自身免疫性疾病中疗效显著[8]。本文通过建立实验性自身免疫性甲状腺炎大鼠模型,给予香远合剂治疗,并以雷公藤多苷片为阳性对照,发现香远合剂和雷公藤多苷片治疗桥本氏甲状腺炎疗效均显著,可使甲状腺滤泡组织基本恢复正常,淋巴细胞和浆细胞浸润程度明显降低,血清TG-Ab、TPO-Ab抗体水平降低,甲状腺功能异常有所恢复,但与雷公藤多苷片比较,香远合剂的治疗效果更加显著。本研究证实了香远合剂对桥本氏甲状腺炎的治疗效果显著。
香远合剂通过何种机制治疗桥本氏甲状腺炎尚不十分清楚,尚待进一步研究。桥本氏甲状腺炎是由于抑制性T细胞存在遗传性缺陷、辅助性T细胞和抗原结合抵抗甲状腺上皮细胞,诱导细胞介导、抗体依赖的细胞毒作用的免疫机制,在桥本氏甲状腺炎发病过程中Th1细胞因子亢进、占据优势,Th1/Th2细胞平衡失调具有重要作用[9,10]。T淋巴细胞分为CD4和CD8 T淋巴细胞两大亚群,正常情况下,CD4 T淋巴细胞处于前体状态,表达少量的IL-2,当特异性抗原刺激抗原递呈细胞后诱导其成为前体细胞,在细胞因子的作用下分化为Th1细胞和Th2细胞,Th1细胞分泌IFN-γ、IL-2、TNF-α等细胞因子介导细胞免疫;Th2细胞分泌IL-4、IL-10等细胞因子介导体液免疫,Th1/Th2细胞平衡反映机体免疫倾向,两者在正常情况下相互调节、相互抑制,处于动态平衡状态,维持正常的细胞和体液免疫,当两者之间的平衡被打破时可引起桥本氏甲状腺炎的发生[11]。IFN-γ为Th1细胞因子,可增强甲状腺上皮细胞表达HLA-Ⅱ类抗原的表达,该抗原表达可使甲状腺细胞转化为抗原递呈细胞,激活CD4 T淋巴细胞IL-2受体,并引起IL-2细胞因子分泌释放,IL-2细胞因子激活分泌其他细胞因子,趋化大量T淋巴细胞和单核细胞进入甲状腺内增加细胞毒性作用,从而诱导B细胞分化成熟并促进自身抗体产生[12-14]。IL-10为一种Th2型细胞因子,在细胞免疫过程中发挥负向调节因子作用,IL-10在甲状腺组织浸润的单核细胞和淋巴细胞内,表达量随着免疫疾病的进展而减少,免疫疾病越严重,IL-10表达量越低,在终末期桥本氏甲状腺炎患者的甲状腺组织中几乎没有IL-10细胞因子的表达[15-17]。本研究中自身免疫性甲状腺炎的模型大鼠的血清和脑组织IFN-γ、IFN-γ/IL-10升高,IL-10水平下降,表明自身免疫性甲状腺炎大鼠模型存在Th1/Th2细胞平衡失调;香远合剂治疗后大鼠血清和脑组织IFN-γ、IFN-γ/IL-10下降,IL-10水平升高。分析香远合剂治疗桥本氏甲状腺炎机制可能为通过纠正Th1/Th2细胞平衡失调在桥本氏甲状腺炎的治疗中发挥作用。
