由碳铵沉淀低价金属离子生成碳酸盐的证实与变式训练
2019-11-19云南
云南
一、问题的提出
根据2019年全国卷Ⅲ第26题,工业上可设计如下流程,由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备高纯硫酸锰:


二、相关理论

查表知:Ka1(H2CO3)=4.2×10-7;
Ka2(H2CO3)=5.6×10-11;
Kb(NH3·H2O)=1.8×10-5;
Ksp[Mn(OH)2]=1.6×10-13;
Ksp[MnCO3]=1.8×10-11;
以0.50 mol·L-1NH4HCO3溶液为例进行计算:
设NH3·H2O平衡浓度为xmol·L-1,则:
起始浓度(mol·L-1) 0.50 0.50 0 0
变化浓度(mol·L-1)xxxx
平衡浓度(mol·L-1) 0.50-x0.50-xxx


解得:x=c平(NH3·H2O)=c平(H2CO3)≈1.7×10-2mol·L-1②

将②、③代入NH3·H2O的电离常数式中:
=1.8×10-5
c平(OH-)=6.5×10-7mol·L-1



需要Qc(MnCO3)>Ksp[MnCO3]的成立条件为c(Mn2+)×1.8×10-3mol·L-1>1.8×10-11,即c(Mn2+)>1.0×10-8,很容易达到这一条件,故竞争性更强;
需要Qc[Mn(OH)2]>Ksp[Mn(OH)2]的成立条件为c(Mn2+)×(6.50×10-7)2>1.6×10-13,即c(Mn2+)>0.38,竞争性较弱。
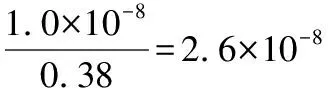
以上计算可用实验证明:向0.50 mol·L-1NH4HCO3溶液中滴加0.50 mol·L-1BaCl2溶液,澄清溶液中明显出现白色浑浊,随着BaCl2溶液的增加,最终产生了气泡。考虑碳酸氢铵是否变质或混有碳酸铵等影响因素,重新配制0.50 mol·L-1NH4HCO3溶液,并向其中通入CO2气体数分钟,再滴加0.50 mol·L-1BaCl2溶液,澄清溶液仍然生成白色浑浊和气泡。
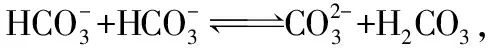



起始浓度(mol·L-1) 1.0 0.50 0 0
变化浓度(mol·L-1)xxxx
平衡浓度(mol·L-1) 1.0-x0.50-xxx
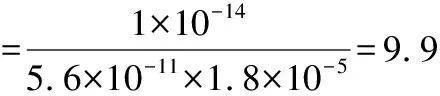


②

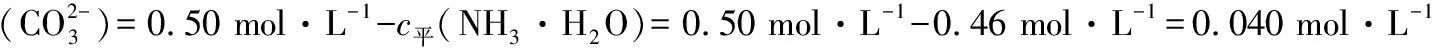
将②、③代入NH3·H2O的电离常数式中:

c平(OH-)=1.5×10-5mol·L-1
需要Qc(MnCO3)>Ksp[MnCO3]的成立条件为c(Mn2+)×0.040 mol·L-1>1.8×10-11,即c(Mn2+)>4.5×10-10,竞争性很强;
需要Qc[Mn(OH)2]>Ksp[Mn(OH)2]的成立条件为c(Mn2+)×(1.53×10-5)2>1.6×10-13,即c(Mn2+)>6.8×10-4,竞争性较差。

c碳酸铵溶液中(OH-)=1.5×10-5mol·L-1
c碳铵溶液中(OH-)=6.5×10-7mol·L-1
∴c碳酸铵溶液中(OH-)>c碳铵溶液中(OH-)
故(NH4)2CO3与MnSO4溶液反应时会混有更多的Mn(OH)2。因此,在实际生产中,常常选择碳铵来制取金属碳酸盐。
三、结论
加入碳铵,欲使金属离子An+完全生成碳酸盐沉淀,即An+≤10-5mol·L-1。
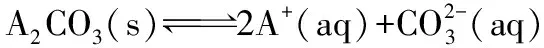
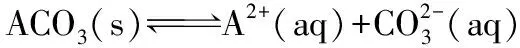
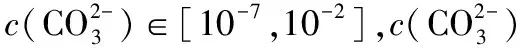

四、变式训练
【练习1】某地以辉铜矿(内含大量Cu2S、少量Fe2O3、SiO2等杂质)制备胆矾的流程如下,沉锰时还有一种酸性气体生成,写出沉锰时的离子方程式:____________________。



【练习2】某硫酸厂烧渣主要成分是Fe2O3、FeO,同时含有少量SiO2等杂质。按照如下流程制备高纯度铁红,沉铁足量碳酸氢铵与硫酸亚铁反应的离子方程式为____________________
____________________。实验发现,若用碳酸钠代替碳酸氢铵,生成的碳酸亚铁中混有较多的氢氧化亚铁,原因是____________________。回答下列问题:

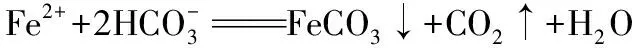

【练习3】(2019云南省第二次省统测28题改编)湿法炼锌厂在除杂过程中会产生大量铁矾渣。某黄钾铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO·Fe2O3及少量CaO、MgO、SiO2等。一种由黄钾铁矾渣制备复合镍锌铁氧体(NiZnFe4O8)的流程如下:

(1)滤渣Ⅰ的主要成分是________________。
(2)净化除杂阶段加入Fe粉时发生反应的离子方程式为__________________、__________________。已知:25℃时Ksp(CaF2)=2.7×10-11,Ksp(MgF2)=6.4×10-19。加入NH4F使Ca2+、Mg2+沉淀,若沉淀后溶液中c(Ca2+)=2.7×10-6mol·L-1,则c(Mg2+)=________mol·L-1。
(3)在Fe2+、Ni2+、Zn2+共沉淀过程中,三种离子的损失浓度与pH的关系曲线如图A所示,pH与n(NH4HCO3)∶n(Fe2++Ni2++Zn2+)的关系曲线如图B所示。为提高原料利用率,n(NH4HCO3)∶n(Fe2++Ni2++Zn2+)最好控制在________左右;按此比例,若以Me代表Fe、Ni、Zn元素,则生成MeCO3·2Me(OH)2·H2O沉淀的化学反应方程式为____________________。

图A

图B
(4)铁氧体工艺阶段制备NiZnFe4O8过程中,需加入剂________(填“氧化”或“还原”)。按照上述流程,一座10万吨规模的锌厂每年产生黄钾铁矾渣约5万吨,Fe3+含量为28%。即使不计算酸浸之后过量稀硫酸溶解的铁粉,理论上每年也能够制备复合镍锌铁氧体(NiZnFe4O8,M=476 g·mol-1)________(保留两位有效数字)万吨。
【答案】(1)SiO2


(4)4.5


故:2Fe3+~ 3Fe3+~ 0.75NiZnFe4O8
2×56 g·mol-10.75×476 g·mol-1
5×28%万吨 4.5万吨
