黑逍遥散对阿尔茨海默病模型小鼠Ca2+-CaM/CaMKⅡα信号通路关键因子表达的影响
2019-11-15马春林吴红彦兰美华程坚段永强
马春林 吴红彦 兰美华 程坚 段永强
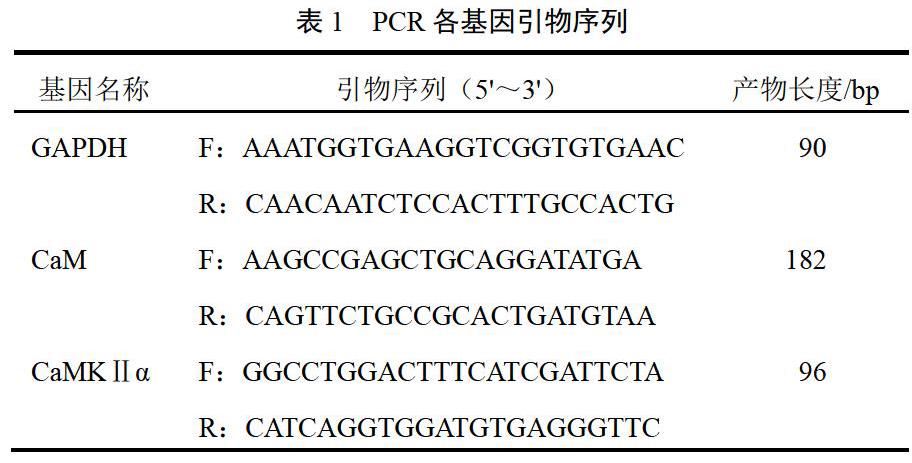

摘要:目的 观察黑逍遥散对阿尔茨海默病(AD)小鼠海马神经元Ca2+浓度和钙调蛋白(CaM)、钙调蛋白依赖性激酶Ⅱα(CaMKⅡα)表达的影响。方法 30只APP/PS1双转基因雄性小鼠称重后,按随机原则分为模型组、阳性对照组和黑逍遥散组,每组10只。另取10只同月龄、同种系野生型C57BL/6雄性小鼠为空白组。各给药组给予相应药物干预,连续3个月,采用钙荧光探针结合激光共聚焦显微镜技术检测海马神经元Ca2+浓度,采用实时荧光定量PCR和免疫组化技术分别检测小鼠海马区CaM、CaMKⅡα基因和蛋白的表达。结果 与空白组比较,模型组小鼠海马神经元Ca2+浓度显著升高,CaM基因和蛋白表达显著升高,CaMKⅡα基因和蛋白表达显著降低(P<0.01,P<0.05);与模型组比较,各给药组小鼠海马神经元Ca2+浓度显著降低,CaM基因和蛋白表达显著降低,CaMKⅡα基因和蛋白表达显著升高(P<0.01,P<0.05)。结论 黑逍遥散通过调节模型小鼠海马Ca2+-CaM/CaMKⅡα信号通路关键因子表达而发挥防治AD的作用。
关键词:黑逍遥散;阿尔茨海默病;海马组织;Ca2+浓度;钙调蛋白;钙调蛋白依赖性激酶Ⅱα;小鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)10-0050-05
DOI:10.3969/j.issn.1005-5304.2019.10.012 开放科学(资源服务)标识码(OSID):
Abstract: Objective To observe the effects of Heixiaoyao Powder on the concentration of Ca2+ and expressions of calmodulin, CaMKⅡα αgenes or proteins in the hippocampus neurons of Alzheimer disease (AD) mice. Methods After weighing, 30 APP/PSI genetically modified mice were randomly divided into model group, positive medicine control group, and Heixiaoyao Powder groups, with 10 mice in each group. Ten wild-type C57BL/6 male mice of the same age and same species were set as blank group. Each administration group was given relevant medicine. After three-month successive gavage, calcium fluorescence probe combined with laser confocal microscopy was used to detect the Ca2+ concentration in hippocampal neurons, and real-time quantitative PCR and immuno- histochemistry were used to detect the expressions of CaM and CaMKⅡα genes and proteins in hippocampus of mice. Results Compared with the blank group, the Ca2+ concentration in the hippocampal neurons of the model group significantly increased, and the expressions of CaM gene and protein were significantly increased, while the expressions of CaMKⅡα gene and protein were decreased (P<0.01, P<0.05). Compared with the model group, the concentration of Ca2+ in hippocampal neurons of mice significantly decreased. The expressions of CaM gene and protein were significantly decreased, while the expressions of CaMKⅡα gene and protein were significantly increased (P<0.01, P<0.05). Conclusion Heixiaoyao Powder can prevent and treat AD by regulating the concentration of Ca2+-CaM/CaMKⅡα signal pathway in the hippocampus of model mice.
Keywords: Hei Xiaoyao Powder; Alzheimer disease; hippocampus; Ca2+; CaM; CaMKⅡα; mice
阿爾茨海默病(Alzheimer disease,AD)是一种增龄性的神经退化性疾病,以大脑皮层退化导致记忆力、判断力、抽象思维力、推理能力及情感反应障碍和性格改变为主要临床特征[1]。据报道,目前全世界痴呆患者约有4680万人,而我国占比超过l/4,随着我国老龄化趋势的加速,如缺乏有效防治措施,AD患者必将迅速增加[2]。研究表明,AD发病时脑神经元存在钙稳态失衡[3]。Ca2+/CaM-CaMKⅡ-CREB是中枢神经系统学习记忆形成与维持的重要信号转导通路[4],其中Ca2+是一种重要的第二信使,参与多种细胞生理生化过程[5];钙调蛋白(CaM)是胞内重要的信号传导分子,与Ca2+结合形成Ca2+/CaM复合物,通过激活下游分子参与学习记忆等多种生理学效应[6];钙调蛋白依赖性激酶Ⅱα(CaMKⅡα)是胞内参与钙信号转导的一种依赖于Ca2+的酶类,广泛参与基因转录调节、骨架蛋白磷酸化,其活性异常可能是AD的发病机制之一[7]。Ca2+-CaM可诱导CaMKⅡ发生分子构像改变,在Thr286位点出现磷酸化,活化的CaMKⅡ可激活神经元胞核内转录机制,从而调控神经元胞内或胞膜的酶类或受体成分的合成[8]。本课题组前期已应用基因芯片检测大鼠基因表达谱改变,部分差异表达基因聚类分析提示,黑逍遥散干预AD大鼠与Ca2+-CaM/CaMKⅡ信号通路有关[9]。因此,本实验从Ca2+-CaM/CaMKⅡ信号通路探讨黑逍遥散对APP/PSI双转基因小鼠海马区CaM、CaMKⅡα因子的干预作用,为该方防治AD的研发提供依据。
1 实验材料
1.1 动物
雄性SPF级APP/PS1双转基因小鼠30只,4月龄,体质量(25±5)g,同月龄、同种系雄性小鼠10只,均购于北京华阜康生物科技股份有限公司,动物许可证号SCXK(京)2014-0004。饲养于甘肃中医药大学SPF级动物实验中心,温度20 ℃、湿度40%,昼夜交替12 h,自由摄食饮水。
1.2 药物
黑逍遥散按熟地黄∶柴胡∶当归∶白芍∶茯苓∶白术∶生姜∶甘草∶薄荷=7.5∶5∶5∶5∶5∶5∶5∶4∶1比例,购自甘肃中医药大学附属医院,采取传统水煎法制备成水煎液,无菌条件装瓶,4 ℃贮存备用。盐酸多奈哌齐片,卫材(中国)药业有限公司,批号1604043。
1.3 主要试剂与仪器
Fluo-3/AM(翊圣,F58890),PluronicF-127(上海复凝科技有限公司),无钙和含钙人工脑脊液(自配),胰蛋白酶(翊圣,T1826471),Rabbit Anti- Calmodulin Polyclonal Antibody、Rabbit Anti-CaMKⅡα Polyclonal Antibody(北京博奧森生物技术有限公司,bs-0527R、bs-3666R),辣根酶标记山羊抗兔IgG(H+L)(中杉金桥,ZB-2301),TRIzolTM Reagent (Invitrogen Corporation, Cat. No.15596026),GoScriptTM Reverse Transcription System和GoTaq?qPCR Master Mix(Promega Corporation,0000303542、0000275172)。1 mL和10 ?L微量加样器(Eppendorf,R18012G、H18771H),激光共聚焦显微镜(日本Olympus,RS2000TM),连续波长酶标仪(美国Bio-Rad),PCR仪(美国Bio-Rad,CFX96),超薄切片机(瑞典LKB),电脑生物组织摊烤片机(浙江金华),光学显微镜(日本Olympus,CKX21)。
2 实验方法
2.1 分组及给药
将30只4月龄AD小鼠按随机分组法分为3组,给药剂量按人和动物体表面积比进行换算。黑逍遥散组给予黑逍遥散水煎液(6 g原药材/kg)灌胃,阳性对照组给予盐酸多奈哌齐(3.25 mg/kg)药液灌胃,给药体积0.2 mL/10 g。同月龄同系种小鼠10只作为空白组,模型组和空白组给予等体积纯净水灌胃。每日1次,连续3个月。
2.2 荧光探针结合激光共聚焦显微镜技术检测海马神经元[Ca2+]i相对荧光强度
参照文献[10-13]方法,主要步骤包括标本制作、神经细胞Fluo-3/AM负载、激光共聚焦显微镜技术检测和图象分析等。
2.3 实时荧光定量PCR检测
Trizol法提取小鼠海马组织总RNA,检测浓度纯化后,反转录成cDNA,-20 ℃冰箱保存备用。引物CaM、CaMKⅡα、GAPDH由宝生物工程(大连)有限公司合成,其序列详见表1。按95 ℃预热3 min,95 ℃变性5 s,60 ℃ 退火与延伸40 s,40个循环,PCR仪进行扩增反应。2-ΔΔCt法分析结果,计算相对表达量。
2.4 免疫组化检测
切片经脱蜡、抗原修复、冲洗、内源性过氧化物酶灭活处理后,加一抗Rabbit Anti-Calmodulin Polyclonal Antibody(1∶400)、Rabbit Anti-CaMKⅡα Polyclonal Antibody(1∶200)将载玻片置于37 ℃恒温培养箱中孵育2 h,PBS冲洗2次×5 min,滴加二抗(1∶500),室温孵育30 min,取出后PBS冲洗2次×5 min,滴加显色剂,经复染、脱水和透明后,树胶封片,拍照。
3 统计学方法
采用SPSS21.0统计软件进行分析。实验数据以—x±s表示,两组间比较采用独立样本T检验,多组间比较采用方差分析,方差齐用LSD法,不齐用Dunnetts T3。P<0.05表示差异有统计学意义。
4 结果
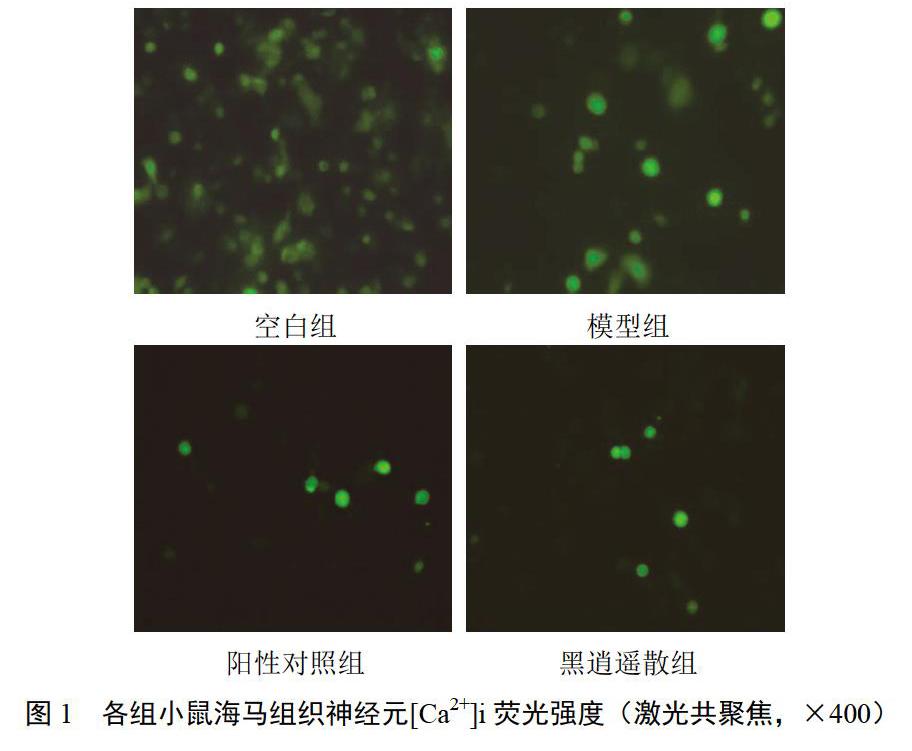
4.1 黑逍遥散对模型小鼠海马神经元[Ca2+]i相对荧光强度的影响
与空白组比较,模型组小鼠海马神经元[Ca2+]i相对荧光强度显著升高,差异有统计学意义(P<0.01);与模型组比较,各给药组小鼠海马神经元[Ca2+]i相对荧光强度显著降低,差异有统计学意义(P<0.01);与阳性对照组比较,黑逍遥散组小鼠海马神经元[Ca2+]i相对荧光强度略高,但差异无统计学意义(P>0.05)。结果见图1、表2。
4.2 黑逍遥散对模型小鼠海马组织钙调蛋白、钙调蛋白依赖性激酶Ⅱα mRNA表达的影响
与空白组比较,模型组小鼠海马组织CaM mRNA相对表达量显著升高,CaMKⅡα mRNA相对表达量显著降低,差异有统计学意义(P<0.01);与模型组比较,各给药组小鼠海马组织CaM mRNA相对表达量显著降低,CaMKⅡα mRNA相对表达量显著升高,差异有统计学意义(P<0.01);与阳性对照组比较,黑逍遥散组小鼠海马组织CaM mRNA相对表达量有所升高,CaMKⅡα mRNA相对表达量有所降低,但差异均无统计学意义(P>0.05)。结果见表3。
4.3 黑逍遥散对模型小鼠海马组织钙调蛋白、钙调蛋白依赖性激酶Ⅱα蛋白表达的影响
CaM、CaMKⅡα阳性表达多出现在神经元胞浆或核位置,呈黄色或棕黄色颗粒。与空白组比较,模型组小鼠海马组织CaM蛋白阳性表达显著增强,CaMKⅡα蛋白阳性表达显著减弱(P<0.05);与模型组比较,各给药组小鼠海马组织CaM蛋白阳性表达显著减弱,CaMKⅡα蛋白阳性表达显著增强(P<0.05,P<0.01);与阳性对照组比较,黑逍遥散组CaM蛋白阳性表达相对增强,CaMKⅡα蛋白阳性表达相对减弱,但差异无统计学意义(P>0.05)。结果见表4、图2和图3。
5 讨论
AD属中医学“呆证”“健忘”等范畴,其病位在脑,但与肝、肾等脏腑功能紊乱尤为密切。黑逍遥散出自《医宗己任编》,具有肝脾肾并调、气血精兼顾功效,通过清利脑络充养神窍能有效缓解AD患者行为异常[14],对AD模型具有调节中枢单胺类神经递质、抗氧化应激、保护神经元等防治效果[15-17]。AD发病机制十分复杂,中医复方具有多组分、多靶点治病特点,因此,基于中医学理论结合现代医学研究成果从信号转导通路着手,寻找有效的AD防治策略。
钙稳态失衡可导致AD发生的病理模式逐渐得到医学界认可并成为研究焦点[5,18-20]。前期研究表明,黑逍遥散防治AD可能与Ca2+-CaM/CaMKⅡα信号通路有关[9]。钙信号的形成与维持参与了学习和记忆机制,长时程增强作用(long term potentiation,LTP)是学习和记忆形成与维持的微观模式,而神经细胞游离Ca2+浓度是影响LTP形成的重要因素之一,其主要参与神经信号的传递和神经递质的释放[21]。CaM首先发现于细胞浆,但也存在于细胞核中,在哺乳动物中枢神经系统中非常丰富。在细胞信号转导过程中,CaM是Ca2+的受体蛋白,Ca2+所介导的信号转导大多数以Ca2+-CaM复合物的方式激活靶酶,活化的CaM经Ca2+-CaM依赖性蛋白激酶途径,具有调节神经递质的合成与释放、调节离子通道活性、细胞转运、神经轴突延伸、突触可塑性、学习记忆及基因表达等多种生理功能,影响细胞的生长和分裂[22]。
CaMKⅡα是一种主要表达于皮质、海马、杏仁核和基底神经节的丝/苏氨酸蛋白激酶,可经假底物区的自动磷酸化进行调节。CaM缺乏时,假底物区和CaM结合掩蔽了催化域,阻止底物与ATP结合而使激酶处于自身抑制狀态;当细胞内Ca2+浓度升高,促使Ca2+-CaM与激酶的CaM结合区相互作用引起构象改变,自身抑制区失活,激活CaMKⅡ与Mg2+/ATP结合而起催化作用[23]。CaMKⅡα是Ca2+的重要靶酶,在脑组织含量最高,通过磷酸化许多底物蛋白来传导Ca2+信号,神经元的可塑性、神经递质的合成和释放、LTP和细胞骨架修饰等都起着重要作用,可定位于神经元胞浆、轴突、树突及突触的前后膜[24]。CaMKⅡ可引起CREB磷酸化,从而调节海马区基因转录,通过下游基因的表达加强海马区LTP的形成[25]。
APP/PS双转基因小鼠模型已广泛用于实验研究,该模型小鼠优势在于将APPswe和PS1dE9这2个易感基因结合在一起,弥补了单一突变基因所引起的病理改变相对单一、病理变化时间相对较长的缺陷。有研究表明,该模型小鼠3月龄时在其大脑内未检测到明显老年斑,但已存在记忆缺陷的表现,而到4~5月龄时其大脑皮层开始出现老年斑[26]。上述研究结果表明,这种小鼠模型模拟了人类早发型AD的部分疾病特征,可用于预防或治疗AD的药理实验研究。虽然该模型能模拟人类AD患者年龄依赖性老年斑的形成、胶质细胞增生和突触减少等部分神经病理特征,并表现出与AD临床相似的行为学障碍,也有助于AD的病因、发病机制及治疗策略等相关研究,但其未见神经纤维缠结这一AD特征性病理改变,故在应用过程中仍具有一定的局限性[27]。
前期研究显示,未治疗的7月龄AD模型小鼠已经出现明显行为学异常,而经黑逍遥散干预后小鼠学习和记忆能力显著提升[28]。本研究结果表明,黑逍遥散能明显降低AD模型小鼠海马神经元Ca2+浓度,下调海马区CaM基因和蛋白表达,上调CaMKⅡα基因和蛋白表达,因此推断黑逍遥散可能是通过调节Ca2+-CaM/CaMKⅡα通路关键因子的表达而发挥防治AD作用的,具体机制还需今后深入研究。
参考文献:
[1] CHEN Y G. Research progress in the pathogenesis of Alzheimers disease[J]. Journal of Capital Medical University,2018,131(13):1618-1624.
[2] JIA J, WEI C, CHEN S, et al. The cost of Alzheimer's disease in China and re-estimation of costs worldwide (Article)[J]. Alzheimers and Dementia,2018,14(4):483-491.
[3] LIANG J Y, DON KULASIRI. What can computational modeling offer for studying the Ca2+ dysregulation in Alzheimers disease:current research and future directions [J]. Neural Regeneration Research, 2018,13(7):1156-1158.
[4] 詹向红,吕茹,王慧霞,等.长期负性情绪应激对大鼠学习记忆及海马Ca2+/CaM-CaMKⅡ-CREB信号通路的影响[J].中国老年学杂志,2019, 39(4):886-889.
[5] NODA M. Dysfunction of glutamate receptors in microglia may cause neurodegeneration[J]. Curr Alzheimer Res,2016,13(4):381-386.
[6] 李庆伟,张撼,逄越.钙调蛋白结构、性质及其细胞生物学功能的研究进展[J].辽宁师范大学学报(自然科学版),2017,40(1):74-82.
[7] MIN D Y, MAO X Y, WU K C, et al. Donepezil attenuates hippocampal neuronal damage and cognitive deficits after global cerebral ischemia in gerbils[J]. Neuroscience Letters,2012,510(1):29-33.
[8] 鐘强.CaMKⅡ蛋白的结构与功能关系研究[D].武汉:华中农业大学, 2010.
[9] 邓健男.黑逍遥散对阿尔茨海默病模型大鼠认知记忆及药靶部位的蛋白影响[D].兰州:甘肃中医学院,2014.
[10] 刘佳楠.黑逍遥散对APP/PS1双转基因小鼠海马区内Aβ清除机制的研究[D].兰州:甘肃中医药大学,2018.
[11] 罗红波,石向群,张志强,等.Aβ诱发细胞钙失衡中蛋白激酶A的表达变化及二苯乙烯苷的影响[J].中国现代医学杂志,2014,24(1):20-24.
[12] 武美娜,李新毅,白玮,等.激光共聚焦扫描显微镜技术在大鼠皮层神经元细胞内钙离子浓度动态测定中的应用[J].中国药物与临床,2008, 8(7):530-532,585.
[13] 黄娅林,赵鹏,程介士.共聚焦激光扫描显微镜技术在研究大鼠海马神经元胞内钙超载中的应用[J].复旦学报(医学版),2005,32(1):98- 100,104.
[14] 吴红彦,王虎平,王彩霞.黑逍遥散对老年性痴呆的防治作用及其机制研究[J].时珍国医国药,2011,22(4):912-913.
[15] 李海龙,王虎平,刘建鸿,等.黑逍遥散对Aβ25-35诱导AD大鼠模型脑组织和血清SOD,GSH-Px及MDA的影响[J].中国实验方剂学杂志, 2013,19(21):186-189.
[16] 吴红彦,李海龙,顾静,等.黑逍遥散对Aβ25-35诱导AD模型大鼠脑组织神经递质及海马病理改变的影响[J].中国老年学杂志,2015, 35(16):4417-4420.
[17] 吴红彦,李海龙,顾静,等.黑逍遥散对阿尔茨海默病大鼠海马基因表达谱的影响[J].中国中西医结合杂志,2016,36(11):1345-1351.
[18] REESE L C, LAEZZA F, WOLTJER R, et al. Dysregulated phosphorylation of Ca2+/calmodulin-dependent protein kinase Ⅱ α in the hippocampus of subjects with mild cognitive impairment and Alzheimers disease[J]. Journal of Neurochemistry,2011, 119(4):791-804.
[19] GANT J C, CHEN K C, KADISH I, et al. Reversal of aging-related neuronal Ca2+ dysregulation and cognitive impairment by delivery of a transgene encoding FK506-binding protein 12.6/1b to the hippocampus[J]. Journal of Neuroscience,2015,35(30):10878-10887.
[20] CASCELLA R, EVANGELISTI E, BIGI A, et al. Soluble oligomers require a ganglioside to trigger neuronal calcium overload[J]. Journal of Alzheimers Disease Jad,2017,60(3):1-16.
[21] 王冰.丁苯酞对血管性痴呆小鼠海马神经元谷氨酸受体及钙信号转导机制的作用研究[D].石家庄:河北医科大学,2008.
[22] 伍艺灵.钙调蛋白依赖性蛋白激酶Ⅱ通路介导石菖蒲有效成分抗神经细胞凋亡[D].广州:广州中医药大学,2011.
[23] 赵岚,陆融,姚智.Ca2+/钙调蛋白依赖性蛋白激酶在细胞增殖中的作用[J].细胞生物学杂志,2007,29(3):331-335.
[24] 王月菊,陈贵海,周江宁,等.阿尔茨海默病海马CaMKⅡα神经元表达的变化[J].安徽医药,2007,11(1):64-66.
[25] 王莹,王晓冬,王彩霞,等.七氟醚对老龄大鼠海马CaMKⅡ/CREB信号通路的影响[J].中华麻醉学杂志,2017,37(2):163-166.
[26] 宗园媛,王晓映,王海林,等.APPPS双转基因阿尔茨海默病小鼠模型的老年斑及行为学动态分析[J].中国比较医学杂志,2008,18(9):8-11.
[27] 石辉,原丽,张军,等.APPswe/PS1dE9双转基因阿尔茨海默病模型小鼠的行为学及病理学特征研究[J].神经解剖学杂志,2016,32(4):499-506.
[28] 吴红彦,马春林,崔淑梅,等.黑逍遥散对AD模型小鼠海马区Aβ1-42, GSK-3β,NEP,IDE表达的影响[J].中国实验方剂学杂志,2019,25(5):36-42.
(收稿日期:2019-04-22)
(修回日期:2019-05-14;编辑:华强)
