四氯化钛精制尾气的综合利用研究
2019-11-15刘邦煜刘涛泽
刘邦煜,刘涛泽,叶 春
(1.贵州师范学院地理与资源学院,贵州贵阳550018;2.中国科学院地球化学研究所,环境地球化学国家重点实验室)
TiCl4是钛及其化合物生产过程中的重要中间产品,是生产海绵钛和氯化法钛白的主要原料[1]。TiCl4的工业生产通常是利用高钛渣、金红石等富钛原料经过沸腾或熔盐氯化制得粗TiCl4再精制而成。中国的粗TiCl4精制一般采用3段流程:一段精馏产生低沸点尾气;二段精馏排出高沸点金属氯化物釜残液;三段采用铜丝除钒。3个精制工段都会产生含氯及氯化物的高腐蚀性废料,若直接排放,环境污染严重,同时也会造成其中所含Ti、Si、Cu、V等有价资源的流失浪费[2]。目前,针对TiCl4精制蒸馏釜残液以及铜丝除钒废渣的资源化利用研究已见少量文献报道,并部分应用于工业生产,而其中排放量最大的精制尾气还未见可靠技术方法进行回收利用[3-5]。
TiCl4精制尾气主要成分是TiCl4和SiCl4,都属于高毒性物质,在潮湿空气中水解生成TiO2、SiO2气溶胶分散体和强腐蚀性氯化氢气体,企业环保压力巨大。因此,寻求TiCl4精制尾气科学合理的处置方法具有十分重要的现实意义。TiCl4精制尾气物质组成的复杂性一直是制约其综合利用的难点所在,笔者对TiCl4精制尾气的来源及物化特性做了系统研究,分析了精制尾气的成分组成及其特性,提出采用精馏法从TiCl4精制尾气中分离富集回收TiCl4和SiCl4的方案,并通过后续的精馏实验确定了其可靠性。
1 精制尾气的来源
中国的钛资源主要是钛铁矿,钛铁矿经过冶炼制得高钛渣的杂质成分较多,主要有 Si、Fe、Ca、Mg、Al、Mn、S 等元素的氧化物[6-7]。 原料高钛渣和石油焦进行高温氯化时,几乎能使物料中所有的金属和非金属元素转化成氯化物和相关衍生物。因此,粗TiCl4的化学成分十分复杂,主要的杂质有SiCl4、AlCl3、FeCl3、VOCl3、Cl2等(见表 1)。 这些杂质成分按其相态及溶解特性可分为气体、液体和固体;按杂质与TiCl4沸点的差异可分为高沸点杂质(如 FeCl3)、低沸点杂质(如 SiCl4)、沸点相近杂质(如 VOCl3)(见表2)。这些杂质在粗TiCl4中的含量随着氯化时所用原料和工艺条件的不同而异。上述杂质对于生产海绵钛或钛白而言都是有害杂质,必须通过精制去除。

4表1 某钛厂粗TiCl 主要化学成分 %

表2 粗TiCl4中主要杂质分类及沸点
中国粗TiCl4精制一般采用3段流程:一段精馏操作中,SiCl4、SCl4、CCl4等低沸点组分会以尾气的形式排出;二段精馏中,AlCl3、FeCl3、MnCl2等高沸点金属氯化物会富集到蒸馏釜残液中排出;三段除钒工艺多采用铜丝除钒,将铜丝球装入除钒塔中,使钒杂质沉淀在铜丝表面,定期取出铜丝球净化。在一段精馏中,99%以上的低沸点杂质会被除去,受某些操作因素的影响,这些低沸点馏分排出时会夹带部分TiCl4。据估算,一个年产海绵钛8000 t的钛企业,每年会排放100 t以上的SiCl4和近400 t的TiCl4毒性气体,环境污染严重。
2 精制尾气成分分析及综合利用思路
根据TiCl4精制尾气产生的原理,分析其成分组成及理化特性,探索实现精制尾气综合利用的可行途径。 粗 TiCl4中低沸点杂质如 COS、Cl2、O2、CO2、COCl2等,由于其易挥发性和随着料液温度升高溶解度下降的特点,在粗TiCl4精馏提纯过程中很容易逸出分离,通过尾气排出。粗TiCl4中沸点相近杂质如 CCl4、VOCl3、SOCl2、SCl2等,采用多塔板高效精馏,强化回流作业,大部分会在精制尾气中富集。粗TiCl4中的高沸点杂质在常温下为固态,几乎不溶于TiCl4,可在隔板除尘器灰筒中除去。少量极细颗粒在TiCl4液中形成胶溶液,会在精馏过程中残留于釜底,不进入精制尾气中。综上所述,TiCl4精制尾气冷凝液中的物质组成应包括粗TiCl4中的低沸点组分和沸点相近组分(见表3),以TiCl4和SiCl4为主。

表3 TiCl4精制尾气的物质组成
对中国某钛厂TiCl4精制尾气冷凝液做化学分析,SiCl4质量分数为11.6%~15.2%、TiCl4质量分数为37%~45%。要实现TiCl4精制尾气的资源化利用,关键是其中TiCl4和SiCl4的分离富集。SiCl4沸点为57.0℃,TiCl4沸点为 136.4℃,与 TiCl4相比 SiCl4属于易挥发组分,相平衡时其在气相中的分子浓度大于液相中的分子浓度,鉴于此可利用SiCl4和TiCl4沸点的差异,采用高效精馏法进行分离富集回收。精馏操作时,精馏塔底的蒸汽上升,由于温度递降,挥发性小的TiCl4逐渐被冷凝,蒸汽中易挥发的SiCl4浓度增加;相反,塔顶向下流的液相,由于温度递增,挥发性差的TiCl4浓度增加,这样使得TiCl4逐渐富集于塔底,SiCl4以及 O2、HCl、Cl2、SCl4等低沸点物质以蒸汽的形式馏出,可同时实现TiCl4和SiCl4的富集回收。 TiCl4精制尾气中所含的 CS2、CCl4、SOCl2、SCl2、SO2Cl4、POCl3、VOCl3等液相杂质,可以和 SiCl4、TiCl4按任意比例互溶,且沸点相差不大,这部分杂质的分离较难,但其含量很低,对于富集回收粗TiCl4液的影响不大。
3 实验部分
3.1 实验原料
实验原料是中国某钛厂回收的TiCl4精制尾气冷凝液,呈橘红色浑浊状,开瓶后有强烈窒息性气体喷出,经化学分析,其TiCl4质量分数约为45%、SiCl4质量分数约为16%。
3.2 实验装置
实验采用玻璃填充塔精馏分离TiCl4精制尾气冷凝液中的TiCl4和SiCl4。精馏塔釜的体积为3 L,釜底采用调温电加热,釜壁采用电热丝加热,玻璃棉保温控制;精馏塔柱的尺寸为D 25 mm×1300 mm,带玻璃夹套;填料为φ2.5 mm×2.5 mm的θ形不锈钢压延环,比表面积为2000 m2/m3,空隙率为0.92,填充高度为1000 mm;精馏塔顶设置冷凝器及5225型电磁控制式分馏头,塔壁由带循环泵的恒温水设备保温,冷却系统采用CDSB型制冷机,用NaCl溶液作冷却液。
3.3 实验过程及结果
实验采用常规间歇精馏分离。取2000 mL粗TiCl4精制尾气冷凝液置于精馏釜中,加热至料液沸腾。恒温水温度控制为55~57℃,冷却液温度控制为1~3℃。全回流1.5 h后将回流比调节为12∶1。当塔顶浓度达到稳定后,按设定的回流比和塔顶温度切割各馏分。实验取样记录见表4。对收集的各馏分做了化学分析,中段馏分中SiCl4质量分数达到95%,可用作制备高纯SiCl4的原料;精馏釜液中TiCl4质量分数达到96.5%、SiCl4质量分数仅为0.2%,可直接返回企业TiCl4精制流程使用。采用精馏法处理TiCl4精制尾气冷凝液,实现了SiCl4和TiCl4的分离富集回收,TiCl4回收率达到90%以上。
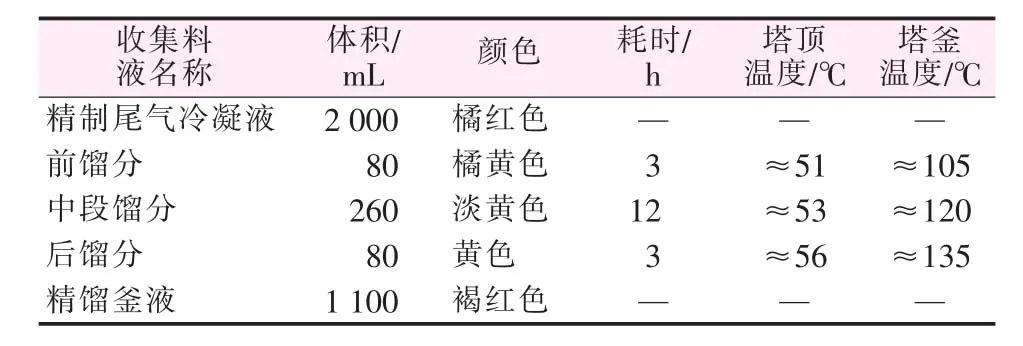
表4 实验取样记录
3.4 实验分析
精馏塔运行初期排出的尾气量较多,收集到的低沸点馏分很少,说明混溶于精制尾气冷凝液中的N2、HCl、COS、Cl2等在此过程大量排出,根据表 4 料液平衡计算出现480 mL减少量,主要是这些低沸点混溶杂质赋存量较大。前馏分呈橘黄色,挥发性极强,分析带色物可能是SCl4(黄棕色,沸点为30.0℃)、SCl2(暗红色,沸点为 59.0 ℃)、SO2Cl4(黄色,沸点为69.1℃)等。当塔顶温度上升到53℃左右时,馏出液颜色变淡,估计低沸点馏分已基本蒸完。当塔顶温度上升到56℃左右时,馏出液颜色又变深,估计是VOCl3(黄色,沸点为 127.2 ℃)、S2Cl2(橙黄色,沸点为138℃)等沸点较高的带色物开始馏出的缘故。针对那些和TiCl4互溶且沸点相近的液体杂质,采用在精馏柱和精馏釜中加入不锈钢丝或钛丝来促进它们的分离。这是因为某些杂质稳定性不高,当有金属或金属化合物存在时,在加热条件下会转化为金属硫化物、高沸点金属氯化物、单质硫等有利于分离的新生相, 如:S2Cl2+3Me→MeCl2+2MeS,2SOCl2+2Me→2MeCl2+SO2+S,使反应-精馏同时进行,实现精馏塔的双效功能,仅通过一次精馏就可以使釜液中TiCl4质量分数达到96.5%,回收率达到90%以上。
4 结论
TiCl4精制尾气是多种物质并存的共生相,包括粗TiCl4中的气相组分和液相组分,以TiCl4和SiCl4为主,其余成分含量极低。利用精密分馏的工艺装置与控温分馏的技术路线能够实现TiCl4精制尾气中TiCl4和SiCl4的分离富集,回收的中段馏分中SiCl4质量分数达到95%,可作为高纯SiCl4的制备原料;精馏釜液中TiCl4质量分数达到96.5%,可直接返回企业TiCl4精制流程使用,TiCl4回收率达到90%以上。该工艺为海绵钛以及钛白粉等氯化法TiCl4生产领域中精制尾气的综合利用开辟了一条新途径,具有显著的经济环境效益。
