发动蛋白在EMCV感染Hela细胞中作用的研究
2019-11-14刘翊忠李琼毅
刘 杨,刘翊忠,李琼毅
(1.西北民族大学 生物医学研究中心,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
EMCV是微RNA病毒科心病毒属的病毒。1945年首次从一只黑猩猩的体内分离得到,随后在多国被相继报道[1]。怀孕母猪感染EMCV之后可导致木乃伊胎和繁殖机能障碍,临近分娩时可发生流产、木乃伊胎增加和小猪离乳前死亡。仔猪感染致死,哺乳小猪致死率甚至可达到100%[2]。较大猪和成猪通常不显性感染,成猪偶尔发生死亡。人感染时常呈现散发,患者可表现间歇性头痛、颈项强直,呕吐和发热[3]。
该病毒可通过多种途径感染动物和人类,但具体的感染机制目前尚未完全清楚,有报道称包括EMCV在内的心脏病毒可能经由内吞途径感染宿主细胞[4]。发动蛋白可以参与多种内吞途径,为大多数内吞途径提供动力[5],包括经典的网格蛋白介导的内吞途径,在非网格蛋白介导的内吞途径中,目前发现只有小窝蛋白依赖的内吞途径需要发动蛋白的参与。近年来,越来越多的研究提示发动蛋白依赖型内吞途径可参与多种病毒感染宿主细胞,如猿猴空泡病毒40、冠状病毒和口蹄疫病毒等[6]。
1 材料与方法
1.1 细胞及毒株
人宫颈癌细胞(Hela)、仓鼠肾细胞(BHK-21)、脑心肌炎病毒(EMCV)由甘肃省兰州市西北民族大学生物医学研究中心提供。
1.2 主要仪器与试剂
凝胶成像系统(GE);酶标仪(Thermo Fisher);Proliferation细胞活力检测试剂盒购自Gromega公司;鼠源VP1抗体由南京农业大学动物疫病诊断与免疫重点开放实验室提供;抑制剂Dynasore 购自Abcam公司,MitMab购自Tocris公司。
1.3 特异性抑制剂浓度筛选
参考已有文献将发动蛋白特异性抑制剂Dynasore和MitMab配置成含FBS的不同浓度工作液,然后作用于Hela细胞24 h。24 h后,按照Proliferation细胞活力检测试剂盒说明书进行细胞活力检测,重复三次,筛选两种抑制剂适宜工作浓度。
1.4 特异性抑制剂试验
1.4.1 特异性抑制剂作用下EMCV攻毒 配置含FBS的适宜浓度的Dynasore和MitMab工作液,作用于Hela细胞1h,1h后进行EMCV攻毒,接毒量为0.1MOI,病毒体积=细胞数× 0.1MOI/0.7 ×TCID50[7]。接毒1 h后弃去毒液,换为Dynasore和MitMab的细胞维持液。于感染后24 h收集细胞和上清。
1.4.2 Western bolt检测Hela细胞中VP1含量 收集Hela细胞,RIPA裂解,产物经SDS-PAGE电泳后转印至PVDF膜。脱脂奶粉封闭1 h,加入鼠抗VP1一抗(1:5000稀释),室温孵育2 h,PBST洗膜5次,每次5 min,再加入HRP标记的山羊抗鼠二抗,室温孵育1 h,PBST洗膜5次,ECL显色。
1.4.3 病毒滴度检测 将收集到的上清10倍梯度稀释(10-1~10-8)接种于96孔板的BHK-21细胞中,37℃恒温培养箱中孵育6天,统计病毒感染阳性细胞孔的数量,Karber法计算病毒滴度。
1.4.4 病毒拷贝数检测 实时荧光定量测定上清的病毒拷贝数,TaqMan 实时荧光定量PCR参考本实验室已建立的方法。
2 结果
2.1 特异性抑制剂浓度筛选
将Hela细胞在含有不同浓度特异性抑制剂Dynasore和MitMab培养基中培养24 h后测定细胞活力。确定Dynasore的适宜工作浓度:25 μM和50μM(图1A),MitMab的适宜工作浓度2.5 μm 和5.0 μM(图1B)。

图 1 细胞活力检测
2.2 特异性抑制剂作用下EMCV攻毒试验
2.2.1 Hela细胞中VP1含量检测结果 将Dynasore和MitMab处理过的Hela细胞进行EMCV攻毒试验,收集细胞检测VP1含量,对检测结果进行灰度分析。结果显示经25 μM和50 μM的Dynasore作用后VP1含量显著下降(图2AB),经过2.5 μM MitMab作用后VP1下降不明显(图2CD),经过5.0 μM MitMab作用后VP1含量下降显著(图2CD)。

图 2 VP1蛋白含量检测
2.2.2 病毒滴度检测结果 将Dynasore和MitMab处理过的Hela细胞进行EMCV攻毒试验,收集上清进行病毒滴度检测。结果显示经过25 μM和50 μM的Dynasore作用后病毒滴度均下降明显(图3A),经2.5 μM和5.0 μM MitMab处理后病毒滴度同样显著下降(图3B)。
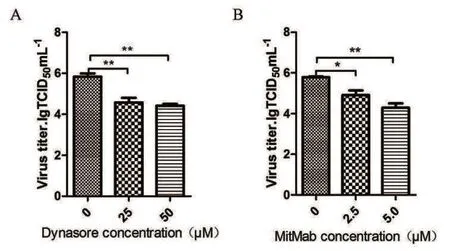
图3 病毒滴度检测结果
2.2.3 病毒拷贝数检测检测结果 上清病毒拷贝数检测结果显示经过25 μM和50 μM Dynasore作用后病毒拷贝数下降很明显(图4A)。经2.5 μM和5.0 μM MitMab处理后病毒拷贝数同样下降明显(图4B)。

图 4 病毒拷贝数检测结果
3 分析与讨论
选取对细胞活力无影响的抑制剂浓度作用于Hela细胞后进行EMCV攻毒,接毒24 h后收集细胞检测VP1含量,收集上清液检测病毒拷贝数和病毒滴度,分别从蛋白和基因等水平检测病毒感染状况。蛋白、病毒拷贝数和病毒滴度检测结果显示经抑制剂Dynasore和MitMab作用后EMCV感染Hela细胞受到抑制,虽然三种检测结果中实验组和对照组之间的差异显著性不完全相同,但大体的趋势一致;都可提示发动蛋白依赖型内吞途径抑制剂Dynasore和MitMab可以抑制病毒感染Hela细胞,证明了EMCV感染Hela细胞依赖于发动蛋白发挥作用。
本试验初步探索了发动蛋白在EMCV感染Hela细胞中的作用,证明了发动蛋白参与EMCV感染Hela细胞。这一发现大大降低了研究EMCV通过内吞途径感染宿主细胞的范围,可以有针对性的研究网格蛋白和小窝蛋白介导的内吞途径。另外,这一发现为使用Dynasore和MitMab预防和治疗EMCV以及其他通过发动蛋白依赖型内吞途径感染人与动物的病毒提供了一个可行的思路。随着发动蛋白参与病毒感染这一机制研究的不断深入,有可能从发动蛋白着手,为防治人与动物的脑心肌炎提供更优的方法。
