2019年7月美国和欧盟新批准药物概述
2019-11-14孙友松
孙友松
(上海递鸽医药科技有限公司,上海 201210)
1 2019年7月美国FDA新批准药物
2019年7月,美国FDA共批准9个新药,包括2个全球首次批准的新分子实体[塞利尼索(selinexor,1)、达罗他胺(darolutamide,2)]、1个美国首次批准的新分子实体[麦芽酚铁(ferric maltol)]、2个新生物类似药、1个新复方、2个新剂型和1个新增适应证药物(见表1)。
1.1 塞利尼索
塞利尼索是一种XPO1抑制剂,是首款也是唯一一款被美国FDA批准的核输出抑制剂,由Karyopharm Therapeutics公司研发,研发代号为KPT-330,商品名为Xpovio®。2019年7月3日,美国FDA加速批准塞利尼索与低剂量地塞米松联用治疗四线治疗后复发难治性多发性骨髓瘤[1]。2018年5月29日,德琪医药与Karyopharm Therapeutics公司签署战略合作协议,共同开发和商业化包括塞利尼索在内的4种口服创新药物。
塞利尼索此次获得美国FDA批准基于1项单臂、开放标签、多中心Ⅱb期临床研究(STORM研究,NCT02336815)结果。该研究结果显示,83位患者亚组中观察到25.3%的总体反应率具有临床意义,这也是FDA加速批准的基础,且其预示着患者将获得临床受益[2]。
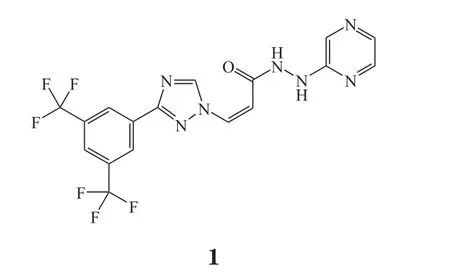
1.2 达罗他胺
达罗他胺是一种雄激素受体拮抗剂,由拜耳公司和Orion Corporation公司合作研发,研发代号为ODM-201,商品名为Nubeqa®。2019年7月30日,美国FDA批准达罗他胺联合雄激素剥夺疗法(androgen-deprivation therapy,ADT)用于治疗非转移性去势抵抗性前列腺癌(NM-CRPC)[3]。达罗他胺获得美国FDA优先审评资格,此次批准比美国FDA预定审评期限提前了3个月。
达罗他胺此次获得美国FDA批准基于1项随机、多中心、安慰剂对照、双盲Ⅲ期临床研究(ARAMIS研究, NCT02200614)结果,共招募1 509例NM-CRPC受试者,随机分为达罗他胺+ADT治疗组和安慰剂+ADT对照组。该研究结果显示,治疗组中位无转移生存期(metastasis-free survival,MFS)为40.4个月,对照组为18.4个月(P<0.000 1),达到MFS显著改善的临床主要终点[4]。
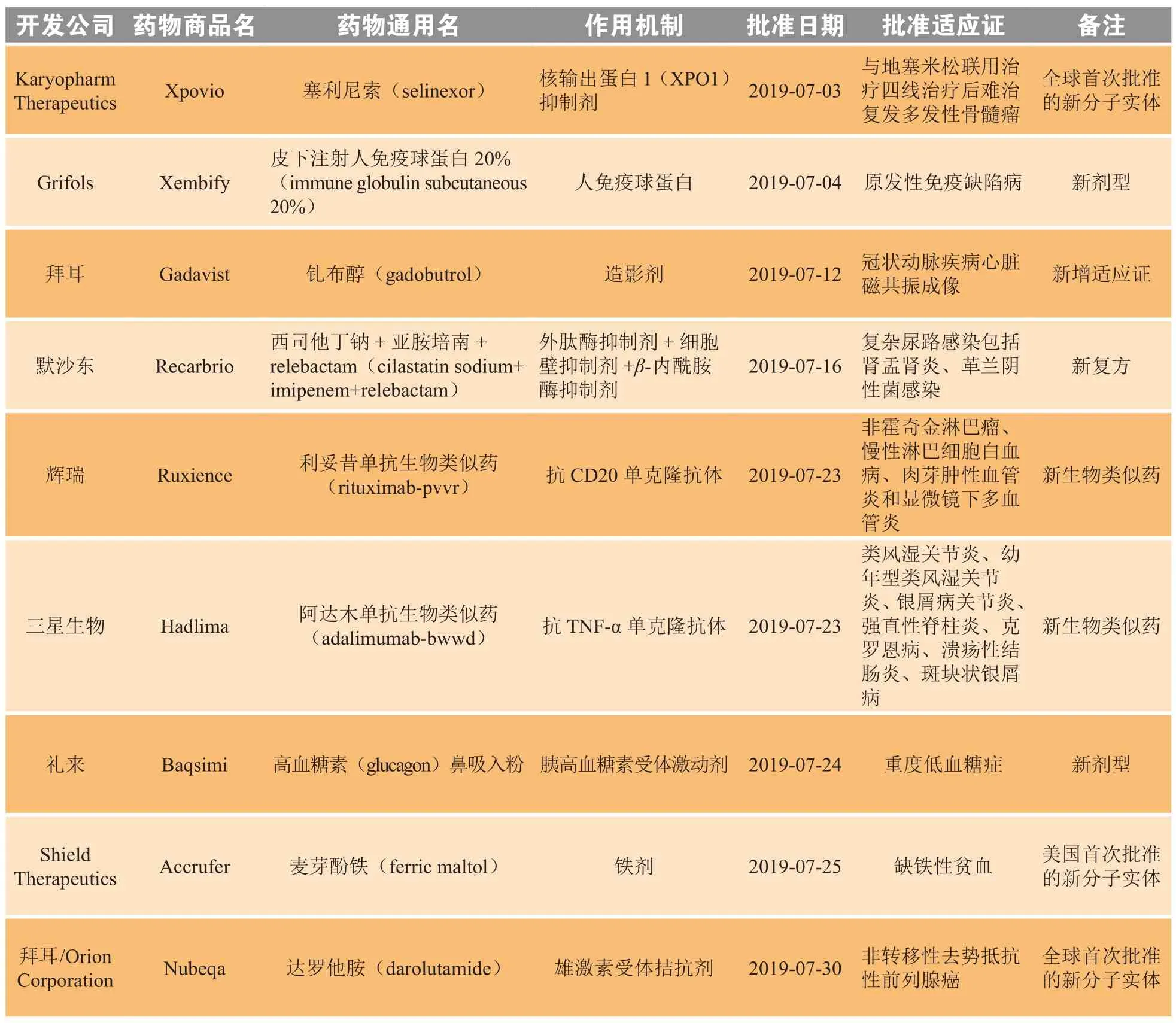
表1 2019年7月美国FDA新批准药物Table 1 New drugs approved by FDA in July 2019
2 2019年7月欧盟新批准药物
2019年7月,欧盟委员会(European Commission,EC)共批准5个新药,包括1个欧盟首次批准的新生物制品(ravulizumab)、2个新复方和2个新增适应证药物(见表2)。
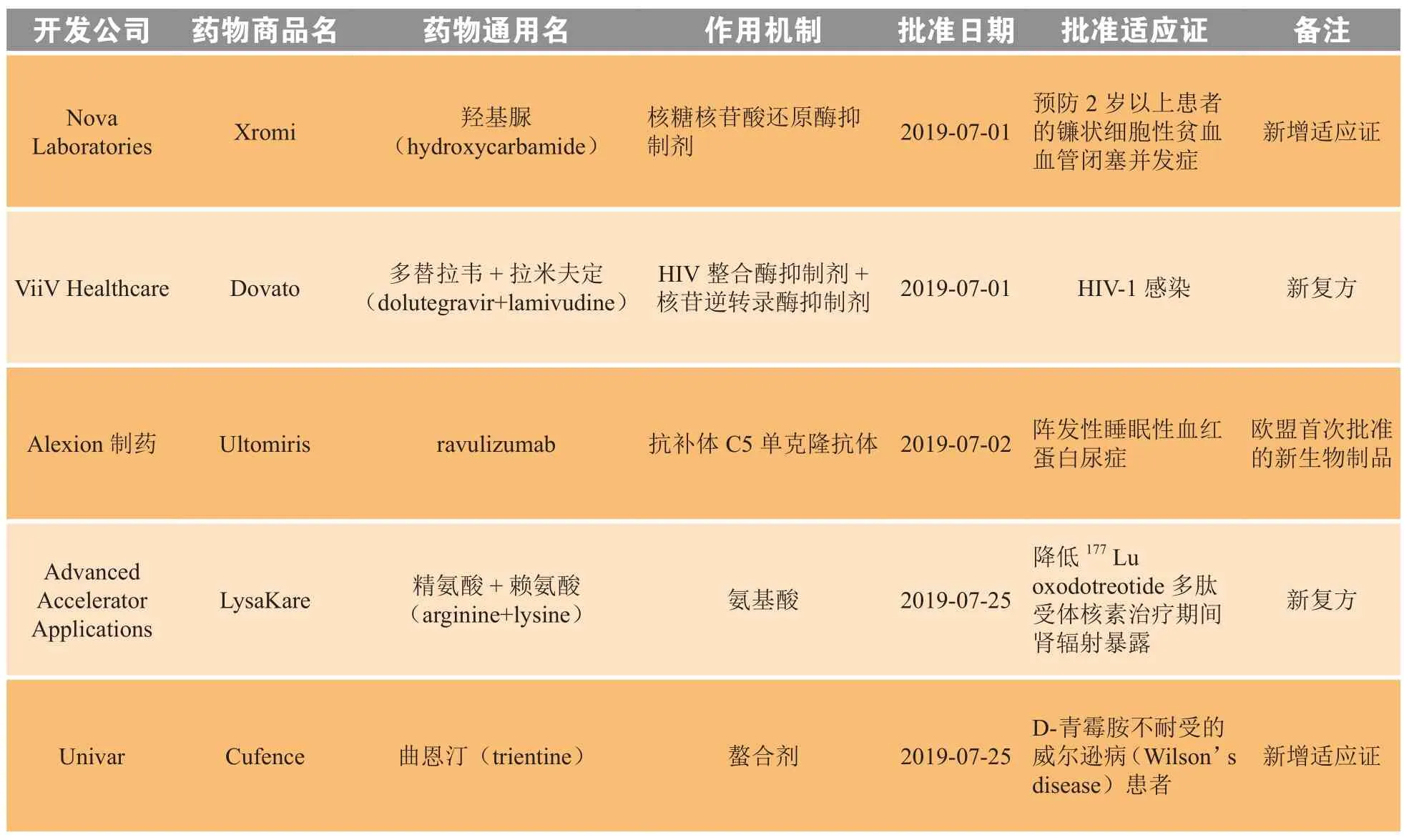
表2 2019年7月欧盟新批准药物Table 2 New drugs approved by European Commission in July 2019
