脑缺血再灌注与神经保护剂联合治疗脑卒中的研究进展
2019-11-14孙俊姜其慧张陆勇庞涛
孙俊,姜其慧,张陆勇,庞涛
(中国药科大学药物科学研究院 新药筛选中心 江苏省新药筛选重点实验室,江苏 南京 210009)
急性缺血性脑卒中目前仍是全球范围内导致患该疾病患者突发死亡的主要病因,也是成年人身体残疾的主要原因[1]。对脑缺血患者在发病初期应给予积极的治疗,可阻止脑缺血的进一步加重,减轻对脑组织的损伤。1995年静脉溶栓疗法最初引入时进展缓慢,随后的血管内血栓切除术在大血管闭塞(large vessel occlusion,LVO)治疗中取得了巨大进展[2]。但即使在高度有效的再灌注治疗后,许多患者仍存在严重残疾、身体各方面的功能独立性较差等问题。神经保护剂可以减小缺血后脑梗死体积而不引发出血,保护大脑免受再灌注损伤[3]。目前神经保护剂有2种使用办法:一种是在缺血性脑卒中发作早期给予治疗,以潜在地延长静脉或动脉内的治疗时间窗;另一种是在部分或完全再灌注期间或之后使用,以减少再灌注的损伤,进而降低脑卒中患者在治疗后残疾的可能[4]。本文简要概括近年来对于神经保护剂的研究进展,分析了目前神经保护剂研究应用失败的原因,讨论神经保护剂临床前和临床试验的研究方法,以期未来其能够在脑卒中治疗中发挥更大的作用。
1 脑卒中再灌注治疗
1.1 脑卒中再灌注治疗最新进展
既往研究表明,急性缺血性脑卒中患者缺血核心是由不可逆转的梗死组织组成,周围是半暗带即功能受损但可挽救的组织[5]。急性脑卒中后,随着时间的推移,缺血核心可能扩展到半暗带,进一步发生梗死,但如果缺血组织能够得到较早、有效的再灌注,这个过程可能会中止。根据患者侧支血流容量和缺血耐受性的差异,缺血核心的扩大在不同的个体间可以按不同的速率进行。因此,侧支血流较差、LVO后缺血耐受性较低的患者,在发病后不久即出现较大的缺血中心,这些患者被称为快进展患者[6],这些患者的临床结果往往更糟,症状更严重,脑梗死体积更大,恶性脑水肿和出血转化的风险更高。相反,在卒中发生LVO后几天内,还具有良好的侧支血流和缺血耐受性的患者往往出现较小的缺血核心,治疗效果更理想,这些患者为慢进展患者[7],他们在再灌注治疗后通常会有相对较好的临床结果。
几个缺血性脑卒中治疗的随机临床试验已证实,LVO再灌注可以明显改善脑缺血严重患者的临床结果,且这些实验证实了一个明显趋势,即更快和更完整的动脉再灌注与较好的治疗效果呈正相关(见表1)。
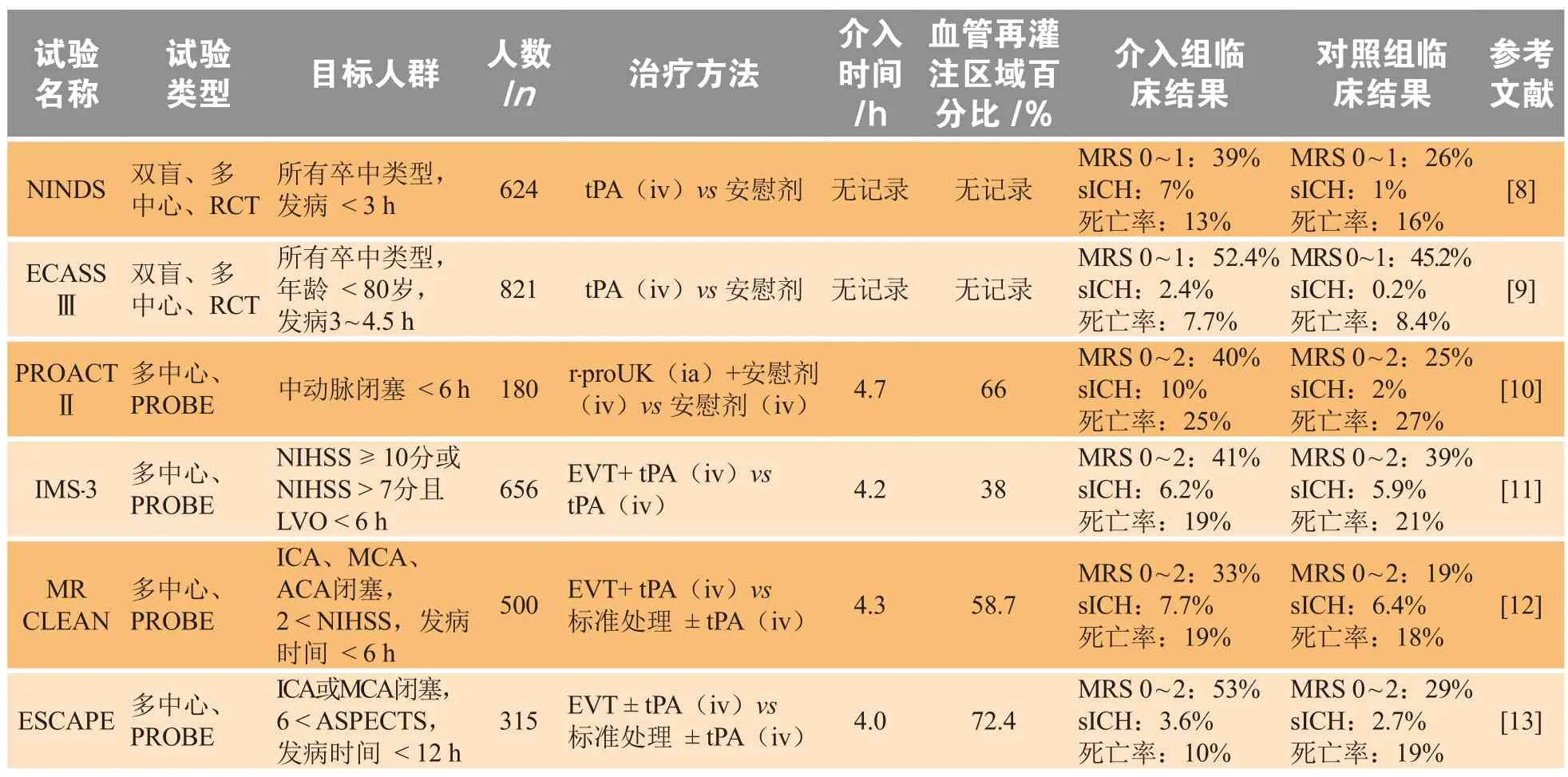
表1 脑卒中再灌注治疗进展的关键临床试验Figure 1 Key clinical trials in the development of stroke reperfusion therapy
1.2 脑卒中再灌注治疗的缺陷
尽管再灌注治疗已成功实现标准化,但只能在一定程度上改善患者的临床症状。在静脉注射tPA联合血管内血栓切除术的标准干预下,仍有大量LVO患者出现严重残疾,且可能伴随溶栓后颅内出血等并发症。2015年对脑卒中血管内治疗成功的5项试验进行meta分析发现,18.5% ~ 32.5%的卒中患者在发病后3 ~ 8 h内可获得成功再灌注,但在90 d内仍有严重的残疾或死亡发生[14]。在延迟再灌注治疗的临床半暗带分诊觉醒卒中及迟发型卒中患者应用Trevo装置行取栓治疗(DAWN)研究和影像评估筛选缺血性卒中患者血管内治疗研究3(DEFUSE 3)试验中,分别有84%和76%的患者获得了成功再灌注,但只有49%和45%的患者实现了长期自主生活功能独立[15-16]。这些数据表明,部分卒中患者对最初成功的再灌注反应较差,即单独的再灌注治疗不能有效地改善其临床结果。
1.3 脑卒中再灌注治疗的改善
虽然脑卒中再灌注治疗在理想情况下是有效的,但其在现实中的有效性仍然不佳,因为大多数脑卒中患者缺乏及时的静脉溶栓及血管内治疗。一般人群中25%的急性缺血性脑卒中是LVO造成[17],而大部分是远端动脉分支闭塞或小血管闭塞的非LVO患者,由于他们缺乏及时的再灌注治疗,这些患者临床症状出现时间会延迟超过4.5 h,这一现状表明再灌注治疗应辅助神经保护剂,以保护缺血半暗带脑组织,延迟组织梗死,缓解缺血后的细胞损害,防止出血转化,以期有效延长再灌注治疗的时间窗。
2 治疗缺血性脑卒中的神经保护剂
虽然静脉溶栓及机械取栓疗法是目前治疗早期缺血性脑卒中的主要方法,但其时间窗及适用范围均较窄(静脉溶栓治疗适应证:缺血性脑卒中患者的年龄80岁且发病时间4.5 h,或年龄 >80岁且发病时间3 h;机械取栓治疗适应证:缺血性脑卒中患者的发病时间6 h)[18]。研究表明,缺血后神经保护治疗可以显著延长静脉溶栓治疗的时间窗[19]。神经保护治疗的主要作用方式是缓解缺血后的细胞损害,能够有效延长治疗时间窗。常用的神经细胞保护剂有钙离子通道阻滞剂、兴奋性氨基酸受体拮抗药、抗氧化剂、抗炎免疫调节剂、凋亡抑制剂及其他类。
2.1 钙离子通道阻滞剂
脑卒中发生后,三磷酸腺苷(adenosine triphosphate,ATP)能量耗竭,导致钠-钾ATP酶活性降低,细胞内外K+浓度改变,细胞膜发生去极化,Na+-Ca2+交换体使得细胞外Ca2+流入细胞内,细胞内贮存的Ca2+超载。同时,脑卒中后激活N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid receptor, NMDA)受体,使得电压门控Ca2+通道开放,细胞外的Ca2+流入细胞内,进一步增加Ca2+超载。过量的Ca2+会激活分解生物膜结构的蛋白酶,破坏细胞结构,并且线粒体摄入过量的Ca2+会引起膜电位紊乱,线粒体发生凋亡,进而引起细胞凋亡。
钙离子通道阻滞剂通过抑制钙离子内流不仅可以减少神经元突触前膜兴奋性氨基酸的释放和细胞内钙超载,而且可使脑血管扩张、脑血流量增加,在缺血性脑卒中的治疗中发挥重要作用。如尼莫地平(1)具有扩血管作用,可改善微循环,对脑水肿有预防和治疗作用。Horn等[20]发现一种分离自红树林真菌Xylaria的新型海洋真菌提取物xyloketal B,其可以改善氧糖剥夺(oxygen and glucose deprivation,OGD)导致的细胞死亡,缩小缺氧缺血性脑损伤小鼠模型中的梗死体积,并可促进其损伤后功能行为恢复。通过研究发现,xyloketal B是通过抑制钙离子内流、抑制细胞凋亡而发挥作用[21]。
2.2 兴奋性氨基酸受体拮抗剂
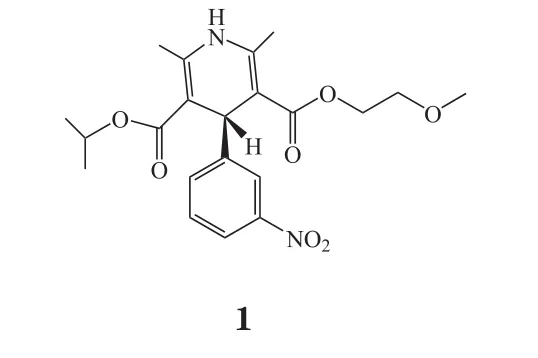
脑卒中后,脑组织供血不足,细胞内外Ca2+失衡,神经元发生去极化,使得兴奋性氨基酸[(主要为谷氨酸(Glu)]大量合成并释放,而突触间隙ATP生物合成障碍,使得突触间隙过量的Glu不能被重吸收或分解,过量的Glu作用于NMDA受体,激活Ca2+通道,进一步引发Ca2+超载,导致脑组织损伤加重。兴奋性氨基酸受体拮抗剂如脑苷肌肽,对于脑卒中的治愈率有明显的提升[22]。但有研究显示,神经节苷脂试验组和安慰剂对照组的死亡率和致残率差异并无统计学意义[23]。地佐环平(2)作为一种非竞争性NMDA受体拮抗剂,可以阻断NMDA离子通道[24]。动物实验研究发现,其可显著缩小脑梗死体积。
2.3 抗氧化剂
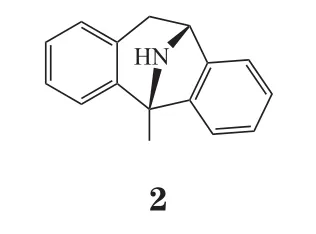
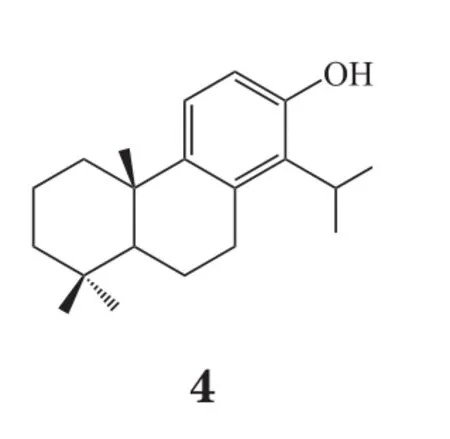
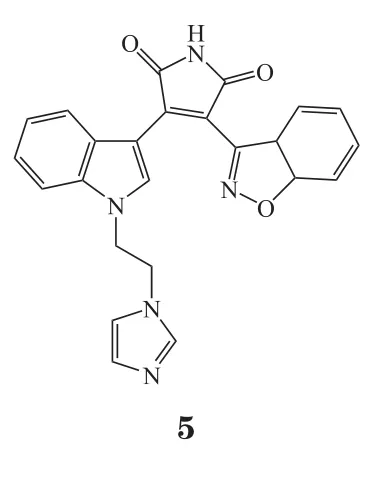
2.3.1 自由基清除剂机体内氧自由基过度生成而消除能力降低,会致体内氧自由基堆积与活性氧簇(reactive oxygen species,ROS)蓄积,从而引起神经元损伤。脑缺血后线粒体功能发生障碍,线粒体利用氧气生成ATP的能力丧失,当恢复血流后,氧气一部分转化为氧离子,另一部分在黄嘌呤氧化酶的作用下生成OH-,氧离子和OH-引发自由基链式反应,致使多种脂质过氧化物生成,最终导致大量ROS产生,对细胞造成损伤,进而引起细胞凋亡。自由基清除剂理论上可阻断该恶性循环,对神经起到保护作用。例如依达拉奉(3)可清除自由基、抗脂质过氧化,还可以维护血脑屏障(blood brain barrier,BBB)的完整性,阻止炎症细胞的侵入。有研究表明,与安慰剂对照组相比,给药试验组(对急性缺血性脑卒中患者输注依达拉奉30 mg,每日2次,持续14 d)的神经功能得到了很大的改善[25]。吡喃酮、卡唑生物碱这些生物碱是从黄皮果中提取的天然产物 claulansine F衍生而来,衍生物中的10a、7c和11a分子亚型在体外过氧化氢处理细胞模型和OGD细胞模型中均表现出对神经细胞的保护作用[26]。过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferatoractivated receptor γ coactivator-1α,PGC-1α)已被证明可作为氧化代谢的有效调节剂。研究发现,ZLN005为一种可以激活PGC-1α的小分子,其对OGD或体内外缺血诱导的神经元损伤具有很好的保护作用[27];totarol(4)可通过增加蛋白激酶B(protein kinase B,AKT)的磷酸化和血红素加氧酶-1(heme oxygenase-1,HO-1)的表达,进而增加谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)的活性,减少氧化应激,从而预防缺血性脑卒中的发生[28]。研究还发现,一种新型糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)抑制剂YQ138(5)在体内和体外均可通过激活核因子2(nuclear factor E2-related factor 2,Nrf2)信号通路来防止Glu和脑缺血引起的神经元损伤[29]。
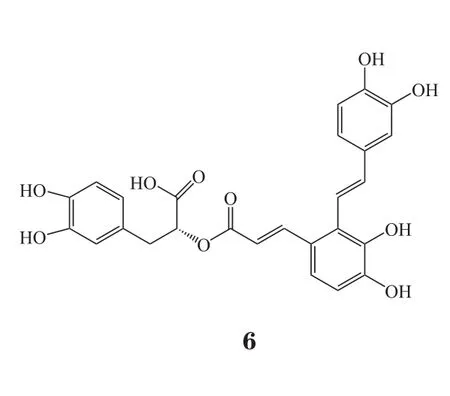
2.3.2 一氧化氮合酶抑制剂机体内有3种一氧化氮合酶(nitric oxide synthase,NOS),分别为神经元型NOS(nNOS)、内皮型NOS(eNOS)、诱导型NOS(iNOS)。不同的细胞在不同亚型的NOS催化下,生成的NO对于脑组织损伤作用不同。nNOS主要作用于缺血早期损伤;eNOS可促进血管舒张,增加脑血流量,对脑卒中有保护作用;iNOS主要在脑卒中晚期,可诱导大量NO生成,造成脑损伤。NO是缺血性脑卒中后引起病理损伤的活性氮簇,主要由iNOS催化生成。NO在细胞内有多重损伤作用,它可以通过超氧化产生亚硝酸盐,破坏线粒体并产生细胞毒性。因此,使用NOS抑制剂对于脑卒中患者的神经细胞可以起到一定的保护作用。例如丹酚酸A(6)通过抑制NOS的表达和过氧亚硝基的形成,从而对脑缺血再灌注损伤发挥保护作用[30]。
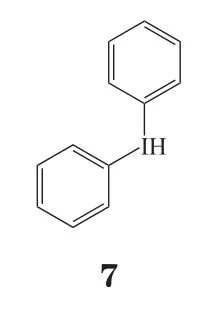
2.3.3 还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶抑制剂还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶系统是ROS的重要生成来源。正常情况下,大多数细胞的NADPH氧化酶处于低表达状态;脑缺血后,NADPH氧化酶系统激活,机体正常氧化还原动态失衡,ROS过量产生使得多种生物大分子如脂质、蛋白质、核酸被破坏,引起细胞凋亡。因此,抑制NADPH氧化酶对于脑卒中患者具有一定的神经保护作用,如抗氧化剂二苯基碘(diphenylene iodonium,DPI,7)可通过阻断NADPH氧化酶,以保护大脑神经细胞免受脑卒中的影响[31]。
2.4 抗炎免疫调节剂
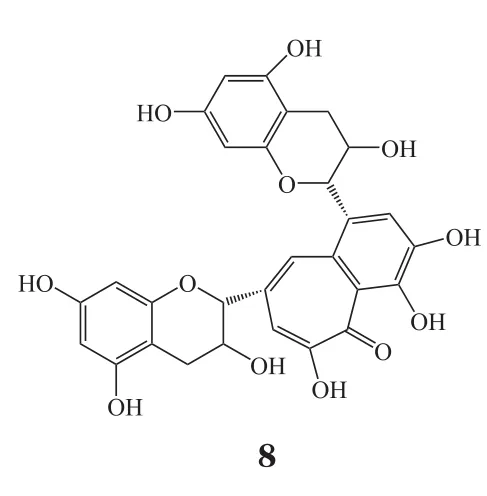
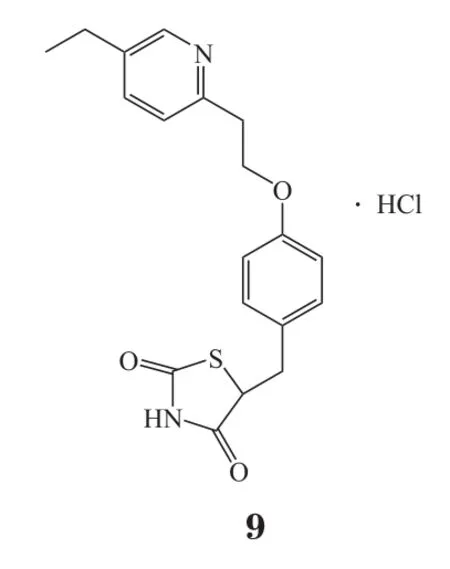
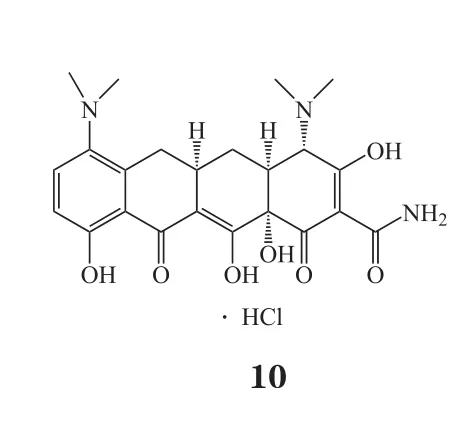
免疫炎性反应在脑缺血再灌注损伤的发生、发展中起着重要作用。脑缺血再灌注损伤时,氧自由基等信号分子可激活小胶质细胞等炎性细胞产生炎性因子,使白细胞和血管内皮细胞表面的黏附分子表达上调,中性粒细胞向微血管内皮细胞移动和黏附并可进入脑内,外周血中炎性细胞联合小胶质细胞产生大量炎性因子,从而加重脑损伤。因此,对于脑卒中患者使用一定的抗炎免疫调节剂对于再灌注后脑神经保护具有十分重要的意义。目前的抗炎与免疫调节药物有:1)茶黄素(thea flavins,TF1,8),阻断炎症相关因子的产生以及环氧化物酶和NOS等的表达,对脑缺血再灌注损伤模型有明显的保护作用[32]; 2)盐酸吡格列酮(9),为氧化物酶体增殖物激活受体γ(PPARγ)激动剂,可以减少全身炎症反应,降低卒中风险[33];3)米诺环素(10),是一种具有挑战性的抗炎药物,其化学稳定性不强,但可进行化学转化,Sharma等[34]研究发现了一种米诺环素缀合物(D-mino),其在脂多糖(LPS)激活的小鼠小神经胶质细胞中有抗炎和抗氧化活性,D-mino缀合物由于其摄取快速,可抑制炎性细胞因子的产生和通过抑制NO产生降低氧化应激,从而增强了药物的细胞内可用性,所有这些特点均显著优于游离药物;另外,D-mino的增强功效可以为靶向药物递送治疗神经损伤提供新的机会。
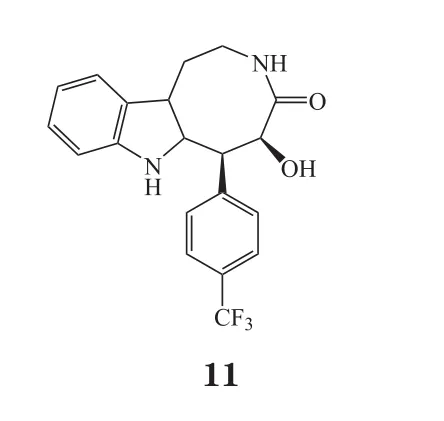
笔者所在团队前期研究发现,天然产物(+)-balasubramide的衍生物——化合物3C(11)在体外表现出明显的抗神经炎症作用;通过对小胶质细胞炎症的调控,确定化合物3C在脑缺血后具有神经保护作用;细胞实验中,化合物3C在LPS刺激的BV2细胞和小鼠原代小胶质细胞中可促进抗炎介质表达;动物实验中,化合物3C可显著缩小大鼠脑梗死体积,改善脑缺血大鼠的神经功能缺损[35]。化合物3C的抗炎机制为:1)通过激活磷酸腺苷活化蛋白激酶(AMPK)或AMPK上游的钙调节蛋白依赖性蛋白激酶(CaMKKβ),从而发挥抗炎作用;2)通过增强小胶质细胞中过氧化物酶体,促使PGC-1α活化,促进抗炎介质的生成,从而起到脑神经保护作用。
2.5 凋亡抑制剂
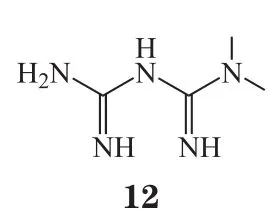
造成脑卒中神经元损伤的主要原因之一是细胞凋亡。参与缺血相关细胞凋亡因子有Caspase蛋白酶家族、AMPK、p53、核转录因子-κB(nuclear factorκ-gene binding,NF-κB)等。因而细胞凋亡抑制剂如二甲双胍(12)在脑缺血的情况下可通过激活AMPK来调节细胞凋亡,进而发挥对神经细胞的保护作用[36]。在动物实验中证实,黄芩苷(13)可通过调节磷脂酰肌醇三激酶/蛋白激酶B(PI3K/AKT)通路,从而保护缺氧缺血性新生小鼠免于脑损伤[37]。
2.6 其他类
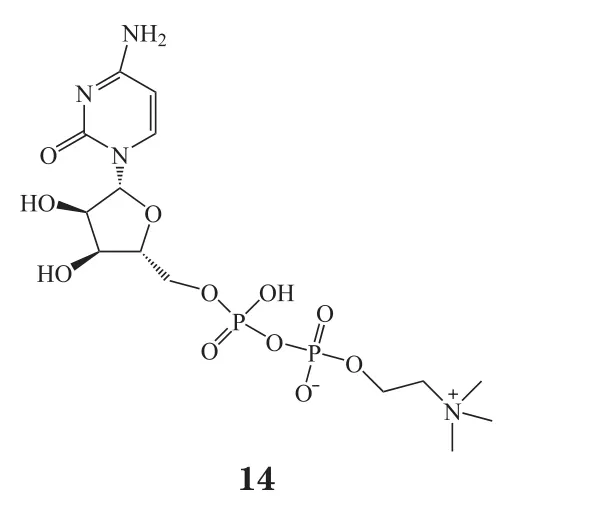
Hurtado等[38]利用成年雄性大鼠局部脑缺血模型,在缺血造模前腹腔注射给予胞二磷胆碱(14),结果发现随着剂量的增加(0.5、1和2 g · kg-1),缺血后大鼠脑组织梗死体积逐渐缩小,化合物14可以缩小梗死面积,降低神经功能缺陷。一项meta分析结果也显示,胞二磷胆碱可以改善缺血性脑卒中患者出院时的神经功能[39]。虽然研究发现胞二磷胆碱对治疗脑卒中有明显的效果,但其治疗机制尚未明确,多推测可能与胞二磷胆碱可以合成卵磷脂,而卵磷脂是合成细胞膜的重要成分有关。神经节苷脂是在国内广泛使用的一种促神经发生剂,在脑中含量丰富,其可参与突触的发生过程,激活酪氨酸激酶受体,调节细胞内钙离子的平衡,降低活性氧自由基的产生,具有保护细胞膜、恢复神经功能等作用。一项关于神经节苷脂辅助治疗脑梗死疗效的meta分析表明,在脑卒中的常规治疗上加神经节苷脂有很好的疗效[40]。最近,越来越多的研究者认为,营养物质是预防脑卒中的重要因素[41],因此蛋白水解物得到了越来越多的关注。脑蛋白水解物是由动物脑组织蛋白通过酶水解获得的一种物质,它是由多种小分子肽和具有生物活性的特异性氨基酸组成,以各种方式作用于中枢神经系统,可保护神经元,提高记忆力、注意力和警惕性。此外,许多老年人尤其是亚洲国家的老年人更喜欢食用植物衍生肽,高纤维食物也可以降低脑卒中的发病风险[42]。Wattanathorn等[43]研究表明,腰果衍生的蛋白水解物对大脑中动脉闭塞诱导的脑缺血大鼠具有神经保护作用,其也可以作为防止脑卒中的潜在保护剂,但其具体的作用机制尚不明确。
3 神经保护剂早期临床试验失败的原因
近20年来,急性缺血性脑卒中临床前研究的数量、广度和深度均显著增加[44]。最近已在临床前动物模型中确定了大量的神经保护剂可以减少急性缺血性脑损伤。1990—1994年,全球平均每年有25篇文章评估急性缺血性脑卒中动物模型中神经保护剂的作用;2000—2004年间增长了3倍(每年平均77篇),在2010年之后增长了近6倍(平均每年144篇),而在1990—1994年,针对缺血性脑卒中治疗,在500项临床试验中约包括200种神经保护候选药物开始进行研究,其中350项试验于2018年2月28日前已经完成(数据来源于www.clinicaltrials.gov)。但在200名接受神经保护剂治疗试验的患者中,只有9名患者在有临床前研究的基础下成功转入Ⅲ期临床试验[45]。这表明在脑卒中临床试验中,很少有神经保护剂能达到预期的临床效果。神经保护剂在早期临床试验失败的原因主要为临床前和临床研究因素不匹配。为了找出临床前试验与临床脑卒中研究之间的差异,一项研究分析了1990年1月1日到2018年2月28日在PubMed和Web of Science数据库中检索到的关于缺血性脑卒中神经保护剂的所有临床前研究[46],最终确定了PubMed上的3 943篇文献和Web of Science上的6 749篇文献,研究结果显示临床前与临床研究因素不匹配可能导致临床试验的失败。临床人群的5个主要特征在大多数临床前研究模型中没有被考虑(见图1)。
3.1 临床前研究与临床试验中缺血模型差异
目前,神经保护剂的临床前研究疾病模型大多数是针对短暂性缺血模型[46]。短暂性缺血动物实验模型通常在小鼠中持续1 h或在大鼠中持续1.5 ~2 h。在这些时间范围内使用重组人组织型纤溶酶原激活物阿替普酶(alteplase,rt-pa)和血管内治疗的临床试验患者中,同时使用神经保护剂对于治疗成功的可能性更大。研究显示,永久性缺血模型的神经保护剂治疗效果通常比暂时性缺血模型差[47],因此临床前研究也认为神经保护剂发挥疗效需要依赖于再灌注治疗。观察进入Ⅲ期临床试验的10种神经保护剂在短暂性和永久性缺血临床前动物模型中的作用结果发现,这10种神经保护剂只在短暂性缺血模型中有积极作用,而在永久性模型中并未显示有明显作用[46]。因此,血管内充分的再灌注治疗为神经保护疗法提供了机会,脑卒中的主要治疗目标应针对于缺血半暗带,而再灌注恢复血流可以促进神经保护剂向缺血性半暗带输送,进一步保护缺血半暗带损伤的细胞[48]。缺血性卒中后再灌注的疗效不仅取决于闭塞血管的再通,还取决于侧支循环的固有特性,梗死核心附近的侧支循环可能在血管闭塞后被激活,为损伤的周围组织提供缺失的营养物质和氧气,因此,侧支血流通畅情况可影响预后。
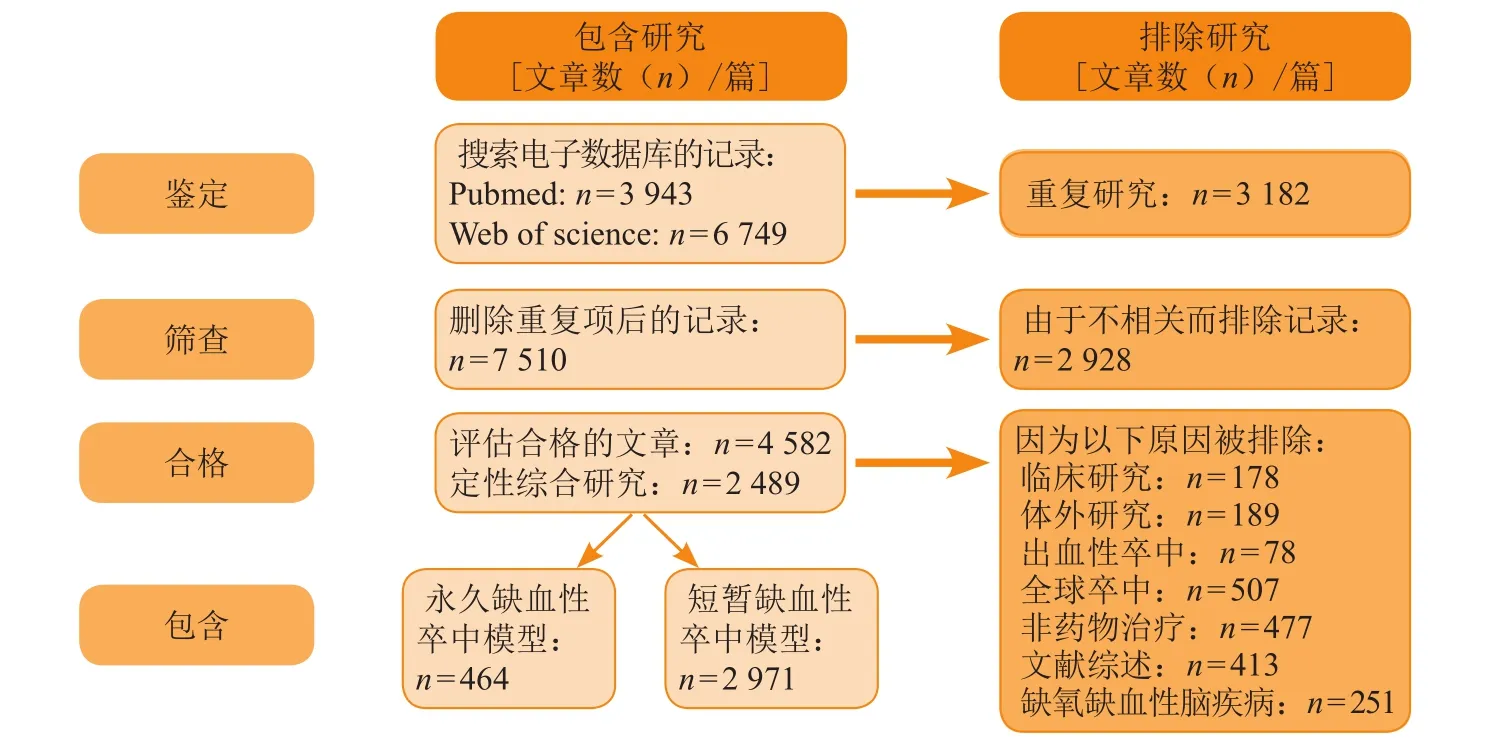
图1 缺血性脑卒中神经保护剂的研究选择流程图Figure 1 Study selection flow chart of neuroprotective agents for ischemic stroke
3.2 临床前研究与临床试验治疗效果评估差异
临床前研究多以梗死体积评估,临床试验多以长期神经功能状态评估。70%的临床前研究将梗死体积作为评价治疗效果的单一标准,而临床治疗效果主要是基于改良Rankin量表[49-50]用于评估长期神经功能状态。在一部分受试者中的研究显示,临床症状的严重程度与梗死体积之间并无直接相关性[51],这表明在临床前研究中不能将梗死体积作为单一评估标准。综合分析显示,2 489项临床前研究中只有819项评估了卒中动物的神经功能结果,而在这819项研究中只有不到30%的研究在较长时间(此处定义为> 14 d)监测了神经功能状态[46];在这些临床前研究中显示,大多数神经保护剂可以促进长期神经功能恢复,但均未进行过临床试验。究其原因可能是:动物研究和人体研究之间存在巨大差异;脑卒中在不同人群中发病亦存在差异;治疗时间窗不同以及神经保护剂的不良反应亦不同;脑缺血损伤机制复杂,单一的神经保护剂不能起到很好的效果。因此,在临床前研究中对长期神经功能恢复取得改善作用的神经保护剂,对其进行临床试验并深入研究是有必要的。
3.3 临床前研究与临床试验研究对象年龄与性别差异
临床前研究模型主要使用年轻动物,而在临床患者常见于老年患者。众所周知,人类脑卒中发病风险随着年龄的增长而急剧上升[52]。临床前研究表明,发生短暂性脑动脉闭塞的青年大鼠死亡率为6.3%,老年大鼠死亡率为43.5%[53]。临床前研究在超过2 000种治疗方法中,只有2种治疗方法[3K3A激 活 蛋 白 C(3K3A-activated protein C,3K3AAPC)[54]和氯化镁[55]]在老年啮齿动物(3K3A-APC实验动物为小鼠,氯化镁为大鼠)永久性缺血模型中进行评估,并发现缺血损伤后老年大鼠神经功能损害随着时间的延长而愈发严重[56]。美国心脏协会最近一份报告显示,65 ~ 74岁缺血性脑卒中患者的30 d内死亡率为9.0%,74 ~ 84岁为13.1%,85岁及以上为23.0%[57]。美国国家神经紊乱和卒中研究所报告称,每年卒中的女性患者比男性多5.5万人,女性在年轻时缺血性脑卒中发病率低于男性,但在85岁之后反而高于男性,且女性脑卒中后的死亡率、致残率更高[58]。在临床前研究中,年轻雌性啮齿类动物在缺血性脑卒中后脑部损伤程度比年轻雄性啮齿类动物小[59],因为类固醇激素如雌激素和黄体酮,是缺血性脑卒中后潜在的神经保护因子[60]。因此,考虑到年龄及性别差异,有必要分别评估用于老年男性和女性的神经保护剂。
3.4 临床前研究与临床试验研究对象共患病差异
临床卒中患者常伴多种其他疾病。大约72%的缺血性脑卒中发生在65岁以上的患者身上[61]。在这一老年人群中往往存在着其他慢性疾病,包括高血压和糖尿病等,且其可能影响神经保护剂的疗效[62]。脑卒中研究评估发现,90%的缺血性脑卒中是由包括高血压、糖尿病、高浓度酒精摄入、吸烟习惯、不良饮食选择、肥胖、缺乏运动、心理社会压力、心脏疾病和脂质异常等10个已知的危险因素引起的[63]。但绝大多数临床前脑卒中研究对象均是建立在最佳无病原条件下饲养的年轻健康啮齿类动物模型中进行的,因此尝试设计包括糖尿病和高血压等常见共患病的动物模型,再在这些模型中进行神经保护剂的效果评估可能更准确[64]。 然而,鉴于共患病的复杂性,应要求脑卒中实验模型只涵盖多种疾病的单一方面,确保在特定共患病的多个独立模型中有效,这样可能增加临床试验成功的可能性。
3.5 临床前和临床研究中的发表偏倚
中性或消极的结果很难在同行评议期刊上发表,这会在临床前和临床研究中引入发表偏见,从而影响报告中得出结论的真实性。研究发现,95%符合纳入标准的研究均能在临床前模型中获得积极的结果[46],这种只报告正面结果的倾向将会导致临床前和临床研究的发表偏移,造成研究结果不真实。
4 结语与展望
综上,脑卒中治疗的主要目标是提高缺血性卒中早期再通率,应探索新型溶栓药物以提高缺血性脑卒中患者再通率,降低出血风险。改进机械溶栓技术不仅可以实现LVO再通,而且可获得最大程度的小血管再灌注。同时,应寻找保护血脑屏障并保持其完整性的药物,脑缺血后,其可以保护BBB功能,抑制水和促炎细胞因子进入大脑,最终减轻再灌注损伤。基于广泛的文献分析,神经保护剂与溶栓药物或血管内血栓切除术的结合应作为治疗急性缺血性卒中的新策略。目前,神经保护剂在临床研究未能成功为临床试验失败的原因:1)在患者方面,未将神经保护剂候选分子与快速、丰富的再灌注结合治疗。在实验模型上,过多应用短暂脑卒中模型,而未使用永久性脑卒中模型。2)缺乏临床前研究分析治疗效果与长期神经功能。3)使用健康的成年雄性动物替代患有糖尿病和其他疾病的老年雄性和雌性动物。4)与大型临床试验相比,临床前研究文章倾向于报告有统计学意义的积极结果。因此,鼓励临床前研究使用雌性动物、老年动物,评估长期神经功能结果,并增加严格、权威性的分析和适当的统计性数据[65],且鼓励临床前永久性脑卒中模型的建立,这些高要求可以加速临床前向临床研究的转化,给生物医学带来回报,也为未来脑卒中患者带来更多的福音。
