儿童门静脉高压症研究进展
2019-11-14徐志强
徐志强,张 敏
门静脉高压症(portal hypertension, PHT)简称门脉高压症或门脉高压,是指由多种病因所致门静脉系统的血流受阻和(或)血流量增加、血管舒缩功能异常,引起门静脉及其属支的压力明显增高,最终导致脾大、门腔侧支循环形成和开放、胃食管静脉曲张破裂出血、腹水以及肝性脑病等临床表现,是一种血流动力学异常综合征。因此,PHT不是一种单一疾病,而是一组临床综合征表现。儿童PHT根据病因不同分为肝硬化性PHT和非肝硬化性PHT,虽然发病率较低,但可以引起胃食管静脉曲张破裂出血、肝性脑病等严重并发症。
1 门静脉压力测定
由于直接测定门静脉压力的难度较大,临床上常采用肝静脉压力梯度(hepatic venous pressure gradient, HVPG)代表门静脉压力。HVPG 为肝静脉楔入压与游离肝静脉的压力差,球囊堵塞法是目前较为精确的测定方法,HVPG正常范围是3~5 mmHg(1 mmHg=0.133 kPa)[1],超过10 mmHg 即可诊断为PHT[2]。当HVPG>12 mmHg时,成人患者出现食管胃底静脉曲张的可能性较大;>20 mmHg是有效的预后不良预测因子,其出血和死亡风险增加5倍[3]。但是儿童患者与成人患者不同,HVPG不能准确预测其PHT并发症的风险,HVPG与肝纤维化程度、静脉曲张及出血无显著相关性[4]。
2 分类和病因
PHT根据病因不同和压力来源的解剖部位不同有2种分类方法。根据病因可分为肝硬化性门静脉高压症(cirrhotic portal hypertension, CPH)和非肝硬化性门静脉高压症(non-cirrhotic portal hypertension, NCPH)。成人由各种病因所致的肝硬化引起的CPH占90%左右,NCPH仅占约10%,儿童约各占50%[5-7]。根据压力来源的解剖部位,PHT可分为肝前性、肝内性(窦前性、窦性、窦后性)及肝后性(见表1)。
3 发病机制
PHT因其病因复杂,形成机制尚不明确,目前公认的主要有3大学说,即“前向血流学说”“后向血流学说”和“液递物质学说”。
3.1 前向血流学说 认为内脏高动力血液循环是门脉高压发生和维持的一个重要因素,当持续性门静脉高压时,脾静脉压力增高,使脾静脉增宽,代偿性脾功能亢进。为暂时缓解门静脉压力,使平时闭合的门-腔系统间的交通支重新开放,与腔静脉系统之间形成侧支循环,使门静脉血流入腔静脉,最后回流至心脏,随着肝硬化病情进展,门静脉压力持续增高,使血容量增加、外周动脉扩张,在2者的作用下,启动高动力循环状态,而其是门静脉高压持续的关键。
3.2 后向血流学说 认为肝小叶病变使门静脉血流进入小叶中央静脉受阻。肝窦是相邻肝板之间的腔隙,是肝小叶内血液流通的管道,因肝窦的通透性较大,有利于肝细胞与血流之间进行物质交换,且肝窦内皮细胞与肝细胞之间有一狭窄间隙,称窦周间隙(Disse腔),是肝细胞与血浆之间进行物质交换的场所,当炎症等致病因素长期刺激时,肝细胞变性、坏死及纤维组织增生,假小叶形成,结缔组织增生,肝血窦闭塞或窦周纤维化,且假小叶压迫小叶下静脉使肝窦内血液流出受阻,并且肝内肝动脉小分支与门静脉小分支形成异常吻合支,这些窦前性、窦性、窦后性的原因,使门静脉血液回流受阻,从而加重门静脉系统压力,促进门静脉高压的形成。
3.3 液递物质学说 认为肝功能下降导致肝脏对内脏及外周血管活性物质的灭活能力下降,并且随着侧支循环的建立,部分因子随侧支循环无法进入肝脏灭活,而这部分无法灭活的液递物质因子在体内不断增多,使液递物质浓度异常增加,引起正常血管收缩和舒张之间的生理平衡被打破,导致全身及内脏血流动力学异常,使得体循环和内脏循环发生一系列改变,比如内脏血流量增加、肝内血管阻力增加等[8]。
4 诊 断
4.1 PHT诊断 PHT临床表现差异较大,轻者仅为轻度脾大、脾功能亢进和食管胃静脉曲张;重者可出现食管胃静脉曲张破裂出血、腹水及肝性脑病等严重并发症。临床上可根据血常规(如WBC、PLT减少)、影像学(如脾大、门静脉增宽、门静脉系统侧支循环形成)及内镜检查(如食管胃静脉曲张)初步判断有无PHT。近年来,各种无创诊断技术也被尝试应用于PHT的诊断,基于简单血液指标的模型如APRI(AST与PLT比值指数)及FIB-4(基于年龄、ALT、AST及PLT的纤维化指数)等,基于影像技术的肝脏或脾脏硬度测定,以及基于放射组学的HVPG预测模型[9-11]。
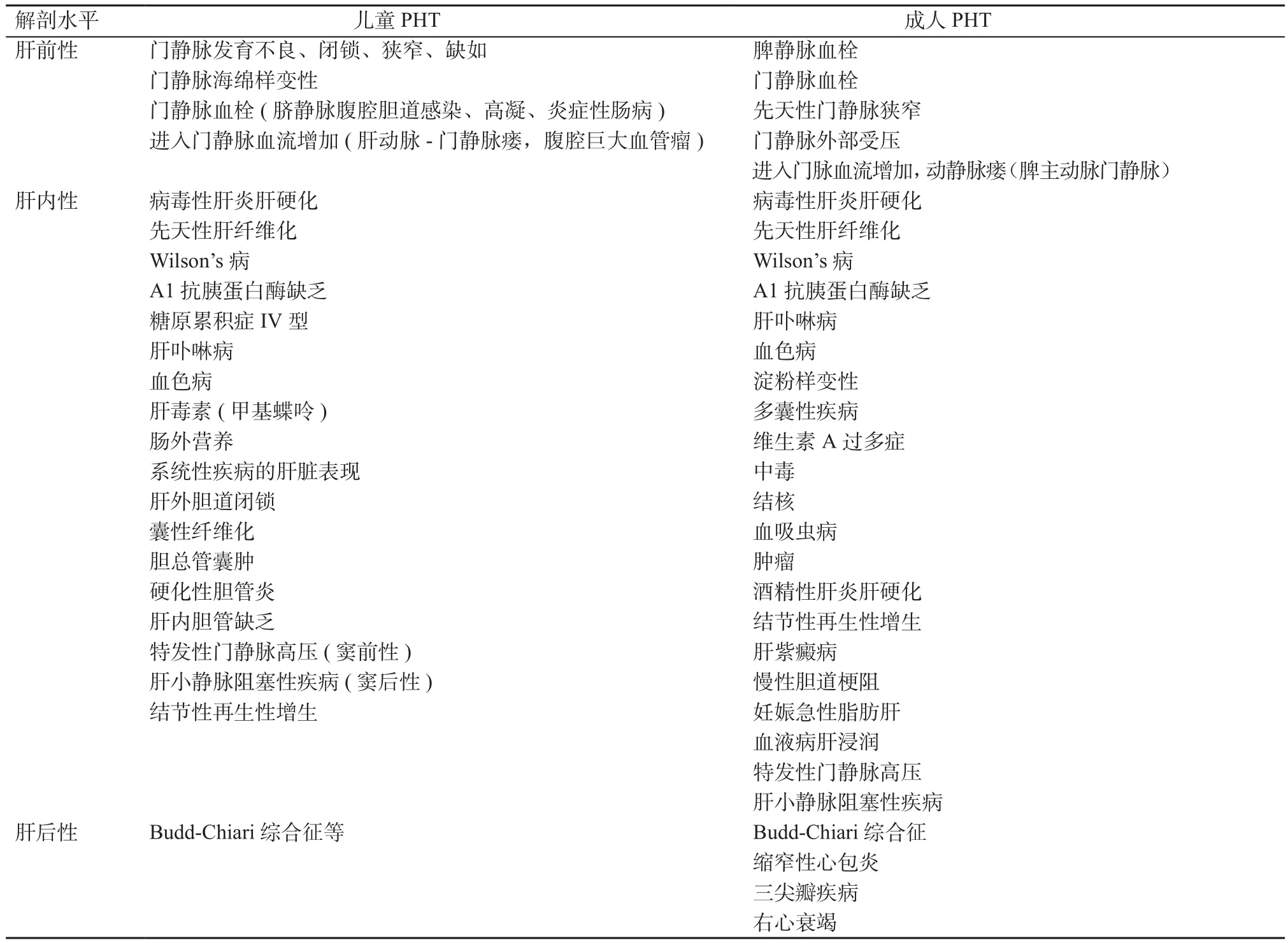
表1 门静脉高压症疾病谱Table 1 Disease spectrum of PHT
超声弹性成像检测技术具有无创、安全且经济的特点[12]。通过瞬时弹性成像(transient elastography, TE)技术检测肝硬度(1iver stiffness,LS)或采用肝脏硬度-脾脏长径比PLT计数评分(liver-stiffness measurement-spleen diameter to platelet ratio score, LSPS)进行测量可作为无创识别PHT的主要方法[13]。LSPS>2.06对于判定PHT的特异度为90%,阳性预测值>90%[14]。一项荟萃分析显示,TE技术测量的LS与HVPG相关性良好(r=0.783,P<0.001),灵敏度为87.5%,特异度为85.3%,并且提出了较低的诊断PHT的临界值(13.6~18.0 kPa),从而使假阴性结果减少且灵敏度增加,实现早期识别PHT[15]。但TE技术受肥胖、肋间隙狭窄或腹水的影响,患者酒精、食物摄入、转氨酶、胆汁淤积等影响因素则会增加LS值,影响其准确性,进而导致对PHT的估计过高[16]。另外,HVPG>10~12 mmHg时,LS和HVPG的相关性明显下降,限制了LS用于PHT评估。在点剪切波成像技术中,德国西门子公司的Virtual Touch被定义为声辐射力脉冲成像(acoustic radiation force impulse imaging, ARFI)技术,诊断临界值为2.17 kPa[17],能够较可靠地预测PHT。
4.2 判断PHT的病因及类型 对于PHT患者,应结合病史,症状,体征,生化、病原、免疫学、铜蓝蛋白、遗传病相关基因等实验室检查,以及影像学及病理学检查,对引起PHT的具体病因做出诊断并大致判断其类型。肝硬化所致的窦性PHT患者,多伴有明显肝脏合成功能障碍的表现,如血清ALB水平降低、胆红素水平升高及PT延长等。相反,NCPH如肝(窦)前性或肝(窦)PHT患者,通常无明显肝脏合成功能障碍,因而其血清ALB、胆红素及PT水平多无明显变化[18];其中肝(窦)后性PHT患者多伴有肝脏增大。对儿童患者须重点关注先天遗传代谢类肝病和肝血管类疾病。
4.2.1 先天性肝纤维化 先天性肝纤维化(congenital hepatic fibrosis, CHF)属非硬化性、肝内窦前性PHT,因PHT纤维囊蛋白的常染色体隐性多囊性肾病基因突变而引起的先天遗传性疾病[19],其特征在于小叶间胆管发育障碍,胆管板畸形及胆管系统结构重塑,肝内门静脉分支异常和门静脉进行性纤维化、PHT为主要表现,多数患者可伴 Caroli综合征(Caroli’s syndrome, CS)或遗传性多囊肾病,包括常染色体显性遗传性多囊肾病和常染色体隐性遗传性多囊肾病,50%患者因门静脉高压食管胃静脉曲张出血死亡,肝功能衰竭罕见[20]。CHF可分为门脉高压型、胆管炎型、门脉高压和胆管炎混合型和隐匿型。CHF主要临床表现为门静脉高压。合并CS时伴反复发作的发热、黄疸、上腹痛等;合并多囊肾者可出现尿毒症。患者肝肿大而质地坚硬,常伴随肝肾囊性疾病,但肝功能代偿良好。ALT和AST水平一般不升高,如升高则表明存在肝细胞损伤[21],肝脏病理及基因检测可明确诊断。
4.2.2 特发性非肝硬化门静脉高压症 特发性非肝硬化门静脉高压症(idiopathic non-cirrhotic portal hypertension, INCPH)是一种罕见的肝脏血管疾病,亦可称为特发性门静脉高压,病因主要集中在免疫、感染、药物或毒物、遗传、促血栓或高凝等方面[22]。其特点是肝内门静脉高压,无肝硬化或者其他肝脏疾病以及门静脉、肝静脉血栓的表现。INCPH主要临床表现为门静脉高压、脾大或巨脾以及脾功能亢进。而肝损伤、腹水以及肝性脑病较少见。
4.2.3 肝外门静脉阻塞 肝外门静脉阻塞(extrahepatic portal vein obstruction, EHPVO)是指门静脉主干及由主干延伸到分支的静脉阻塞的肝血管性疾病[23-24],伴或不伴有肝内门静脉分支、脾脏或肠系膜上静脉的栓塞,而肝功能保持较好,常在儿童期发病,是NCPH的重要原因。EHPVO不仅包括血栓阻塞,还包括肿瘤压迫,门静脉先天性畸形等多种病因。EHPVO易感因素可分为血管腔内(血栓前状态),血管壁(损伤、炎症、浸润)或血管外[25]。少数患者继发于门静脉狭窄、闭锁或发育不全等异常。儿童患者与成人患者的病因有所不同,儿童EHPVO约70%是特发性的,凝血酶原基因突变(G20201A)和亚甲基四氢叶酸还原酶缺乏症(C677T)也常见;成人EHPVO常见病因是原发性骨髓增生性疾病(有或无JAK2突变)与门静脉血栓形成(portal vein thrombosis,PVT)[26]。
4.2.4 门静脉血栓形成 PVT是指各种原因所致门静脉主干和(或)门静脉左右分支静脉内的血栓形成,伴或不伴肠系膜上、下静脉,脾静脉血栓的肝血管疾病[26],可造成管腔部分或完全性阻塞。可见于任何年龄段,多为肝硬化或恶性肿瘤患者。PVT的病因复杂,约1/3成人PVT继发于肝硬化或肝癌;婴幼儿PVT多继发于先天性门静脉闭锁、脐静脉炎和阑尾炎等,常发展为EHPVO。PVT机制与病因有关,主要包括血管内皮细胞损伤或畸形、血流缓慢及高凝状态。彩色超声、无创肝脏弹性测定、CT血管造影术、门静脉直接或间接造影可明确诊断,而磁共振血管造影术对于门静脉系统评价更准确,敏感度和特异度更高。
4.2.5 肝结节性再生性增生 肝结节性再生性增生是一种慢性非硬化性肝脏疾病,临床常表现为窦前性或窦性PHT[27-28],并常伴有免疫病等系统性疾病;组织病理特征为肝实质内肝细胞结节形成,但炎症反应轻微。因其临床少见,故常被误诊为肝硬化。成人患者性别比例无明显差别,也可发生于儿童[29-30]。病因和发病机制尚不清楚,一般认为与肝实质内微循环障碍有关,是肝脏对血流分布异常的一种非特异性适应性改变,这种病理改变的基础是门静脉的末级分支闭塞和减少,血管内皮损伤,血供减少部位肝细胞萎缩,而血供正常的部位肝细胞增生,形成无纤维分隔的再生结节,弥漫累及小静脉,导致该病[31]。门静脉系统的阻塞或微血栓是NRHL的基本病理改变。
4.2.6 门静脉海绵样变性 门静脉海绵样变性(cavernous transformation of the portal vein, CTPV)可引起肝前性PHT,多见于儿童。门静脉主干和(或)其分支慢性部分性或完全性阻塞后,在门静脉周围形成许多向肝性扩张迂曲的侧支循环,在大体标本切面和影像学检查时呈海绵状血管瘤改变。病因主要考虑为门静脉先天性发育异常、门静脉感染和门静脉血栓形成。另外,脾脏切除、门腔静脉分流术、胆道自发性穿孔、寄生虫感染、肝脓肿及非霍奇金淋巴瘤等也与门静脉血栓形成有关。几乎所有CTPV 患儿均有脾大、脾亢症状。大部分患儿同时伴食管胃底静脉曲张等,当曲张的静脉发生破裂时可出现呕血、黑便、腹痛等,因侧支循环建立的不完善,出血量大,有长期反复出血、治疗后再出血的趋势。
4.2.7 戈谢病 戈谢病(Gaucher’s disease, GD)导致PHT的主要机制是由于脾肿大导致血流量增加,因此,PHT多为肝前性。当病情进展到肝纤维化、肝硬化时,血流阻力增加,其PHT属于窦性。GD是一种常染色体隐性遗传的溶酶体贮积病[32],其基因突变位点是染色体1q21。由于葡萄糖脑苷脂酶基因突变所致其活性缺乏导致其底物葡萄糖苷脂在肝脏、脾脏、骨骼、脑、肺等器官的巨噬细胞溶酶体内贮积,形成典型的贮积细胞(即“戈谢细胞”),进而使受累组织器官出现病变。根据有无神经系统病变分为两大类共3型(1型为非神经病变型,2型为急性神经病变型,3型为慢性/亚急性神经病变型)。其中1型主要累及内脏和骨骼,并不累及神经系统。肝脾肿大是最常见表现,而肝功能损伤相对较轻。GD患者肝脏长期受累,严重者可进展为肝硬化、PHT、肝细胞癌、肝功能衰竭等,常提示预后不良[33]。
4.2.8 肝窦阻塞综合征 肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome, HSOS)又称肝小静脉闭塞症,是以肝血窦、肝小静脉和小叶间静脉内皮细胞损伤导致管腔狭窄或闭塞,从而引起肝内淤血、肝损伤和肝内窦后性门静脉高压为特征的肝脏血管性疾病,临床表现主要为肝区疼痛、黄疸、腹水和肝脏肿大。按病因分为以下3类[34]。①吡咯生物碱相关HSOS:与食用含有吡咯生物碱的中草药相关,如菊科的土三七、千里光,紫草科的天芥菜,豆科的猪屎豆等,服用后可能会导致严重的HSOS,其中因服用土三七导致的HSOS占50.0%~88.6%[35]。②造血干细胞移植(hematopoietic stem cell transplantation,HSCT)相关HSOS:移植前预处理方案使用大剂量化疗药物及放疗通常是其直接原因。③其他病因不明的HSOS,大多与使用化疗药物有关。常见药物有:环磷酰胺、6-巯基嘌呤、硫唑嘌呤等。
4.2.9 布加综合征 布加综合征(Budd-Chiari syndrome, BCS)亦属于NCPH,是指由于肝静脉主干和(或)下腔静脉肝段的阻塞或狭窄而形成门静脉高压的一种综合征[36]。作为一种肝脏血管异常的疾病,BCS是临床表现为肝静脉流出道梗阻的各种异质性疾病的综合体。梗阻的部位可以定位于从小肝静脉一直到下腔静脉与右心房连接处[37]。BCS按解剖分为3个类型:肝静脉阻塞型、下腔静脉阻塞型和混合型[38]。BCS的临床表现复杂,有时起病隐匿诊断困难,如突然出现腹水伴有肝脏体积增大及上腹部疼痛,肝功能损伤不严重但腹水蛋白含量较高时,应怀疑本病。BCS患者的肝生化及腹水等检查没有明显特异性,因此影像学对BCS的诊断有着特殊优势。诊断困难者可行肝穿刺活组织检查[39]。
5 治 疗
5.1 原发病的病因治疗 对于PHT病因明确患儿,应及时给予针对原发病的病因治疗,例如:对乙型肝炎患儿采用恩替卡韦抗病毒治疗;自身免疫性肝炎酌情使用激素治疗;代谢性肝病如Wilson’s病或血色病给予驱铜或驱铁治疗。EHPVO等血管源性PHT或血管畸形可行手术矫正或介入治疗,也可行外科手术:Rex(肠系膜上-门静脉分流术)手术、改良Rex(胃冠状静脉或脾静脉或小肠静脉或肠系膜下静脉与门静脉左支分流;或门静脉右支分流)手术、Warren(远端脾-肾分流)手术。易栓症、血栓性予抗凝治疗。
5.2 对症支持治疗 CPH通常肝功能损害明显,而NCPH肝脏基础尚可。对于PHT患儿进行对症支持治疗:肝硬化低蛋白者补蛋白,腹水者利尿,肝性脑病者脱氨、防治脑水肿,感染者抗感染,并发EVB者止血。EVB的防治包括:①预防首次EVB(一级预防);②控制急性EVB;③预防再次EVB(二级预防);④改善肝功能储备;⑤非选择性β-受体阻断剂降低门脉压力;⑥经颈静脉肝内门体分流术;⑦胃镜下止血、套扎、硬化剂治疗等。
5.3 外科手术、肝移植 外科手术目的主要是缓解门静脉压力,治疗EVB和纠正脾功能亢进等,可行门奇静脉断流术或分流术、选择性贲门周围血管离断术联合脾切除术等。发展至终末期肝病后行原位肝移植是惟一有效的方法。
6 小 结
PHT病因复杂,病理生理改变多样,临床表现各异。临床上应及时识别有无PHT并正确区分其类型,从明确病因入手,在及时给予病因治疗的基础上,根据其表现、特点及严重程度,针对主要病理生理环节选择科学合理的治疗手段进行治疗,以减少相关并发症,提高患者的生存率和生存质量。
