基于Label free定量蛋白质组学技术对马铃薯晚疫病菌氮饥饿条件下分泌蛋白组初步分析
2019-11-14姚春馨丁玉梅周晓罡
余 萍,董 超,姚春馨,丁玉梅,周晓罡*
(1.云南省农业科学院生物技术与种质资源研究所,云南 昆明 650223; 2.云南省农业生物技术重点实验室,云南 昆明 650223; 3.农业部西南作物基因资源与种质创制重点实验室,云南 昆明 650223)
【研究意义】马铃薯晚疫病菌是危害马铃薯和番茄最为严重的病害之一,对全球的食物生产构成持续的威胁[1]。马铃薯晚疫病菌的侵染发育是一个复杂的生物学过程,在感染和定植期间,该病原菌产生的细胞外效应蛋白被分泌到植物质外体,其中一些被认为是传递到宿主细胞质中促进感染进程。氮是氨基酸和核酸的重要组成部分。氮源在微生物的细胞周期、生长和蛋白质转化中起着重要作用。真菌在营养胁迫条件下,可以通过物质的再利用维持细胞生存乃至生长,在此过程中病原菌致病基因能够被诱导表达。因此,对马铃薯晚疫病菌在低氮胁迫条件下致病基因编码的分泌蛋白如何表达,在什么条件下表达,在病菌与环境、病菌与寄主的互作中起到何种作用,还需要进行深入研究。【前人研究进展】马铃薯晚疫病菌作为模式生物,其基因序列的公布,为研究其复杂的生物学功能、致病性及进化提供重要依据[2-4]。有研究表明,在细菌和酵母中,氮饥饿严重影响其细胞周期,生长和蛋白质转化[5]。在体外,真菌会产生和分泌大量的蛋白质以应对氮饥饿[6]。生长在缺氮培养基上的稻瘟病菌提取物处理水稻叶片,强烈诱导叶片衰老症状与真菌感染的组织相似[7]。类似于基因组学和转录组学,蛋白质组学已经发展到采用高通量技术和方案,更快地分析大量蛋白质,以明白植物致病菌的相互作用,病菌的致病性和毒力等[8]。通过蛋白质组学,可以发现成千上万的蛋白质何时,在哪里,怎样互相交流以应答所处的环境。其中Label-free无标记定量蛋白质组学基于对离子强度变化的测量研究比较两个或更多样本[9]。基于Label-free的蛋白质组学虽然准确度相对较低,但具有更大的蛋白质浓度动态范围,并且更简单,更便宜。【本研究切入点】应用基于Label-free蛋白质组学技术和生物信息学分析研究氮饥饿处理条件对马铃薯晚疫病菌分泌蛋白的影响。【拟解决的关键问题】探究氮源是否影响马铃薯晚疫病菌的致病性蛋白的分泌,从而影响马铃薯晚疫病菌的致病性。
1 材料与方法
1.1 马铃薯晚疫病菌的培养及处理
将实验室保存的致病疫霉NOD-1从试管转移至固体培养基(黑麦70.0 g/L,番茄汁150 mL/L,琼脂粉8.0 g/L,阿莫西林100 mg/L,五氯苯30 mg/L,利福平10 mg/L,那他霉素10 mg/L),在17 ℃培养箱中培养7 d。缺氮处理参照Zhou等(2016)的方法[10]。将来自2份菌丝体的滤液置于冰上,在4 ℃搅拌下将100 %(NH4)2SO4缓慢加入到滤液中过夜以沉淀蛋白质,然后在4 ℃和10 000 r/min下离心10 min。将沉淀物溶于去离子水中,转移至截止范围为1 KD的透析袋中,并置于4 ℃的去离子水中。透析液每4 h更换一次。将透析过的蛋白质冷冻干燥并保留。
1.2 蛋白质的裂解和定量
取样品组内合并,分别与 300 μl的 SDT裂解液混合裂解样品,经超声进一步破碎,沸水浴 15 min后,12 000 r/min离心 30 min,所得上清即含目标总蛋白。利用BCA 法对目标总蛋白定量。
1.3 蛋白质的酶解和LC-MS/MS分析
经 Zeba 处理后的样品,每份 100 μl,参照Chen等方法[11]交由上海中科新生命生物科技有限公司进行酶解和LC-MS/MS分析,获得LC-MS/MS数据。简言之,经过一系列试剂的加入、离心等处理,获得酶解后产物,并在OD280下定量。酶解产物经毛细管高效液相色谱分离后用 Q-Exactive 质谱仪(Thermo Finnigan)进行质谱分析。
1.4 Maxquant非标记分析
LC-MS/MS 原始文件均导入 Maxquant 1.3.0.5软件进行查库非标记定量分析。数据库为uniprot_phytophthorainfestans_18465_20151221.fasta。主要参数:主要搜索为6×10-6,允许最多2次错过裂解位点,碎片离子的质量公差为20×10-6,胰蛋白酶酶促切割,固定修饰:半胱氨酸的氨甲酰甲基化,可变修饰:蛋白质N端乙酰化和蛋氨酸氧化,肽和蛋白质的错误发现率(FDR)均为0.01。基于Label Free定量(LFQ)在MaxQuant软件中确定的肽量化蛋白质丰度。
1.5 数据分析
利用Perseus 1.3.0.4软件对Maxquant所得的查库文件进行统计学分析。TMHMM(www.cbs.dtu.dk/services/TMHMM)用于预测蛋白的跨膜螺旋数量。WoLF PSORT(http://wolfpsort.seq.cbrc.jp)用于预测蛋白质亚细胞定位。亚细胞定位可以提供额外的信息,支持特定蛋白质的功能。使用Gene Ontology(http://geneontology.org/)基因功能分类体系和生物信息学在线工具KEGG(https://www.kegg.jp/kegg/)对差异表达蛋白进行功能和代谢途径分析。采用STRING数据库[12](http://www.string-db.org/)对受氮饥饿处理的马铃薯晚疫病菌差异蛋白进行互作分析,构建差异表达蛋白间的互作网络图。信号肽的存在是使用SignalP服务器预测(www.cbs.dtu.dk/services/SignalP/)[13-14]。
2 结果与分析
2.1 差异表达蛋白点的质谱鉴定
马铃薯晚疫病菌受氮饥饿处理后的分泌蛋白,经label-free非标记定量蛋白质组鉴定,共有5615个肽段数和相对应的1188个蛋白质被鉴定。该试验进行3次独立的生物学重复。
在这些蛋白质中,以LFQ值用于表征蛋白质丰度,以比值(氮饥饿/对照)大于2.0且P值小于0.05定义为表达量上调,比值小于0.5且P值小于0.05定义为表达量下调。氮饥饿处理马铃薯晚疫病菌相对对照其分泌蛋白共差异表达61个,其中41个蛋白质表达量上调,20个蛋白质表达量下调(表1)。

表1 差异蛋白质点的鉴定结果
续表1 Continued table 1

登录号IDs蛋白质Proteins分子量 (kDa)Molecular mass覆盖率( %)Coverage表达量变化ChangeTMHsWoLF PSORTD0NUH0转谷氨酰胺酶诱导子77.748.800.350SecretedCON__P41361抗凝血酶52.3514.600.230Endoplasmic reticulumD0MXH1碳水化合物结合蛋白60.446.000.310SecretedD0MXT1内切-1,3-β-葡聚糖酶88.9510.900.460SecretedCON__P00761胰蛋白酶24.4125.100.260-D0MRF1碳酸酐酶37.0314.500.470MitochondrialCON__P35908角蛋白65.8759.100.390MitochondrialCON__P13645角蛋白59.5150.400.320nuclearD0NMR0黄素氧还蛋白20.9548.500.500CytoplasmicCON__Q0IIK2转铁蛋白77.749.200.230SecretedCON__P02533角蛋白51.6244.300.320NuclearCON__P13647角蛋白62.3836.300.340NuclearD0MWU3 未知蛋白26.7724.600.360CytoplasmicD0MX07NUK681.5917.300.300nucleolarD0NPM8二聚二氢二醇脱氢酶38.2521.000.330MitochondrialD0ND14未知蛋白22.2742.900.361SecretedD0MXW5组蛋白H315.3416.900.460NuclearD0N6Y2未知蛋白42.2919.400.350SecretedCON__Q86YZ3角蛋白282.3922.200.380NuclearCON__P08779角蛋白51.2745.500.240Nuclear
2.2 亚细胞定位分析

图1 差异蛋白的亚细胞定位分析Fig.1 Subcelluar location of differently proteins
由图1可知,61个差异表达蛋白质定位在细胞的6个部位,其中在质膜和内质网的蛋白质各有1个;细胞核上的12个,比例高达19.67 %;细胞质上的22个,比例高达36.07 %;分泌的15个,比例高达24.59 %;线粒体上的9个,比例高达14.75 %;还有1个蛋白预测不了所处位置。
2.3 差异表达蛋白的GO功能分析
使用GO功能分类系统对61个差异蛋白进行生物过程、分子功能和细胞位置分类(图2),以明确差异表达蛋白参与行驶的功能。这61个蛋白中大多数蛋白主要参与生物过程中的细胞过程(19.67 %)、代谢过程(13.11 %)和细胞成分组织或生物起源(11.48 %);分子功能中的捆绑(32.79 %)和水解酶活性(11.48 %);细胞位置中的细胞质(13.11 %)。
2.4 KEGG代谢途径分析
使用KEGG在线工具对61个差异表达蛋白进行代谢途径分析,以确定它们分别参与哪几类生化代谢途径。KEGG分析表明61个差异表达蛋白共参与28个代谢途径。其中DOMUR6、DOMX78、DOMYA3、DON3B2、DON096和DONME3共6个蛋白参与碳代谢途径,并且前4个蛋白还参与氨基酸的生物合成。另外,DOMZN9、DONBG4、DONBZ4、DONLP0 4个蛋白共同参与核糖体代谢。参与氮代谢的仅有DOMRF1蛋白。说明氮饥饿环境下主要影响马铃薯晚疫病菌株的碳代谢。
2.5 差异蛋白间相互作用网络图谱
61个差异表达蛋白通过STRING在线分析表明53个蛋白之间有密切的蛋白间相互作用关系,构成结构复杂的差异表达蛋白相互作用网络图。聚类分析表明53个差异表达蛋白可分为3类(图3)。PITG_08718、PITG_09345、PITG_03221、PITG_13312、PITG_19178、PITG_09431这6个蛋白聚为一类。蛋白PITG_07328、PITG_07048、PITG_05636、PITG_13614、PITG_02785、PITG_02049、PITG_03698、PITG_11913、PITG_04065聚为一类。剩下的39个蛋白为一类。
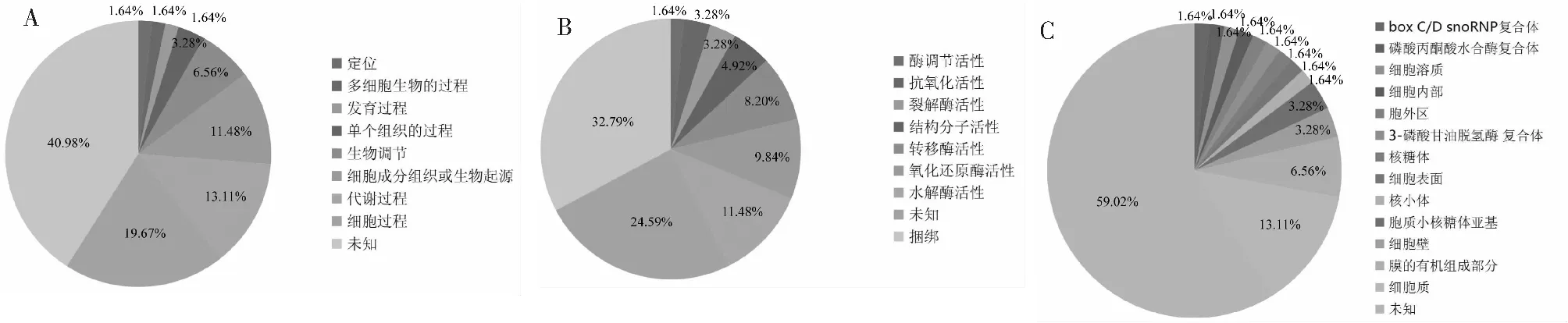
A:生物过程;B:分子功能;C:细胞位置A:Biological process;B:Molecular function;C:Cellular component图2 差异表达蛋白的GO分析Fig.2 The GO analysis of differentially expressed proteins

图3 差异表达蛋白的聚类互作网络图Fig.3 Clustering network map of the differentially expressed proteins
3 讨 论
效应子被定义为发病相关蛋白,能够促进感染和/或引发防御防御反应。细胞质效应子干扰植物细胞中的植物免疫。在效应子的毒力功能中起重要作用[15-18]。例如,来自致病疫霉的SNE1和CRN8可以改变宿主细胞生理学[17,19-20]。CRN效应物首先在致病疫霉中鉴定出来,可以诱导植物叶片皱缩和细胞死亡[21]。CRN效应子在N-末端具有信号肽,接着是保守的FLAK(苯丙氨酸-亮氨酸-丙氨酸-赖氨酸)基序和可变的C-末端。许多先前的研究表明CRN效应子的主要活性是诱导植物细胞死亡[22]。致病疫霉的CRN1和CRN2可导致植物细胞死亡[21]。然而,近期研究表明,只有少数CRN效应物可以引发植物细胞死亡[23-24]。大多数CRN效应子可以抑制由PAMP或诱导子引发的细胞死亡[23]。最近研究显示,CRN效应子可通过靶向不同的亚核区室和改变宿主细胞信号传导来获得毒力[24]。笔者研究在氮缺乏条件下,鉴定了2种不含信号肽的CRN效应子高效表达,分别比对照高出5.7、2.2倍。它们都位于细胞质中。否具有致病性尚不清楚,需要进一步研究。另外,碳代谢在生物体中有着重要作用,在氮饥饿情况下,碳代谢相关的6个蛋白质都高效表达,说明生物体能通过碳代谢弥补氮代谢的不足,但是否对致病性有影响尚待研究。
4 结 论
氮源提高致病性蛋白的分泌,影响马铃薯晚疫病菌的致病性。
