片剂水分活度迁移规律与载荷微生物生长状况研究*
2019-11-14呼延婷婷绳金房
闵 红,杨 静,呼延婷婷,绳金房
(陕西省食品药品监督检验研究院,陕西 西安 710065)
水分活度(aw)指样品中水分的饱和蒸气压与相同温度下纯水的饱和蒸气压的比值[1]。样品中的水可分为结合水和自由水两类,只有自由水能被微生物生长、繁殖、孢子萌发所利用。aw反映产品中微生物新陈代谢的可利用水(结合水)的量度,其值介于0~1[2]。目前,aw常用的3种方法为露点/冷面镜法、电子湿度计法和相对平衡湿度法。其中,露点/冷面镜法具有精确度高(±0.003)、检测速度快(< 5 min)、检测范围广(0.03 ~ 1.00)、准确度高、稳定性好等优点[3-4],是美国药典41版(USP 41)、欧洲药典第九版(EP 9.0)、日本药局方 2016年版(JP 2016)、美国分析化学家协会(AOAC)、国际标准化组织(ISO)等机构推荐使用的aw测定方法。2015年版《中国药典》尚未收载此内容,这与我国药品生产质量管理规范(GMP)强调的药品微生物质量源头设计(QbD)和过程控制的理念不相适应。本研究中将药品分别置aw为 0.328,0.529,0.753,0.902,0.973 的密闭环境中,对药品aw和载荷微生物的生长规律进行研究,揭示将样品储存于不同aw环境下的水分迁移规律及样品载荷微生物变化规律。本研究内容填补了国内药品aw研究的空白,为制订《中国药典》“非无菌制剂水分活度测定的应用指导原则”奠定了理论基础。现报道如下。
1 材料与方法
1.1 材料
仪器:HFsafe-1200LC型生物安全柜(上海力申科学仪器有限公司);SHA-C型水浴恒温振荡器(天津鑫博得仪器有限公司);LRH-250F型生化霉菌培养箱(上海一恒科学仪器有限公司);涡旋混合器(德国IKA公司);Aqualab型水分活度仪(美国Decagon公司)。
菌株:金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、大肠埃希菌(Escherichia coli)[CMCC(B)44102]、白 色 念 珠 菌 (Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003],均购自中国医学细菌保藏管理中心,工作用菌株为第3代。
试药:妇康片(陕西东泰制药有限公司,批号为8E01,规格为每片0.5g);胰酪大豆胨琼脂培养基、胰酪大豆胨液体培养基(TSA)、沙氏葡萄糖琼脂培养基(SDA)、沙氏葡萄糖液体培养基,均购自北京陆桥技术有限公司。
1.2 方法
1.2.1 微生物限度方法适用性试验
为了模拟药品微生物的自然污染状态,将药品置于非洁净区环境进行生产,造成环境中细菌、霉菌和酵母菌对该药品的污染。称取样品10 g,分别加入胰酪大豆胨液体培养基至100 mL,200 mL,45℃水浴15 min,振摇使其分散均匀,制成1∶10和1∶20供试液。计数方法适用性试验分试验组、供试品对照组和菌液对照组,进行3次平行试验。
1)试验组取1∶10供试液分装于5个无菌试管中,每管装量为9.9 mL,再分别加入含菌量不大于104cfu/mL的金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、白色念珠菌、黑曲霉试验菌液各0.1 mL,混匀,得样品液。
2)供试品对照组取供试液原液9.9 mL,加入胰酪大豆胨液体培养基0.1 mL,混匀,得样品液。
3)菌液对照组取胰酪大豆胨液体培养基分装于5个无菌试管中,每管装量为9.9 mL,同试验组操作,分别加入含菌量不大于104cfu/mL的金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、白色念珠菌、黑曲霉试验菌液各 0.1 mL,混匀,得样品液。
取制备好的试验组样品液1 mL,置直径为90 mm的无菌平皿中,注入温度不超过45℃熔化的培养基约20 mL,其中,金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌注入TSA,白色念珠菌和黑曲霉注入SDA,混匀,凝固,按规定条件倒置培养、计数。同法测定供试品对照组及菌液对照组菌落数,观察各组的平均菌落数,计算各试验菌回收率。各试验菌回收率=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数。各试验菌回收率不得低于50%,否则需继续进行方法适用性试验,直至消除供试品的抑菌性。
1.2.2 不同环境aw的制备
将不同质量氯化钠加入500 mL纯化水中,分别制成 aw为 0.328,0.529,0.753,0.902,0.973 的氯化钠溶液,分别加入相应干燥器中,制备 aw分别为 0.328,0.529,0.753,0.902,0.973 的储存环境。
1.2.3 aw、需氧菌总数、霉菌与酵母菌总数测定
准确称取10 g药品置小平皿内,共称取36份,将其放入aw为0.328的干燥器中,同法分别将样品置aw为 0.529,0.753,0.902,0.973 的干燥器中,在 25 ℃条件下密闭储存3个月,从0周开始,每周对样品aw、需氧菌总数(TAMC)、霉菌与酵母菌总数(TYMC)进行检测。TAMC和TYMC检测方法为2.1项下微生物限度方法适用性试验得出的检测方法。
1.3 数据分析
采用SPSS 13.0软件对试验数据进行描述性统计与分析,揭示将样品在不同aw环境下储存水分的迁移规律及载荷微生物变化规律。
2 结果
2.1 TAMC及TYMC适用性试验
取1∶10供试液制得的样品液各1 mL倾注平皿,按“非无菌产品微生物限度检查项下计数检查法(通则1105)”检查,发现铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉回收比值在0.5~2.0之间,金黄色葡萄球菌回收比值不足0.5,不可取;当取1∶20供试液制得的样品液各1 mL倾注平皿,金黄色葡萄球菌的回收比值为0.8,0.9,0.8,可取。结果见表 1。然后在平皿中加入TSA,摇匀,待凝固后置 35℃条件下培养 5 d进行TAMC计数。
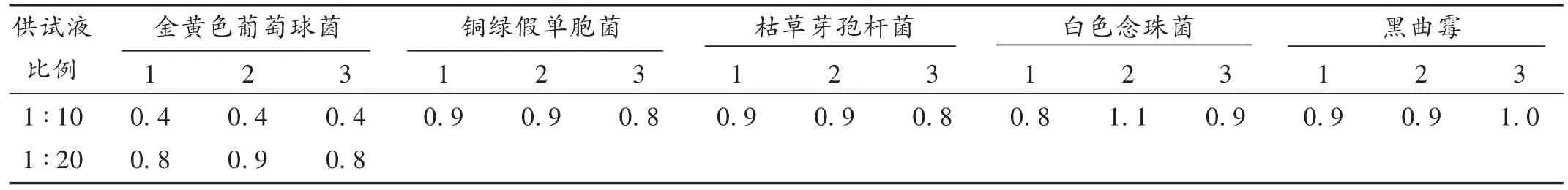
表1 TAMC方法适用性试验各试验菌回收比值
取1∶10供试液制得的样品液1 mL倾注平皿,按照“非无菌产品微生物限度检查计数检查法(通则1105)”检查,发现白色念珠菌和黑曲霉试验菌的回收比值均在 0.5~2.0之间,可取。结果见表 2。然后在平皿中加入SDA,摇匀,待凝固后置25℃条件下培养7 d进行该TYMC计数。

表2 TYMC适用性试验各试验菌回收比值(n=3)
2.2 aw的迁移规律
药品aw随时间变化的曲线见图1 A。可见,药品储存于 5 种不同 aw(0.328,0.529,0.753,0.902,0.973)环境,样品aw在第1周表现出急剧增加,随后缓慢增加,并逐渐与环境aw趋于一致。
当 环 境 aw分 别 为 0.328,0.529,0.753,0.902,0.973时,药品储存1周的 aw较初始值分别增加了9.34% ,62.63% ,111.49% ,149.22% ,160.28% 。样品储存1周后的aw随时间的延长缓慢增加,并逐渐与环境aw保持一致,当环境aw为0.328时,药品aw在第1周就达到0.347,1周后随着储存时间的延长,药品aw无显著性变化;当环境 aw为0.529时,药品aw在第2周达到0.538,2周后随着储存时间的延长,药品aw无显著变化;当环境aw为0.753时,药品储存12周的aw为0.755;当环境 aw为 0.902 和 0.973 时,药品储存 12 周的aw分别为0.901和0.954,药品aw需要更长的储存时间才能与环境aw保持一致。表明药品aw低于其储存环境aw时的水分迁移规律,即药品aw最终与其储存环境aw保持一致,环境aw越大,药品达到环境aw所需时间越长。
2.3 TAMC及TYMC变化规律
将样品置低 aw环境时(aw为 0.328 和 0.529),样品TAMC和TYMC随时间的延长有降低趋势。当环境aw为 0.328时,样品 TAMC 数量在第 10,11,12周分别较初始值降低 6.57%,5.36%,10.51%;样品 TYMC 数量在第 8,9,10,11,12 周分别较初始值降低 2.75% ,8.01% ,14.79% ,14.79% ,9.95% ;当 aw为 0.529 时,样品 TAMC 在第 8,9,10,11,12 周分别较初始值降低4.62%,2.94% ,15.29% ,4.26% ,13.75% ,样品 TYMC在第 7,8,9,10,11,12 周分别较初始值降低 9.95% ,11.03% ,17.89% ,4.76% ,9.95%,4.76%。将样品置较高 aw环境时(aw为 0.753,0.902,0.973),样品 TAMC和TYMC随时间的延长呈现平稳趋势,样品TAMC和TYMC无显著变化。分析原因为,药品置较高aw环境时(aw为 0.753,0.902,0.973),该环境 aw能达到微生物生长条件,但妇康片的成分为益母草、延胡索(醋制)、阿胶、当归、人参、熟地黄、白芍(酒制)、川芎、白术(炒)、茯苓、炙甘草,不能提供微生物生长所需要的氮源、碳源、无机盐、生长因子等营养成分,故在环境aw较高时,药品污染的TAMC和TYMC无显著性变化,而样品置低aw环境时(aw为 0.328 和 0.529),除了药品成分不能提供营养,环境aw也不能满足微生物生长代谢所需的最低水分子要求,初始污染微生物逐渐死亡,TAMC和TYMC较初始值缓慢减低。详见图1 B及图1 C。

图1 药品在不同aw环境储存的aw、TAMC、TYMC随时间变化的曲线图
3 讨论
3.1 指标价值
aw影响微生物代谢活性,大多数微生物的代谢活动需要水分子参与,aw的降低会导致微生物的代谢活性降低[5]。微生物在aw较高时生长较旺盛,在aw较低时生长缓慢,每种微生物都有1个临界aw,当样品aw低于该临界值时,微生物不能正常生长繁殖[6],数量逐步衰减直至死亡,最后该样品达到无菌状态。如铜绿假单胞菌、大肠埃希菌、沙门氏菌等革兰阴性菌在aw低于0.91时不能增殖(甚至不能存活);金黄色葡萄球菌等革兰阳性菌在aw低于0.86时不能增殖;黑曲霉在aw低于0.77时不能增殖;嗜渗酵母和耐旱真菌在aw低于0.60时不能增殖[7]。aw对微生物的致死作用,与微生物细胞内外的aw息息相关,当微生物处在低于临界aw环境时,细胞内水分就会瞬间流失,伴随细胞内细胞质体积的缩小,从而导致细胞的质壁分离[8-9]。
aw是控制微生物污染风险和维持稳定性的关键因素。传统工艺中常将食品控制在较低aw范围内,从而抵制由微生物导致的腐败变质,例如干制水果、糖浆剂、和腌制肉、蔬菜等低aw食品具有自我保鲜能力[9-10]。将药品aw控制在较低范围内,同样可阻止自身及环境污染微生物的生长繁殖,然而,将aw应用于药品微生物控制的研究较少,仅有少量国际药品企业在新药研发阶段,将aw作为控制微生物污染的重要参数进行研究,确保药品质量的稳定性,而该研究在国内药品领域尚属空白。
3.2 控制药品aw的意义
aw是控制药品微生物污染风险和维持药品稳定性的关键因素[11-13]。USP 41指出,药品aw的降低可提高药品的抑菌性,阻止微生物增殖;减少处方对微生物污染的敏感性;减少处方中活性成分水解;为减少微生物限度和控制菌检查频次的参数放行提供支持;并为微生物风险控制提供一种替代方法。
3.3 如何在药品生产和储存过程保持低aw
在药品研发过程,aw可作为固定参数指标优化处方,降低处方中aw,提高药物制剂的抑菌性,通过在处方中改变氯化钠、蔗糖、酒精、丙二醇或甘油的浓度达到降低药品aw的目的。USP 41指出,加强包装研究,以确保包装密闭性,从而有效防止环境水分子在储存过程进入药品,导致药品在aw的增加。
根据药品的性质和要求,GMP规定常温储存库保持10~30℃,相对湿度为45% ~75%,冷藏库保持2~10℃,阴凉库温度不超过20℃,阴暗库温度不超过20℃并保持避光[14]。储存环境湿度较高,空气中的水蒸气就会被一些药品吸收,导致药品变潮湿,从而发生霉变、潮解、稀释及变形等,储藏环境湿度比较低,药品中的结晶水就会被蒸发而导致风化[15]。本研究中将药品储存于5种不同aw环境中,由于药品本身的aw低于这5种环境aw,导致药品吸收环境中的水蒸气,药品aw表现出在第1周急剧增加,随后缓慢增加,并逐渐与环境aw趋于一致的变化规律。
3.4 低aw药品的参数放行
当药品aw足够低,可通过对药品的风险评估决定是否减少或取消微生物限度和控制菌检查频次的参数放行。风险评估内容包括药品原料、水、生产过程、处方和包装系统微生物风险控制的有效性证明文件,以及对药品研发、生产、过程验证及大量批次(至少20批)上市样品常规试验的历史数据[14]。
事实上,非水溶性液体制剂和固体制剂等许多非无菌药物制剂几乎没有微生物污染的可能性,分析其原因可能为这些药物制剂本身aw较低,不适合孢子萌发和微生物生长[16]。妇康片的初始aw仅为0.317,将药品置低aw环境时,样品TAMC和TYMC随着时间的延长有降低趋势,而置较高aw环境时,样品TAMC和TYMC随着时间的延长呈现平稳趋势。因此,对该类药物制剂进行微生物参数控制的意义不大,可考虑根据历史检测数据和有效证明文件进行微生物指标的参数放行,或采用aw取代微生物指标的检测。aw检测具有操作简便、成本低、周期短等优点,一般检测1次药品aw约需30 min,而检测微生物指标的时间为5~7 d。采用药品aw替代微生物指标可显著减少药品放行周期,加快样品流转速度,降低库存成本和检验费用,提高药品生产产值,实现从终端控制到源头过程控制的理念。
