腺泡状软组织肉瘤的磁共振成像表现及临床病理学分析
2019-11-11郭晓丽石慧娴张洪英吴晶涛
高 慧,韩 雷,郭晓丽,石慧娴,张洪英,吴晶涛
1.大连医科大学,辽宁 大连 116044;
2.扬州大学临床医学院,江苏 扬州 225001;
3.苏北人民医院影像科,江苏 扬州 225001
腺泡状软组织肉瘤(alveolar soft part sarcoma,ASPS)属于罕见的恶性软组织肿瘤,发病率不高,组织起源尚未明确,占软组织肉瘤的0.5%~1.0%[1],年轻女性多见,好发于15~35岁[2]。ASPS多见于深部软组织,生长缓慢,早期不易发现,患者多因无痛性肿块渐进性增大就诊。ASPS血供丰富,早期易发生转移、预后差,因其罕见,术前常缺乏完整的影像学资料,临床认识不足,易导致误诊。本研究分析总结ASPS的磁共振成像(magnetic resonance imaging,MRI)表现和病理学特点,以期提高临床对其诊断的准确率。
1 资料和方法
1.1 一般资料
收集苏北人民医院2011年—2018年经手术后病理学检查证实的ASPS患者6例,其中男性1例,女性5例,年龄12~28岁,中位年龄23岁。1例因舌部麻木、有压迫感就诊,其余均因无痛性肿块就诊;1例首诊时已发生肺转移。患者均行常规MRI检查,其中2例行MRI增强扫描。
1.2 检查方法
采用美国GE公司的Discovery MR750 3.0 T超导磁共振扫描仪,常规MRI检查包括压脂或不压脂轴位、冠状位及矢状位检查。T1WI序列:回波时间(echo time,TE)为1.5~14.7 ms,重复时间(repetition time,TR)为150~340 ms;T2WI序列:TE为86.6~115.0 ms,TR为3 000~ 4800 ms。层厚5.0 mm,层间距1.0 mm,矩阵256×l92~384×224,视野24 cm×24 cm~ 26 cm×26 cm。MRI增强扫描选择T1WI压脂轴位、矢状位,注射钆喷替酸葡甲胺作为对比剂,剂量为0.1 mmol/kg,流率为2 mL/s。
2 结 果
6例患者中,3例ASPS发生于四肢深部(其中1例位于右下肢股外侧肌和股中间肌二者的间隙中,1例位于右肩部皮下,1例位于右前臂桡背侧),2例发生于舌根部,1例发生于左耳前;瘤体最大径为25~80 mm。
常规MRI检查可见圆形或类圆形肿块,体积较大,浅分叶状。其中5例患者肿块边界较清晰,1例边界稍模糊(图1)。T1WI序列与邻近肌肉信号相比,5例呈稍高信号,1例呈等信号;T2WI序列均表现为不均匀高信号,内部和外周伴有低信号粗大、迂曲的流空血管影(图1~3)。周围骨质未见明显受侵及破坏征象。2例行MRI增强扫描,增强后强化明显(图2~3),其中1例发生于舌根部的肿瘤周边可见一圈明显的环形高信号(图3)。
病理学及免疫组织化学检查结果:肿瘤标本长径约25~80 mm,境界较清,切面灰白、质韧,可见包膜;镜下肿瘤细胞呈多角形,核圆,有明显的核仁,胞质丰富,掺杂嗜伊红颗粒,呈器官或腺泡状排列,瘤巢有一定的纤维组织间隔,血管量大,血管腔内有明显的肿瘤组织(图1~2)。 免疫组织化学染色结果:TFE3阳性率3/3(阳性率100%),CD34阳性率1/6,CD99阳性率1/6,MyoD1阳性率3/6(其中1例弱阳性),NSE阳性率4/6(其中2例灶区阳性)。
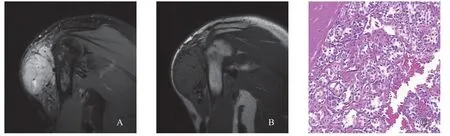
图1 典型病例1(女性,27岁)的MRI影像图及病理学观察
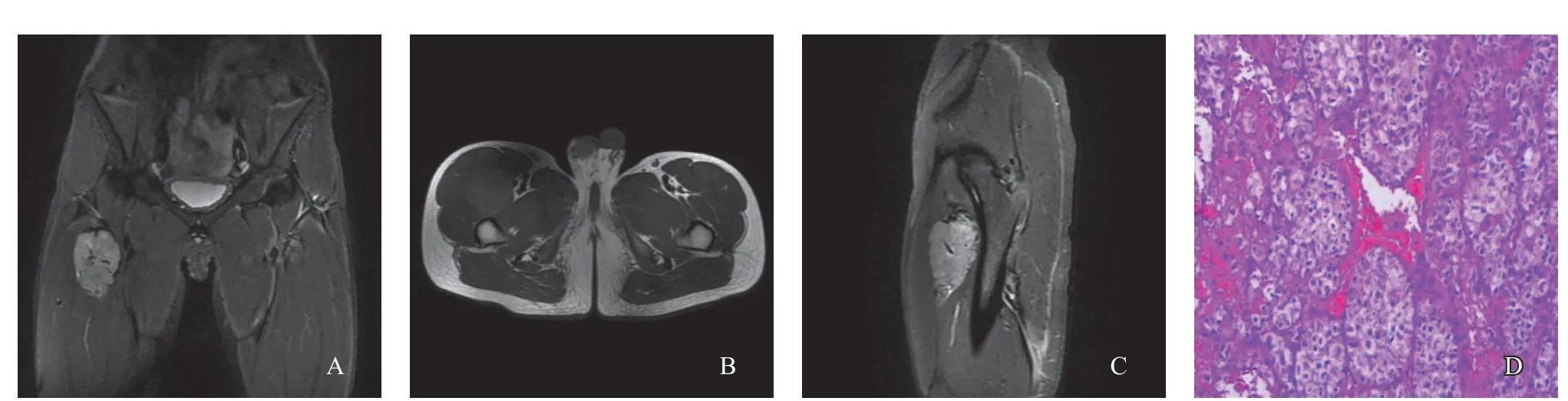
图2 典型病例2(男性,18岁)的MRI影像图及病理学观察

图3 典型病例3(女性,28岁)的MRI影像图
随访结果:6例患者均行手术切除治疗,随访时间为16个月至8年。术后2年内,4例患者发生转移(其中2例患者肺部转移,1例骨转移,1例肺及脑多发转移),1例术后复发,1例目前尚未发现转移及复发征象。
3 讨 论
ASPS属于起源不明的软组织恶性肿瘤,大多学者支持肌源性观点。ASPS发病率低,年轻女性多见,好发于15~35岁。成年患者ASPS常出现在四肢深处的软组织中,少见于头颈、纵隔、盆腔等部位;儿童患者患病区域常见于头部和颈部,例如舌头及眼眶[3]。本研究中,发生于舌部的2例患者年龄分别为26和28岁,极为罕见。ASPS生长缓慢,病程长,患者多因发现无痛性肿块有渐进性增大的趋势就诊,且术前通常被认为是良性肿瘤,直到出现压迫症状才逐渐引起患者重视。亦有患者因肺部转移或脑转移引起的继发症状就诊。因其血供丰富,故首诊伴转移的发生率较高,后期发生转移概率也很大,接近50%,可转移到肺部、大脑和肝脏等部分,淋巴结转移者少见[4]。肺转移患者最多,达42%~65%;脑、骨转移次之;约10%的患者可能出现淋巴结转移[5]。
ASPS患者MRI表现为软组织深处较大的肿块,边界较清晰。T1WI序列与周围肌肉组织相比表现为稍高或等信号,T1WI信号稍高可能与肿瘤内血窦丰富,且血流缓慢有关,为ASPS特征性影像学表现。T2WI序列均表现为不均匀高信号,肿瘤内部及外周有多发迂曲、粗大的流空血管影,为ASPS的典型影像学特征。肿瘤内组织结构复杂,可见坏死及出血,导致水分子扩散受限,故扩散加权成像(diffusion-weighted image,DWI)呈高信号。程玉书等[6]的研究显示,眼眶ASPS与邻近眼外肌分界不清,与本研究1例发生于肩部的患者表现相似,体现了肿瘤的侵袭性,说明ASPS易于向周围组织浸润生长,即边界是否清楚与恶性程度相关(边界越模糊提示肿瘤的恶性程度越高)。部分ASPS在T2WI序列上还可表现出外周环形高信号影,且增强后有明显强化,这说明瘤周有肿瘤细胞浸润[7]。另外,ASPS的不均匀强化与其恶性程度也密切相关,因为恶性肿瘤组织学特征是低分化、成分复杂,且常伴有出血、坏死,从而导致强化不均匀[8]。
ASPS呈膨胀式生长,肿瘤较小时可推挤外周组织。肿瘤细胞呈腺泡状排列,这些腺泡状结构间覆有丰富的血管内皮细胞,因此肿瘤内血供丰富[9]。因为肿块无包膜,肿瘤体积增大后,外周组织也会受侵袭(如血管、淋巴等),表现出侵袭性生物学特征,发生远处转移的概率较大[10]。免疫组织化学染色TFE3有较高的灵敏度,本研究共3例患者进行了该项标志物检测,结果均呈阳性,其遗传学特征为一个染色体易位到17号染色体侧位,而X染色体短臂能够和17号染色体长臂之间出现易位[der(17)t(X;17)(pl1;q25)];该种染色体易位,能够促使TFE3基因和17号染色体上的新基因ASPL进行融合,而融合基因不受制于X染色体的失活[11],故我们猜测其与女性好发这一特点关系密切,尚待进一步研究证实。
ASPS治疗原则上应早期行肿瘤广泛切除术,肿瘤对放化疗不敏感。临床上,常选择生物靶向疗法,但费用昂贵,少有患者能坚持,且疗效尚未得到证实。若患者肿瘤已发生转移,病灶不可切除时,5年生存率只有20%,中位生存时间为40个月[12]。ASPS预后较差,肿瘤发生的部位、范围、边界清楚与否,以及是否发生转移是判断预后的至关重要的因素。
ASPS需要与下列几类疾病相鉴别:① 恶性纤维组织细胞瘤,源自间叶组织,中老年多见,常见于四肢,尤其是下肢,以软组织深处为主,体积大,有清晰的边界,T1WI序列呈等或低信号。而T2WI序列呈现混杂高信号,肿瘤中有明显的分隔、囊变、坏死或出血。MRI增强扫描可见中等及以上不均匀强化[13]。② 横纹肌肉瘤,发病年龄较小,20岁以上发病者较少见,肿块生长迅速,具有较大的侵袭性,MRI表现为等T1、稍长T2信号,增强扫描后无显著强化。③ 动静脉畸形,缺乏实性成分,T1WI和T2WI序列均表现为低信号、迂曲的流空血管影呈团块状聚集,增强扫描呈“快进快出”。④ 滑膜肉瘤,发生人群以青壮年为主,常见于四肢深部,特别是膝关节。MRI表现为T1WI、T2WI均观察到稍高信号,肿瘤内部没有明显的流空血管影。T2WI上常有三信号征:高信号区代表囊变成分,等信号为实性成分,低信号表示纤维成分和钙化[14]。⑤ 血管外皮细胞瘤,瘤体常呈分叶状,境界清楚,常见血管流空、坏死及出血,磁共振信号不均匀,肿瘤T1WI序列可表现出等信号,有时也可呈等低信号,而T2WI序列则表现出等信号,有时为稍高信号。增强后可见延迟强化。
本研究纳入的样本数较少,有明显的局限性。当年轻人发现软组织深处有较大肿块,且境界较清晰,T1WI序列表现出稍高或等信号,T2WI序列呈高信号并观察到肿瘤内部及外周有多发粗大、迂曲的流空血管影,早期发生转移时,应考虑ASPS的可能。
