脑膜瘤的MRI特征与Ki-67指数相关性研究
2019-11-09谢彬王洪正王浩
谢彬 王洪正 王浩
[摘要] 目的 探讨脑膜瘤的各项MRI特征与Ki-67指数的相关性。 方法 通过回顾性分析111例经病理组织学证实的颅内脑膜瘤病例,将病例的临床表现、术前影像学和组织学结果进行统计学分析。 结果 在111例脑膜瘤病例中,组织学结果:79例为WHOⅠ级,21例为WHOⅡ级,11例为WHOⅢ级肿瘤。Ki-67表达分级:阴性、弱阳性、中阳性和强阳性分别为60例、27例、7例和17例。综合磁共振特征分级后,采用序贯Logistic回归模型,发现表观弥散系数(ADC)值、坏死和T2加权MRI上蛛网膜破裂是Ki-67高表达的独立预测因子。 结论 ADC值越低,坏死及T2加权的蛛网膜破裂等影像学特点可能预示着脑膜瘤存在高增殖性。
[关键词] 脑膜瘤;Ki-67;磁共振;表观弥散系数;坏死
[中图分类号] R651 [文献标识码] A [文章编号] 1673-9701(2019)23-0011-04
[Abstract] Objective To investigate the correlation between MRI characteristics and Ki-67 index of meningioma. Methods 111 cases of intracranial meningioma who were confirmed by histopathology were retrospectively analyzed. The clinical manifestations, preoperative imaging and histological results of the cases were statistically analyzed. Results In 111 cases of meningioma, histological findings: 79 cases were in WHO grade Ⅰ, 21 cases were in WHO grade Ⅱ, and 11 cases were in WHO grade III tumor. Ki-67 expression grading: there were 60 negative cases, 27 weak positive cases, 7 medium positive cases and 17 strong positive cases respectively. After the comprehensive grading of magnetic resonance characteristics, a sequential logistic regression model was used to find that the apparent diffusion coefficient(ADC)value, necrosis and T2-weighted MRI upper arachnoid rupture were independent predictive factors of high Ki-67 expression. Conclusion Imaging characteristics such as lower ADC value, necrosis and T2-weighted arachnoid rupture may indicate the high proliferation of meningioma.
[Key words] Meningioma; Ki-67;Magnetic resonance imaging;Apparent diffusion coefficient(ADC);Necrosis
腦膜瘤占所有原发性颅内肿瘤的20%~32%。根据世界卫生组织2016年的分类系统,脑膜瘤分为三个等级。WHOⅡ级(非典型)和Ⅲ级(间变性)脑膜瘤在临床和组织学上比WHO Ⅰ级病变更具侵袭性[1]。有人提出,使用免疫组织化学标记物,即增殖标记物(Ki-67),将对脑膜瘤侵袭行为有一定的帮助。Ki-67有助于评估脑膜瘤的侵袭力,是判断脑膜瘤预后的有用生物标记物[2]。同时有许多研究也明确了与脑膜瘤侵袭行为相关的MRI放射学参数[3-5]。本研究的主要目的是探讨脑膜瘤的MRI特征与Ki-67指数的关系,并进行相关性分析。
1 资料与方法
1.1 一般资料
收集2012年1月~2018年10月共111例经病理组织学证实的颅内脑膜瘤病例。对每例患者的病历、术前影像学和组织学结果进行回顾性分析。根据2016年世卫组织脑膜瘤分类系统,对所有手术标本的组织病理学切片进行了重新评估,并对组织病理学诊断进行了重新分类。
1.2 影像分析
患者均使用西门子1.5T Aera超导型磁共振机进行MRI检查。MRI包括以下序列:T1加权图像、T2加权图像、Flair图像。利用截面厚度为5 mm的B值1000 s/mm2在轴面上获得弥散加权成像(DWI)磁共振成像,在Siemens Synogo工作站中通过人工将感兴趣区域(ROI)放置在B=1000的ADC图上的各个肿瘤部位,由对肿瘤分级不清的的合作者确定ADC值。ROI被有意放置在肿瘤中心,并避开囊性、坏死和出血区域。根据ADC图上的3~5个ROI,计算每个肿瘤的ADC值。同时收集了注射0.1 mmol/kg 的磁共振造影剂(Gd-DTPA)后的轴位、冠状位和矢状位T1加权图像。
本研究分析的术前MRI参数包括:肿瘤位置(颅底与凸面)、肿瘤大小(<3 cm、3~5 cm、>5 cm)、肿瘤形状(不规则形状或规则形状)、T1加权信号(与灰质相比高、低或等强度)、T2加权信号(与灰质相比高、低或等强度)、T1加权增强成像(均匀或不均)、ADC值、Flair信号(与灰质相比高、低或等强度)、肿瘤周围水肿(PTE)、t2加权MRI上的蛛网膜层(完整或破坏)、肿瘤坏死。坏死成分为增强T1加权图像上增强病变范围内的非增强部分。
1.3 免疫组化
石蜡包埋切片用于染色,切片为4 μm层厚连续切割。在去石蜡化和再水化后,在氯化钠缓冲液(pH6.0)中加热20 min。通过在3%过氧化氢中培养10 min来阻断过氧化物酶。用小鼠单克隆抗Ki-67(稀释液1:500,Abcam公司,AB6526)在4℃培养过夜。在用PBS洗涤后,将载玻片与Dako Realtm enVision TM/HRP兔/小鼠(env)试剂(k-5007,Dako,Glostrup,丹麦)一起培养。使用DAB显色剂进行1-3 min的染色。用苏木精复染切片,脱水,然后用中性树胶封片。阴性对照组用磷酸盐缓冲液(PBS)代替主要抗体。
切片由2位病理科医生用双盲法进行阅片。对于Ki-67染色,他们从5个随机选择的代表性区域(×400)计数细胞。根据阳性细胞的比例对染色进行半定量评价,评价标准:阴性(-)<5%,弱阳性(+):5%~10%,中阳性(++)10%~30%,强阳性(+++)>30%[6]。
1.4 统计学方法
采用SPSS统计软件(Windows版,19.0)对数据进行分析。采用非参数Spearman相关分析和Kruskal-Wallis检验(Mann-Whitney检验)评价免疫组化表达水平与MRI参数的关系。采用单因素方差分析法对不同Ki-67表达水平的ADC值进行评价,采用Logistic逻辑回归模型对预测Ki-67指数较高的因素进行评价,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床结果
本研究包括111例脑膜瘤。男36例,女75例,平均年龄44.3(15~71)岁。WHOⅠ级79例,WHOⅡ级21例,WHOⅢ级肿瘤11例。
2.2 免疫组化结果
60例(54.1%)的手术组织中观察到阴性(-)Ki-67表达样品。弱阳性、中阳性和强阳性分别为27例(24.3%)、7例(6.3%)和17例(15.3%)。
2.3 磁共振成像结果
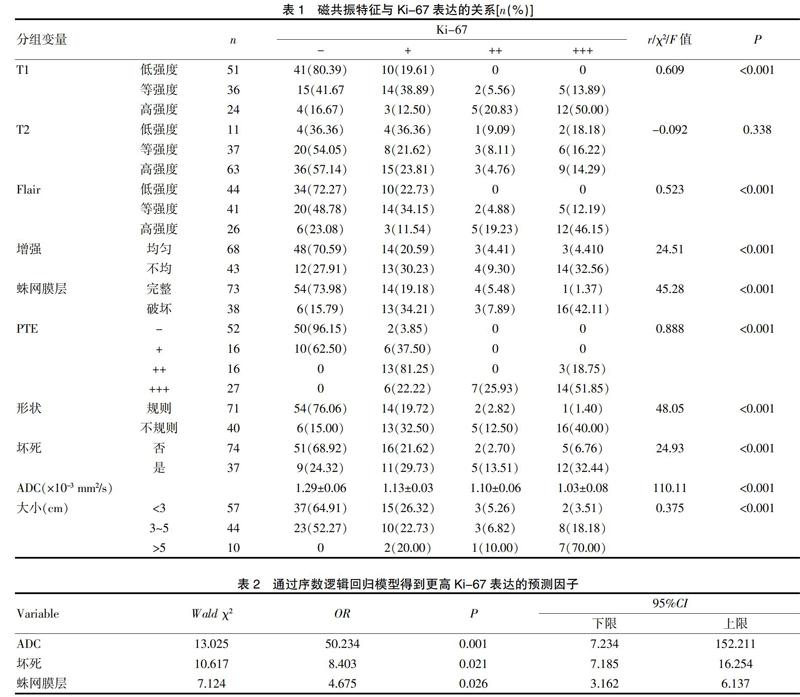
Ki-67表达与术前临床和放射学参数的关系如表1所示。根据T1信号(Spearman相关分析,r=0.609,P<0.001)、Flair信号(Spearman相关分析,r=0.523,P<0.001)、PET(Spearman相关分析,r=0.888,P<0.001)和肿瘤大小(Spearman相关分析,r=0.362,P<0.001),Ki-67的表达有显著差异。在t2加权上蛛网膜层完整性(χ2检验,χ2=45.281,P<0.001)、肿瘤形态(χ2检验,χ2=48.048,P<0.001)、坏死(χ2检验,χ2=24.931,P<0.001)和增强(χ2检验,χ2=24.510,P<0.001)上,Ki-67表达也有显著差异。平均ADC随Ki-67表达的不同而变化,较高的Ki-67表达显示较小的ADC值(单向方差分析,P<0.001)(表1)。
采用序贯Logistic回归模型对术前临床和放射学参数进行进一步分析,以评估这些参数是否能预测Ki-67的表达。发现ADC值(P=0.019)、坏死(P=0.021)和T2加权MRI上蛛网膜破裂(P=0.026)是Ki-67高表达的独立预测因子(表2)。
3 讨论
脑膜瘤是最常见的原发性颅内肿瘤之一。根据世界卫生组织2016年的分类体系,这种组织病理学分类通常用于预测脑膜瘤的临床进程。一些免疫组化参数,包括Ki-67/MIB-1、mmp-9、pr、er,被用作组织病理分级的辅助指标,以预测脑膜瘤预后[7-8]。其他作者已经对脑膜瘤中各种增殖指数的预后意义进行了评估,并认为Ki-67/MIB-1可以在不同的研究中預测患者的临床进程[9]。Ki-67抗原是一种仅在细胞周期(G1、S、G2和M)的活跃阶段存在的核蛋白。在脑膜瘤中使用Ki-67作为预后指标一直是许多研究的主题。大多数(但不是全部)研究发现良性、非典型和间变性脑膜瘤的Ki-67表达存在显著差异,结合放射学特征与组织病理学分级,用来鉴别良性和侵袭性脑膜瘤行为。在弥散加权成像(DWI)和PET中,肿瘤-脑界面消失、瘤周水肿、肿瘤形状不规则、MRI增强不均匀、表观弥散系数(ADC)降低,可预测脑膜瘤的侵袭性[10-12]。
在本研究中,T1信号越高,FLAIR信号越高,瘤周水肿越强,肿瘤越大,T2加权MRI上蛛网膜层被破坏,肿瘤形状不规则,增强存在坏死,ADC值越低,则Ki-67表达越高。在这些参数中,较低的ADC值是Ki-67高表达的最强独立预测因子,其次是T2加权上的蛛网膜不完整。
有研究已经证明[13],DWI的高强度和ADC值的降低预示着脑膜瘤的组织学分级更高。然而,其他研究表明,DWI不能准确预测脑膜瘤的组织病理学分级。Ki-67表达较高的脑膜瘤的特点是肿瘤细胞增多,核/细胞质比率增加,有丝分裂细胞增多,这会限制了水分扩散,因而会表现为较低的ADC值。这与本研究结果中ADC值较低与脑膜瘤侵袭性高正相关是相符合的。另一个与Ki-67高表达相关的MRI特征是T2加权MRI上蛛网膜的破坏,这通常表明脑肿瘤边界不清[14]。Ki-67表达较高的脑膜瘤,包括WHO Ⅱ级和Ⅲ级肿瘤,可以通过肿瘤细胞直接侵入蛛网膜,侵入神经血管组织而进入脑实质。组织病理学侵犯性在MRI上就会表现为脑组织与肿瘤之间的分界不清,蛛网膜界面被肿瘤侵袭破坏。同样,MRI上的坏死是另一个与高Ki-67表达相关的特征。Ki-67表达较高的肿瘤生长迅速,供血不足,导致肿瘤中心坏死。坏死可导致缺氧并增加了诱导缺氧诱导因子-1A(HIF1A),HIF1A 增加了VEGF的表达,进而促进了肿瘤的生长[15]。因此可以解释MRI上的坏死与高Ki-67的正相关性。本研究的临床意义在于术前预测脑膜瘤的行为。首先,具有上述特征的肿瘤需要完全切除,以减少复发;其次,根据MRI特征进行术中冰冻切片诊断,以指导切除的程度;第三,高度怀疑非良性脑膜瘤的患者需要进行术后Ki-67检查。
综上所述,DWI的ADC值越低,T2加权的蛛网膜破裂和坏死可能预示着Ki-67的高表达。对于具有这些特征的肿瘤,可能需要更积极的随访和(或)治疗。
[参考文献]
[1] Louis DN,Perry A,Reifenberger G,et al. The 2016 WHO classification of tumours of the central nervous system:A summary[J]. Acta Neuropathol,2016,131(6):803-820.
[2] Babu S,Uppin SG,Uppin MS,et al. Meningiomas:Correlation of Ki67 with histological grade[J]. Neurol India,2011,59(2):204-207.
[3] Rockhill J,Mrugala M,Chamberlain MC. Intracranial meningiomas:An overview of diagnosis and treatment[J]. Neurosurg Focus,2007,23(4):E1.
[4] 段芙红,白洁,张勇,等. 颅内脑膜瘤ACD值与Ki-67指数和肿瘤细胞计数的相关性[J]. 江苏医药,2018,44(5):556-558.
[5] Alexey S,Daniel TG,Tchoyoson L,et al. Histogram analysis parameters apparent diffusion coefficient for distinguishing high and low-grade meningiomas:amulticenter study[J]. Translational Oncology,2018,11(5):1074-1079.
[6] Rezanko T,Akkalp AK,Tunakan M,et al. MIB-1 counting methods in meningiomas and agreement among pathologists[J]. Anal Quant Cytol Histol,2008,30(1):47-52.
[7] 楊秋雄,林成达,蔡奋忠, 等.脑膜瘤组织中 Ki-67 蛋白的表达及与患者临床病理特征的关系[J].中国临床研究,2018,31(3):362-368.
[8] Henderson VW. Information and misinformation on hormone therapy and meningiomas[J]. Climacteric,2013,16(6):721-722.
[9] 王文阳,卢珍玲,林晓宁,等.Ki-67与脑膜瘤分级及复发的相关性分析[J]. 中国卫生标准管理,2018,9(22):46-48.
[10] 蒋春秀,朱建彬,邹天宇,等. 颅内孤立性纤维瘤/血管外皮瘤与脑膜瘤的临床和MRI对比分析[J]. 中国医学影像技术,2017,33(6):848-852.
[11] Felix S,Daniel S,Damian S,et al. DNA methylation-based classification and grading system for meningioma: A multicentre,retrospective analysis[J]. Lancet Oncol 2017, 18(5):682-694.
[12] Benedito JAP,Sueli MOS,Ant?觝nio NDA,el al. Molecular alterations in meningiomas:Literature review[J]. Clinical Neurology and Neurosurgery,2019,176:89-96.
[13] Fen X,Ning T,Tong SK,et al. MR diffusion kurtosis imaging predicts malignant potential and the histological type of meningioma[J].European Journal of Radiology,2017,95(8):286-292.
[14] Fritz J,Roser F,Tatagiba M,et al. The basement membrane at the tumour-brain interface of brain-invasive grade I meningiomas[J].Neuropathology and Applied Neurobiology,2005,31(3):339-342.
[15] Nassehi D. Intracranial meningiomas,the VEGF-A pathway,and peritumoral brain oedema[J]. Dan Med J 2013, 60(4):1-15.
(收稿日期:2019-03-09)
