早期使用右美托咪定对神经外科ICU清醒患者睡眠质量的影响
2019-11-08周娥李冬娜陈惠璇陈克恩王向宇程龙飞
周娥,李冬娜,陈惠璇,陈克恩,王向宇,程龙飞
暨南大学附属第一医院神经外科重症监护室(广东广州 510630)
重症监护病房(ICU)患者的睡眠质量被认为是重症监护的重要方面。研究发现神经外科重症监护室(NSICU)患者有53.7%~78.6%存在睡眠障碍[1],主要是因为睡眠剥夺(sleep deprivation,SD)和睡眠结构的改变。睡眠剥夺是机体因环境改变而导致睡眠时间和睡眠时相的减少或损失,可能导致谵妄、神经功能障碍、感染、住院时间和病死率增加等[2]。正常的睡眠是由快速眼动期睡眠(rapid eye-movement,REM)和非快速眼动期睡眠(non-rapid eye-movement,N-REM)两个睡眠时相构成并交替出现。右美托咪定是一种新型高选择性α2肾上腺素能激动剂,具有镇静、抗焦虑和辅助镇痛的作用,同时具有神经保护和改善认识功能的作用,其产生的镇静催眠效果接近自然睡眠[3]。本研究对暨南大学附属第一医院NSICU收治的70例清醒患者进行睡眠监测,探讨右美托咪定对其睡眠的影响。
1 资料与方法
1.1 一般资料 选择我院自2017年3月至2018年3月NSICU收治的清醒患者。纳入标准:(1)年龄>18岁且<65岁;(2)无机械通气,纳入者至少连续2个夜晚在NSICU接受治疗;(3)Glasgow评分均>14分,神志清楚,且可言语,对答切题;(4)Riker镇静躁动评分4~5分,未接受镇静药物,且血流动力学稳定;(5)同意参与本研究,并签署知情同意书。排除标准:(1)精神心理疾病患者;(2)既往有长期失眠,需要药物辅助睡眠者;(3)对理查兹坎贝尔睡眠量表(RCSQ)[4]中各项目不能理解者。将70例患者按随机数字表分为观察组和对照组,每组35例。观察组中男19例,女16例,年龄19~64岁,平均(45.79±12.99)岁;对照组中男17例,女18例,年龄18~62岁,平均(43.15±12.15)岁。其中脑出血23例,脑动静脉畸形(AVM) 4例,蛛网膜下腔出血10例,颅脑外伤6例,脑膜瘤6例,慢性硬膜下血肿2例,脑梗死3例,垂体瘤6例,胶质瘤3例,椎管内肿瘤3例,颅咽管瘤2例,松果体区肿瘤1例,鞍区囊肿1例。两组患者的性别、年龄、Riker镇静躁动评分比较差异无统计学意义(P>0.05)。
1.2 方法 两组患者除都使用监护仪监测生命体征,实时监测患者血氧饱和度、呼吸频率和心率,血压测量间隔30 min,并采用相同的常规护理方法。观察组患者入ICU后第1晚不予任何影响睡眠药物。第2晚予右美托咪定0.1~0.5 μg/(kg·h)静脉泵入,从最小剂量开始使用,每隔2 h进行RASS评分,根据RASS评分结果和生命体征及时调整药物的剂量,维持生命体征稳定和RASS镇静评分在-1至-2,每天上午停止泵入右美托咪定至患者完全清醒(RASS镇静评分0分)。对照组患者不用任何影响睡眠药物。两组患者佩戴同一型号的小米智能手环(型号:XMSH02HM)记录睡眠数据,并于次日上午进行RCSQ量表评分,监测总时长14 h。
1.3 评价指标 患者客观睡眠质量指标记录各组患者第1晚及第2晚的总睡眠时长、深睡眠时长、浅睡眠时长。患者主观睡眠指标采用RCSQ,根据所涵盖的睡眠深度、睡眠潜伏期、夜间觉醒、重回入睡、睡眠质量5个方便进行评分(总分100分),分数越低表示睡眠质量越差。
1.4 统计学方法 运用SPSS 22.0统计软件,计数资料采用2检验,比较两组患者组间及组内深睡眠、浅睡眠、总睡眠时长、RCSQ评分采用方差分析及t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 总睡眠时长、深睡眠时长、浅睡眠时长比较 第1晚时,观察组与对照组之间总睡眠时长、深睡眠时长、浅睡眠时长差异无统计学意义(P>0.05)。第2晚时,与对照组相比,观察组使用右美托咪定后患者总睡眠时长及深睡眠时长明显增加(P<0.05),两组浅睡眠时长差异无统计学意义(P>0.05)。在观察组中,使用右美托咪定后的第2晚与未处理的第1晚相比,患者总睡眠时长及深睡眠时长明显增加(P<0.05),而浅睡眠时长差异无统计学意义(P>0.05)。见表1。
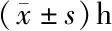

项目第1晚第2晚t值P值总睡眠时长 观察组7.32±1.8810.46±2.358.0570.000 对照组6.99±1.867.14±2.040.3140.754 t值0.7388.052 P值0.4630.000深睡眠时长 观察组2.97±1.346.80±2.208.7950.000 对照组2.68±1.263.09±1.401.2580.213 t值0.9178.429 P值0.3620.000浅睡眠时长 观察组4.35±1.463.66±1.002.3070.122 对照组4.30±1.424.05±1.590.7030.484 t值0.1311.149 P值0.8960.254
2.2 RCSQ评分比较 第1晚时,两组间RCSQ评分差异无统计学意义(P>0.05)。第2晚时,使用右美托咪定后的观察组RCSQ评分较对照组明显升高,差异有统计学意义(P<0.05)。在观察组内,使用右美托咪定后的第2晚与未处理的第1晚相比,RCSQ评分明显升高,差异有统计学意义(P<0.05)。见表2。


项目第1晚第2晚t值P值观察组38.75±13.0875.36±15.5710.6530.000对照组37.92±14.3940.55±11.960.8290.410t值0.25110.489P值0.8030.000
3 讨论
3.1 睡眠障碍对NSICU患者的影响 睡眠是人体的正常生理活动,大约占据了人一生的1/3,机体通过周期性刺激大脑中缝核和孤束核上的睡眠诱导区,通过上行抑制系统和神经递质,从而对大脑皮层产生抑制形成睡眠。睡眠根据其电生理学特性可以分为两个时相,即REM和N-REM。N-REM可以按照睡眠深度的递增继续分为入睡期(N1期)、浅睡期(N2期)、中度睡眠期(N3期)和深度睡眠期(N4期)共4期,其中N3期和N4期合称为慢波睡眠(slow wave sleep,SWS)。正常睡眠通常从N-REM期开始,持续约90 min后转入REM期,接着持续约30 min后再次转入N-REM期,整个过程将循环4~6个周期,随着睡眠时间进展,每个周期的SWS时间将逐步递减,REM时间将逐步增加。正常人的睡眠过程中的时期都是按比例出现,成为一个正常的睡眠结构。
我们发现NSICU患者睡眠障碍是由于总睡眠时长、尤其是深睡眠时长明显缩短,而与之相对的浅睡眠时长明显延长引起。这可能是由于病理生理状态下,疼痛刺激和所处的环境,容易发生睡眠结构改变和睡眠剥夺。在难以忍受的疼痛,肢体制动,频繁的护理操作和神经检查等,更加容易发生睡眠障碍。睡眠是机体产生能量节律性调节的蛋白质合成和细胞分裂的自我修复过程[5-6],睡眠不足将对生理和心理产生严重的影响。应激状态使血液中皮质醇水平升高,导致血液中的淋巴细胞和功能性单核细胞数量减少。进一步引起自然杀伤细胞活性降低和细胞因子产生减少,使得机体免疫功能下降[6]。此外,还可引起外周血管收缩血压持续升高,胃肠道功能紊乱,伤口愈合延迟,肢体肌张力增加,体温调节功能障碍,糖耐量降低和胰岛素抵抗等[5-6]。频繁的醒来和睡眠中断在白天会引起疲劳,出现昼夜颠倒,导致出现情绪低落、注意力不集中、过度焦虑甚至谵妄。Freedman等[7]表明ICU患者24 h内共有(41±28)个睡眠周期,每个周期平均维持(15±9)min,睡眠障碍主要表现在N1、N2期增加,而N3和REM减少。这些对于NSICU患者的影响更加明显,主要表现为神经功能障碍加重、严重的感染、内环境紊乱。机体蛋白的合成减慢进一步使影响患者恢复,增加患者的能量消耗、氧耗量和二氧化碳的产生量,从而对神经系统的影响,导致脑血管痉挛,加重脑水肿,加重原有的病情,形成恶性循环。由于本研究针对于清醒的NSICU患者,病例数有限,随访周期较短,有待更多临床资料进一步研究睡眠障碍对神经外科患者预后的影响。
3.2 NSICU患者睡眠质量的评估 目前,传统使用的多导睡眠图(PSG)是国际公认的睡眠结构分析的黄金标准,但其价格昂贵,操作复杂,体验感差使得在常规实践中难以推广。特别是对于NSICU患者来说,在疼痛刺激的作用下加上PSG监测的电极和束带,常常会干扰患者睡眠并难以耐受不能配合。但常用的还有体动监测仪、匹兹堡睡眠质量指数量表(PSQI)、RCSQ等方法[7-8]。各种技术方法都有其优缺点。
本研究使用的是基于体动监测仪原理的睡眠监测手环,主要是通过3D重力加速传感器捕捉数据,处理器进行信息处理分析储存于记录器中,最终通过蓝牙芯片传送至终端形成可视化数据。体动记录仪记录患者浅睡眠时长、深睡眠时长和总睡眠时长主是根据肢体运动的幅度大小进行分析整合,在使用中操作简单、经济可行和舒适方便。但记录过程中会默认长时间不动的时间段为睡眠时间,可能导致其记录到的睡眠时间增加,并且不能精确区分睡眠分期,可能限制了其相关应用。随着科技电子产品的快速发展,体动记录仪不断的革新换代,更加精密的芯片和科学缜密的算法的应用,越来越多的研究将体动记录仪应用于临床。在一个多中心共228例阻塞性睡眠呼吸暂停低通气综合征患者中记录到体动记录仪记录的总睡眠时间和睡眠效率等参数与PSG相比具有较高的一致性[9]。匡晓等[10]在40例受试者中发现,智能手环记录的睡眠期时长和所占百分比与实际PSG记录的无明显差异。同样地,在研究智能手环在睡眠监测可靠性研究中发现,小米智能手环与PSG监测的睡眠有效率、清醒睡眠时长、浅睡眠时长、深睡眠时间无明显差异[11-12]。虽然需要更多的研究、更大的样本进行观察和评价其临床价值,但已经可以说明其在睡眠监测中具有较高的安全性和可靠性,可以作为参考依据之一。
PSQI是常用的睡眠质量评估量表,在各类睡眠中被广泛运用。但是,PSQI评价条目内容较多、时间长,这对于ICU患者,特别是NSICU患者难以适用。而RCSQ量表具有较好的信效度,且简洁方便,专门针对ICU患者而设计[13],很适合NSICU清醒患者。本研究采用小米智能手环记录患者睡眠数据,并结合RCSQ量表进行综合评估患者睡眠质量状况。在本研究中,与智能手环记录的客观数据相比,RCSQ量表对NSICU清醒患者的睡眠评估同样具有良好的一致性。
3.3 早期使用右美托咪定对NSICU清醒患者睡眠质量的影响 脑干中心区是接收外界剌激和睡眠觉醒的部位,损害其中的蓝斑核(LC)和背侧中缝核(DR),会导致REM和N-REM平衡的破坏,LC和DR中的肾上腺素能神经元和5-羟色胺与大脑皮层之间存在投射关系,从而维持机体觉醒状态。其中,蓝斑核是α2受体分布最密集的部位。右美托咪定是新型的α2肾上腺素能受体激动剂,通过降低蓝斑核去甲肾上腺素能细胞的活性起作用,降低患者脑皮质过度觉醒水平,纠正紊乱的睡眠-觉醒通路,改善患者的失眠症状,同时具有不抑制呼吸、引起心血管系统变化轻微等特点。由于低血压和心动过缓都是α2激动剂的不良反应。在本研究中,在使用小剂量右美托咪定使患者轻度镇静、诱导睡眠情况下,并未出现循环系统的影响,可能与本研究选择的清醒患者具有较强的循环系统调节能力有关。
右美托咪定是目前唯一可以唤醒的镇静药物,产生的脑电图类似于N-REM期睡眠[3],这对于需要频繁进行神经系统评估的患者尤为合适。李国兰等[14]研究认为右美托咪定可以缩短停药后苏醒时间,便于进行神经系统评估,其效果优于咪达唑仑。在使用右美托咪定治疗慢性原发性失眠症中,患者深睡眠时长及总睡眠时长明显增加,而浅睡眠时长明显缩短[15]。而本研究的浅睡眠时长无明显改变,但在整个睡眠周期中占有的比例明显缩短,并且RCSQ量表评分明显增加,说明患者的睡眠结构得到调整,得到了更加充足的有效睡眠。
综上所述,对于神经外科清醒患者进入ICU后可以考虑予以右美托咪定使患者达到适当的镇静状态,可以显著提高深睡眠时长和总睡眠时长,使患者的有效睡眠增加,从而改善患者睡眠质量。
