原子力显微镜在细菌黏附力学研究中的应用
2019-11-08王蕊盖阔刘梦齐蒋丽
王蕊 盖阔 刘梦齐 蒋丽
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院全科门诊 成都 610041
细菌黏附是非常普遍和重要的生物学现象,细菌通过复杂的物理化学力的作用定植于细胞或基底表面。细菌生物膜的形成和结构维持及细菌对宿主细胞的入侵、破坏都与黏附性能密切相关。目前,原子力显微镜(atomic force microscopy)结合单分子、单细胞力谱等技术在细菌黏附研究中应用广泛,相比于传统的细菌处理及检测技术,原子力显微镜具有纳米(nm)级空间分辨率及皮牛(pN)级力灵敏度,细胞处理简单,并可以实现在生理环境下直接观测细菌黏附的动态过程。近年来,原子力显微镜的功能越来越多样化,性能不断增强,如多频原子力显微镜技术、实时高速原子力显微镜技术、力谱成像技术等,这些技术的进步推进了原子力显微镜在细菌黏附研究中的应用。本文将从原子力显微镜在分子生物学应用方面的最新发展和在细菌黏附研究中的应用两方面进行阐述,为细菌黏附的研究提供新的方法和思路。
1 原子力显微镜在分子生物学应用方面的进展
原子力显微镜是一种能够在纳米级水平表征生物细胞及分子的成像工具,其结合力谱技术可以实现对生物样品机械性能的探测。过去几十年里,基于原子力显微镜的力谱技术发展迅速,由细胞水平发展到分子水平,实现了单分子水平的实时-原位检测。
1.1 成像模式
原子力显微镜的液相成像实现了近生理条件下对活细胞、生物大分子等生物样品进行动态研究。原子力显微镜的成像模式主要有接触模式和动态模式两种,其中动态模式广泛用于软生物样品成像,是目前用于细菌成像的最主要的模式[1],其横向剪切力小,可同时表征样品形貌和检测其机械性质,但在分辨率、灵敏度和数据采集速度上仍有一定的局限性。
多频原子力显微镜(multi-frequency atomic force microscopy)和实时高速原子力显微镜(highspeed atomic force microscopy)的出现,为解决空间分辨率及成像速度的问题提供了新的发展方向。多频原子力显微镜涉及在多个频率下对原子力显微镜探针偏移的激发和检测,减少了样品数据的不可逆性丢失[2]。高速原子力显微镜在实时观测动态生物分子及细胞生物动力学过程方面取得重大突破[3-4],在细菌黏附力学研究中高速原子力显微镜常与其他一系列光学技术结合使用。
1.2 力谱技术
结合力谱技术对生物样品间各种相互作用力的测量是原子力显微镜的另一重要功能,主要依赖于检测“力-距离曲线”获得相互作用力。原子力显微镜测得的力曲线服从poisson分布。poisson分析法可以估计细菌黏附力中单个化学键的强度,并在表面聚合物性质未知的情况下将整体作用力分解成特异性力和非特异性力进行分析[5-6]。
基于原子力显微镜的力谱技术目前在细菌黏附力学研究中最前沿的应用是单分子力谱技术和单细胞力谱技术。既往细菌黏附研究多基于群体水平,近年来单分子力谱技术发展迅速,主要用于定量研究单细菌黏附力学特性等[7-8]。新近研发出多巴胺涂层胶体探针,可以使单个活菌稳定附着于微悬臂上,为细菌黏附力学研究提供了平台[9]。但目前单细胞力谱技术研究实用性低,局限性大,亟待进一步发展和推广。
单分子力谱技术是定量探测分子内或分子间微小作用力的重要工具,单细胞力谱技术涉及复杂的功能化探针技术,并需要选择适当的物理模型对测得的力曲线进行拟合分析[10]。目前单细胞力谱技术与原子力显微镜成像、激光扫描共聚焦显微镜、荧光显微镜等技术结合应用成为新的发展趋势[11],这在细菌黏附领域有着广阔的发展和应用空间。
基于原子力显微镜的力谱技术发展越来越迅速,已成为国内外黏附力学研究的重要工具。但该技术仍存在诸多问题,如成本高、效率低、技术复杂、无法获取菌体内部信息等,因此还需要更丰富的理论基础与实践应用。
1.3 力谱成像技术
基于力谱技术的成像模式是原子力显微镜的一个重要的里程碑,该技术实现了原子力显微镜功能的多元化。多参数原子力显微镜能够将复杂生物系统的结构图像与其生物物理特性量谱相关联。原子力显微镜在力曲线测量中提取样品的弹性、刚度、黏附性等机械参数,并将这些信息映射于样品的形貌特征[12]。多参数成像模式出现后不久,结合成像功能与单分子力谱技术的分子识别技术也发展起来。分子识别技术通过用特定化学基团修饰的原子力显微镜尖端对细胞表面进行扫描,将特异性相互作用的位点映射到样品的形貌图上[13]。分子识别成像技术结合荧光显微镜可以直观清晰地观测受体的分布,在生物样品结构功能关系的研究中有广阔的应用前景。
2 基于原子力显微镜的力谱技术在细菌黏附力学中的应用
细菌黏附是细菌生物膜形成及致病的基础和前提,包括细菌与基底、细菌与细菌、细菌与宿主细胞间的复杂的相互作用过程,主要依赖于黏附素与受体间的作用。基于原子力显微镜的力谱技术可以从单细胞或单分子水平定量、直观地测定非特异与特异性相互作用力,为细菌黏附性的研究提供了新的方法。
2.1 细菌与基底间的黏附力学特性
细菌与基底间的黏附是牙菌斑生物膜形成的第一步,也是最关键的一步,在口腔环境中缺乏与釉质间黏附的细菌难以形成生物膜,其致龋力也显著降低。初始黏附的力学性质与细菌及基底特性均密切相关。通过检测力-距离曲线,进行poisson分析,可将细菌黏附力分为非特异性力(如氢键、疏水作用力、范德华力、静电作用力等)和特异性力(如配体-受体间作用力),发现口腔细菌与基底作用力随接触时间延长而增加[14]。
黏附素是一类由细菌合成的细胞外聚合物(例如多糖、蛋白质、环境DNA等),其与受体间相互作用构成细菌黏附过程中特异性作用力的主要成分。P1是变异链球菌表面主要的蔗糖非依赖性黏附素,主要介导细菌与牙面固定唾液薄膜中的唾液凝集素 (salivary agglutinin,SAG)以及与细胞外基质蛋白间的黏附作用。应用单分子、单细胞原子力显微镜技术,Sullan等[15]研究发现变异链球菌与SAG间的黏附为至少10个以上P1蛋白质分子和4个以上gp340糖蛋白分子介导的长距离强作用力(~500 pN)。与此同时,Heim等[16]利用单细胞力谱技术及单分子成像技术对P1的组成及在活菌表面的密度、分布和排列方向进行探测,发现P1中的A3VP1和C末端结构域是主要的黏附相关区域,且这些特定的P1片段在变异链球菌表面上组装成的复杂空间结构对于细菌与SAG间黏附意义重大。与表面蛋白P1相反,葡糖基转移酶(glucosyltransferase,Gtf)主要介导细菌与牙面间的蔗糖依赖性黏附。Cross等[17]最早应用原子力显微镜从生物物理学角度对变异链球菌Gtf进行研究,发现变异链球菌在牙齿表面的黏附主要由葡聚糖介导,并且黏附随时间而增强。GtfC和GtfB合成的葡聚糖在变异链球菌与磷灰石表面及细菌细胞之间的黏附中起重要的作用。
菌毛是牙龈卟啉单胞菌及放线菌等革兰阴性菌的主要黏附结构。研究[18]发现口腔放线菌在对基底的黏附中,疏水、静电等非特异性作用力起到主导作用,且唾液薄膜覆盖羟磷灰石或牙釉质表面可使细菌黏附力显著降低。
细菌与口腔材料间的黏附与材料的化学稳定性和表面微观结构关系密切,材料表面的粗糙度影响细菌的黏附和菌斑的形成。Mei等[19]首次应用单细胞力谱技术研究了正畸复合树脂材料的表面粗糙度与链球菌黏附性之间的关系,结果表明表面粗糙度越大,链球菌的黏附性越强,且材料表面粗糙度对血链球菌(先锋菌)黏附性的影响大于变异链球菌(致龋菌)。Yu等[20]研究表明,氧化锆表面纳米级粗糙度差异主要影响变异链球菌的初始黏附阶段,黏附力随粗糙度增加而增加。多项研究[19,21-22]应用相同的技术发现,牙菌斑初始黏附菌和致龋菌的黏附力随牙釉质粗糙度的增加而增加,但在粗糙度达到0.2 mm时达到阈值,且初始黏附菌株对于不同粗糙度釉质表面的黏附力强于致龋菌株。
此外,Mei等[23]还发现,材料表面覆盖唾液薄膜可以显著降低口腔细菌对正畸粘接剂、不锈钢、釉质表面的黏附力。对变异链球菌与不锈钢基底间的黏附力曲线进行poisson分析,发现细菌与唾液薄膜覆盖的不锈钢材料表面的非特异性力为斥力,而在无唾液薄膜覆盖的不锈钢表面表现为引力。这可能由于带负电的细菌与金属表面产生的正电荷相互吸引,唾液薄膜抑制了其间的引力作用。
细菌的黏附力学特性不仅与材料表面特性相关,还与材料种类密切相关。Mei等[24]联合原子力显微镜与扫描电子显微镜比较了链球菌对于聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)和聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)两种不同修复材料的黏附力学特性,得出无论有无唾液薄膜覆盖,链球菌在PET表面的黏附力及形成生物膜的密度均明显高于PMMA的结论,因此认为PMMA材料更适用于口腔卫生不良、龋易感性高、患牙周病或口臭的患者。类似实验[25]发现,链球菌及牙周致病菌对钛表面的细菌黏附力高于氧化锆表面,因此氧化锆作为种植材料可有效降低口腔细菌黏附,预防龋病或牙周病。
2.2 细菌之间的黏附力学特性
细菌与细菌间的黏附共集聚是生物膜形成以及三维结构维持的基础,主要由表面的黏附蛋白和受体特异性相互作用所决定。Feuillie等[26]结合单细胞力谱技术及单分子力谱技术发现金黄色葡萄球菌表面蛋白SDRC通过弱结合力(~40 pN)和低亲和力键(~160 μmol·L-1)连接,且主要由N2亚结构域介导分子间相互作用,其在细菌间黏附及生物膜形成中起到重要作用。
不同菌种之间的集聚是菌斑生长成熟的前提。基于原子力显微镜对链球菌与放线菌的单细胞黏附力学研究[27]发现,不可集聚细菌间的非特异性力约为1 N,而可集聚的细菌间作用力为非集聚的细菌间作用力的3~4倍。口腔中白假丝酵母与变异链球菌集聚常改变菌斑的结构而影响其毒性和致病性,研究认为该黏附过程依赖于GtfB将蔗糖原位转化为葡聚糖。结合单细胞力谱技术,Hwang等[28]研究发现,GtfB与白假丝酵母表面表现出显著的结合力(~2 nN)和较低的离解速率,且该作用力及其稳定性都明显高于GtfB与变异链球菌间黏附力。原子力显微镜力谱图结果间接表明GtfB结合位点在白假丝酵母表面分布不均匀,但在变异链球菌表面分布均衡。之后Hwang等[29]进一步对GtfB与白假丝酵母的结合机制进行研究,证明了GtfB与白假丝酵母细胞壁中的甘露糖蛋白结合的假设,且发现N-或O-甘露糖蛋白合成缺陷的白假丝酵母与GtfB作用力明显降低。
细菌与宿主细胞间的黏附是引起致病菌入侵及起始感染的重要环节,主要依赖于微生物的表面组分与宿主细胞的细胞外基质的相互作用。Prystopiuk等[30]应用单分子力谱技术与单细胞力谱技术,对金黄色葡萄球菌与宿主细胞间纤连蛋白结合蛋白、纤连蛋白及整合素相互作用研究发现,纤连蛋白结合蛋白通过强作用力(~1 500 pN)介导细菌与纤连蛋白黏附, 纤连蛋白结合蛋白-纤连蛋白复合物与宿主表面整合素之间的作用力高达800 N,因此提出可阻断纤连蛋白-整合素间机械桥以抑制细菌与宿主细胞间黏附。Becke等[31]利用相同的手段研究表明,肺炎链球菌菌毛蛋白RrgA的2个结构域D3和D4同时与宿主细胞表面纤维粘连蛋白作用,介导细菌对宿主细胞的初始黏附。
3 力谱成像技术在细菌黏附中的应用
近年来,基于力-距离的多参数成像模式已实现在分子及亚分子分辨率及常规成像时间内对活细胞表面的形貌结构及黏附、弹性等力学特性进行表征[32]。Dufrêne研究团队[33-34]对金黄色葡萄球菌表面形貌、弹性、黏附力及杨氏模量等力学参数成像,原子力显微镜成像同时逐像素记录力-距离曲线,在压痕力Fi恒定的情况下,黏附力Fadh及弹性、静电等参数可映射于细菌形貌图上(如图1所示)。研究发现,锌溶液中细菌表面更光滑,硬度、弹性及黏附性显著增强,且缺失SasG8的细胞表面加入锌离子后黏附性变化不大,证明锌离子可通过改变SasG8的特征来改变细菌的黏附力学特性。
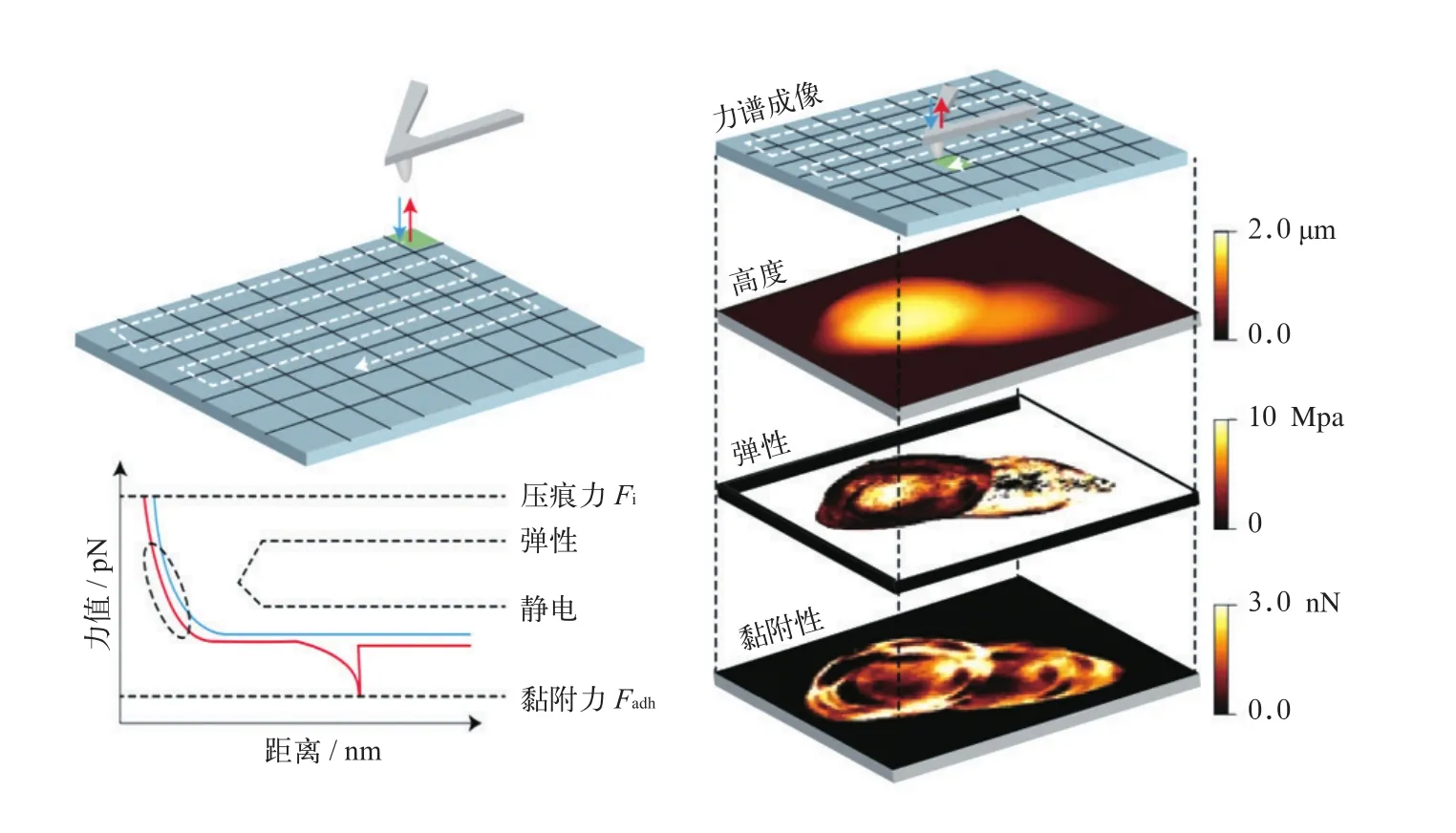
图 1 基于原子力显微镜的多参数及分子识别成像示例[34]Fig 1 Examples of multiparametric imaging and molecular recognition imaging based on atomic force microscopy[34]
此外,基于力-距离的原子力显微镜成像技术在菌斑生物膜组成、结构及其生物物理化学性质探测中也起到了重要作用。Liu等[35]对生物膜中变异链球菌力学性能的变化研究发现,细胞外基质在生物膜中呈梯度分布,细胞外聚合物当组成、新鲜度和代谢阶段不同时,表现出不同的黏附性,在变异链球菌细胞的边缘黏附性最强。
基于原子力显微镜的单分子力谱成像目前可被用于定位细菌表面黏附相关分子和黏附素结构及机制的研究。应用该技术,Dupres等[36]绘制了结核分枝杆菌表面肝素结合血凝素黏附素的分布图;El-Kirat-Chatel等[37]研究发现黏附分子LapA在荧光假单胞菌表面随机分布,并可释放到溶液;Beaussart等[38]研究无乳链球菌表面多糖Cps的分布情况时,将Cps抗体修饰在探针尖端,测量抗体-细菌表面的黏附力,同时获得黏附力谱图,从而对野生型菌株及Cps变异株表面的Cps分布进行分析。此外,研究者[15,26]对众多黏附素分子都进行了详细的研究,推动了单分子力谱成像技术在细菌黏附领域的应用和发展。
4 展望
细菌生物膜形成过程与细菌黏附密切相关,目前基于原子力显微镜对初始黏附阶段细菌与基底间相互作用力研究已取得一定的成果,但对细菌共集聚机制及其对菌斑生态影响的研究仍处于早期阶段。近年来,原子力显微镜的力谱技术及多种成像模式的发展为细菌黏附力学的深入研究提供了新方法,但新兴原子力显微镜技术理论基础尚不完善,且细菌样品的特殊性限制了原子力显微镜技术在该领域的推广应用。预计高速原子力显微镜平台的发展将为更全面地了解复杂生物系统的形态结构及生物物理特性发挥作用。
