转录组测序揭示细胞周期通路参与鸡腹脂沉积
2019-11-08陈家辉任学义李丽敏卢诗意程湉谭量天梁少东何丹林罗庆斌聂庆华张细权罗文
陈家辉,任学义,李丽敏,卢诗意,程湉,谭量天,梁少东,何丹林,罗庆斌,聂庆华,张细权,罗文
研究报告
转录组测序揭示细胞周期通路参与鸡腹脂沉积
陈家辉,任学义,李丽敏,卢诗意,程湉,谭量天,梁少东,何丹林,罗庆斌,聂庆华,张细权,罗文
华南农业大学动物科学学院,广东省农业动物基因组学与分子育种重点实验室,农业农村部鸡遗传育种与繁殖重点实验室,广州 510642
近年来,随着生长性状和饲料转化率的提高,中国地方品种肉鸡腹脂率不断增加,大大降低了肉鸡的品质。过多的腹脂沉积不仅降低了肉鸡的屠宰率和抗病力,而且由于脂肪较难处理,导致其被随意丢弃,污染环境。为了挖掘与中国地方品种肉鸡腹脂沉积相关的基因和调控通路,本研究对杏花鸡分别进行高脂和普通饲料的喂养,检测腹脂沉积情况,并利用转录组测序检测高脂饲养对肝脏和腹脂组织中基因表达的影响。结果表明,喂养两周后高脂组肉鸡腹脂重和腹脂率显著增加,且腹脂细胞的直径和面积也显著增大。对两组鸡的腹脂和肝脏进行转录组测序,发现在腹脂中显著差异表达基因主要富集于细胞周期通路、PPAR (peroxisome proliferator- activated receptor)信号通路和ECM (extracellular matrix)受体信号通路中;而在肝脏中,显著差异表达基因同样显著富集于细胞周期通路中,同时也显著富集于类固醇生物合成和PPAR信号通路中。通过分析腹脂和肝脏组织中共同差异表达的基因,发现这些基因同样显著富集于细胞周期中。进一步以鸡肝癌细胞系LMH (chicken hepatoma cell)细胞和鸡前脂肪细胞系ICP (immortalized chicken preadipocytes)细胞进行体外验证,利用高脂培养基和普通培养基进行培养,结果发现48 h后,高脂培养基可显著促进细胞周期进程,增加处于S期的细胞数。同时,qRT-PCR结果发现高脂培养基可显著促进细胞周期相关基因的表达。综上所述,本研究通过基因表达差异分析,发现高脂饲养可能通过激活鸡脂肪组织的细胞周期来促进前脂肪细胞增殖,进而增加腹脂沉积。该研究结果为进一步了解优质肉鸡腹脂沉积的机制提供了理论依据。
杏花鸡;高脂饲料;腹脂沉积;细胞周期;差异表达基因
随着育种、营养、免疫和环境管理等对鸡生长状态的不断改进,现代肉鸡表现出良好的生长性能,但在体重增加的情况下,肉鸡体内的脂肪沉积也不断增多,尤其是肉鸡腹脂沉积过高过快的问题逐渐显现出较大的弊端。适当的脂肪沉积可提高肉质,增加肌肉风味,但过多的脂肪沉积不仅降低了鸡的屠宰率和饲料转化率,还会影响鸡的繁殖性能和抗病能力[1,2]。另一方面,由于脂肪的加工较为复杂,目前主要以废弃物的形式将其处理,由此不仅减少了生产者的经济利益,还增加了对环境的危害,不利于肉鸡业的长足发展[3]。
与国外普遍食用快大型肉鸡不同,国内更偏向于食用本地的土鸡品种,特别是传统的中国烹饪法更是对肉鸡的品种和品质有严格的要求。相比于快大型肉鸡,土鸡品种虽然长肉少、长肉慢,但却普遍拥有更好的肉质,也更适合中国人的烹饪方式。但近些年随着规模化和集约化养殖的普及,土鸡品种腹脂沉积越来越多,成为影响土鸡品质的一大因素[4]。如何减少土鸡或肉鸡的腹脂沉积,已成为育种和养殖技术人员的重要研究课题。目前对于肉鸡腹脂率的选种方法包括体尺测量间接选择法、饲料转化率间接选择法、活体触摸评分法、同胞屠宰法、VLDL(very low density lipoprotein)浓度法和分子标记辅助选择法[5]。因为腹脂性状具有中高等的遗传力[5],所以这些方法都能在一定程度上降低肉鸡的腹脂沉积。但对于肉鸡腹脂沉积的遗传机制,包括相关的主效基因、QTL和调控通路等,目前仍然存在许多亟待解决的问题[6]。
饲料中添加高含量的脂肪能促进肉鸡生长,同时也能增加肉鸡腹脂沉积[7]。对小鼠()进行高脂饲养可诱导脂肪生成相关基因的表达,激活脂质代谢相关通路,最终提高体脂沉积[8]。因此,通过在饲料中添加更高比例的含脂物质,可诱导肉鸡体内脂肪沉积相关基因的表达,从而增加腹脂沉积。但腹脂沉积不仅仅与脂肪生成和脂质代谢相关,还涉及许多与细胞功能和活动相关的进程。本研究以广东4大名鸡之一的杏花鸡为实验材料,通过喂养高脂饲料和普通饲料,检测其腹脂沉积情况,并对与脂质代谢紧密相关的肝脏和腹脂进行转录组测序,分析饲料中不同脂肪含量的饲养模式对这两种组织中基因表达的影响,由此挖掘与脂肪沉积相关的基因、通路和细胞进程,为进一步了解肉鸡腹脂沉积的机制提供理论依据。
1 材料与方法
1.1 肉鸡饲养及细胞来源
从华南农业大学科研禽场获得体重相近的8周龄纯种杏花鸡母鸡,随机分组,每组6只母鸡,分别饲喂高脂饲料(饲料中含有40%碳水化合物、25%脂肪和20%蛋白质)和普通饲料(饲料中含有41%碳水化合物、5%脂肪和22%蛋白质)整两周。实验所用鸡肝癌细胞系LMH (chicken hepatoma cell)由中国农业科学院哈尔滨兽医研究所馈赠,鸡前脂肪细胞系ICP (immortalized chicken preadipocytes)由东北农业大学农业部鸡遗传育种重点实验室馈赠。
1.2 肉鸡屠宰测定
用高脂饲料和普通饲料分开饲养整2周后,测量鸡活体重,进行屠宰并检查其胴体品质。脱毛后取出内脏,测量半净膛重;取出腹部脂肪,称量腹脂重;取肝、腹脂组织样本液氮速冻,随后保存于−80℃冰箱用于提取RNA等;取腹脂组织样本保存于10%福尔马林中用于切片。
1.3 转录组测序
提取–80℃冰冻保存的肝脏和腹部脂肪样品总RNA,利用深圳华大基因公司BGI-500测序平台进行转录组测序和数据的初步分析。所有序列数据均已保存在NCBI'S Gene Expression Omnibus (GEO, http://www.ncbi.nim.nih.gov/geo)中,可通过GEO系列登录号GSE128340获取。本研究将组间差异倍数≥2、Q值(矫正后的值)≤0.001的基因作为显著差异表达基因。为了验证高通量测序结果的准确性,本研究随机选取7个与细胞周期通路相关的差异表达基因(如、、、、、和)进行qRT-PCR验证。
1.4 RNA提取、cDNA合成和qRT-PCR
利用RNaiso试剂(TaKaRa公司,日本)分别对鸡的肝脏组织、腹脂组织、LMH和ICP细胞进行总RNA提取。根据试剂盒操作说明书,以总RNA为模板,使用PrimeScriptTMRT reagent Kit with gDNA Eraser (TaKaRa公司,日本)进行逆转录,合成cDNA。以cDNA为模板,使用ITAQTMUniversal SYBR® Green Supermix (Bio-Rad公司,美国)对选取的差异表达基因进行qRT-PCR检测。扩增所用的引物信息见表1。扩增体系:10 μL 2×SYBR®Green Supermix、0.5 μL正向引物(10 μmol/L)、0.5 μL反向引物(10 μmol/L)、2 μL cDNA、7 μL MilliQ 水。扩增条件:95℃ 1 min;95℃ 10 s,58℃ 30 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。所有反应均设3个重复。qRT-PCR扩增数据分析采用2–ΔΔCT法分析基因表达情况[9]。对LMH细胞进行qRT-PCR扩增所用的内参基因为[10],引物序列用Primer premier 5软件设计;对ICP细胞进行qRT-PCR扩增所用的内参基因为,引物序列参考文献[11]。
1.5 石蜡切片
对上述10%福尔马林溶液保存的腹脂样品进行石蜡切片,比较高脂鸡和正常鸡的腹脂细胞大小。样品经乙醇脱水和二甲苯透明后,经过浸蜡使溶解的石蜡渗透进样品中。夹取已浸蜡组织块埋入熔蜡中并编号。待包埋模具内的熔蜡表面凝固后,放入冷水中加速凝固。凝固后切成规则的正方形或长方形备用。每个样品固定后经粗切、细切切出较为完好的切片后,放到温水中展平然后用玻片捞起,烘箱过夜即可。
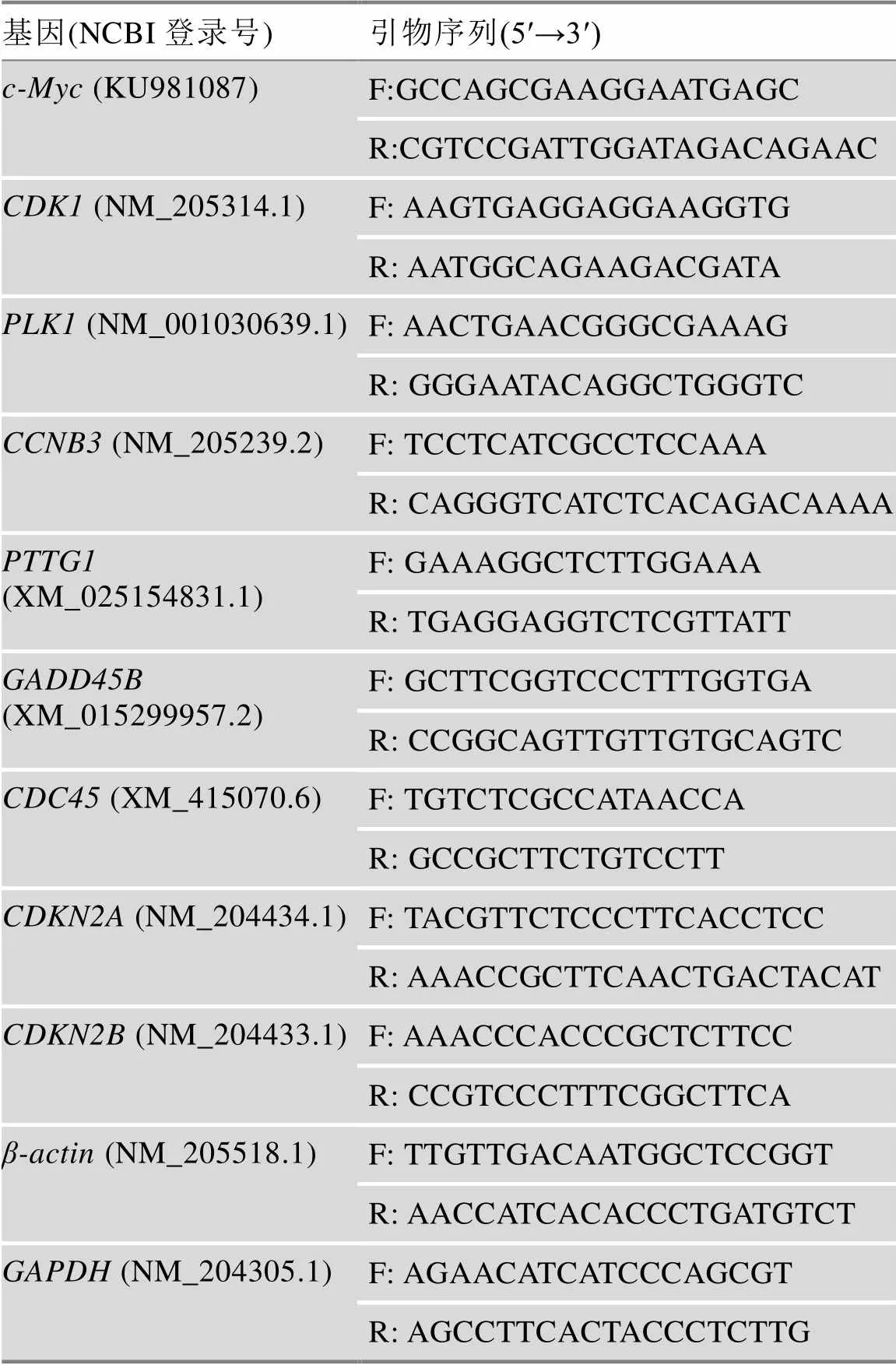
表1 qRT-PCR扩增引物
1.6 HE染色
制作好的切片经55℃烘箱烘烤固定6~12 h,使用苏木素–伊红染色试剂盒(上海碧云天生物公司)进行染色。经苏木素染色、冲洗、返蓝、伊红染色、透明等步骤后,显微镜观察染色情况,选择染色较清晰的切片进行树胶封片。封片后择日拍照。
1.7 细胞培养与高脂处理
普通培养基为含10%或15%胎牛血清的DMEM培养基(Gibco,美国),高脂培养基参考文献[12]配制,即在普通培养基中加入0.66 mmol/L油酸钠、0.33 mmol/L软脂酸钠和1 mmol/L牛血清白蛋白。
鸡前脂肪细胞系ICP细胞的培养:利用含15%胎牛血清的DMEM培养基培养,每天观察细胞形态,及时换液。鸡肝癌细胞系LMH细胞培养:利用含10%胎牛血清的DMEM培养基培养,每天观察细胞形态,及时换液。
高脂处理:在加入高脂培养基的前一天,用胰酶消化已长满的细胞并进行计数,按照一定密度铺于24孔细胞培养板和12孔细胞培养板中,当细胞在多孔板中长至约80%密度时,将普通培养基更换为高脂培养基,再持续培养48 h,随后收集细胞,进行细胞周期检测(12孔板)和RNA抽提(24孔板)。
1.8 细胞周期分析
在细胞高脂处理48 h后,用75%乙醇收集细胞,在−20℃下过夜固定。乙醇固定后,用含10 μg/mL RNA酶A(TaKaRa公司,日本)和含0.2%(v/v)Triton X-100(Sigma公司,美国)的50 μg/mL碘化丙啶(Sigma公司,美国)在4℃下染色30 min。随后使用BD Accuri C6流式细胞仪(BD Biosciences公司,美国)分析细胞周期,并使用Flowjo 7.6软件(Verity Software House)进行数据分析。
同时,选取9个基因(、、、、、、、和),利用qRT-PCR进行细胞周期的检测。这9个基因既属于细胞周期通路,又同时在肝脏和腹脂中显著差异表达。
1.9 脂肪细胞大小的测量
用福尔马林保存好的腹脂制作石蜡切片,在Nikon Eclipec-Ti显微镜观察下,利用NIS-Elements BR软件测量脂肪细胞的大小和平均直径。每只鸡进行3次切片,每个切片随机选取至少3个视野,进行脂肪细胞大小和直径的测量,每个视野至少选取20个细胞,记录后将结果进行统计学分析。
1.10 数据统计和分析
利用在线DAVID软件(http://david.abcc.ncifcrf. gov/home.jsp)进行显著差异表达基因的GO功能注释和Kyoto Encyclopedia of Genes and Genomes (KEGG)富集通路分析;互作通路分析采用在线Metascape软件(http://metascape.org/gp/index.html#/ main/step1)进行。所有数据均以平均值±标准误的形式表示,肉鸡样本每组6个重复,细胞样本每组3个重复。数据分析采用SPSS软件中的独立样本检验进行。
2 结果与分析
2.1 高脂日粮可增加肉鸡腹脂沉积,增大腹脂细胞直径和面积
为了解参与肉鸡腹脂沉积的基因、信号通路和细胞进程,本研究构建了肉鸡高脂组(高脂日粮饲喂)和普饲组(普通日粮饲喂)两个模型。在连续两周饲喂特定饲料后,对10周龄肉鸡称重后进行屠宰测定。相比于普饲组,高脂组鸡的活重无明显差异(图1A)。鸡腹部脂肪重和腹脂率高脂组和普饲组差异显著(图1,B和C),高脂组鸡的腹脂重和腹脂率显著高于普饲组(<0.05)。对鸡腹脂进行石蜡切片观察,发现高脂组的杏花鸡腹部脂肪单个细胞明显大于普饲组的腹部脂肪单个细胞(图1D)。利用NIS-Elements BR软件测量脂肪细胞的大小和平均直径,通过对比两组鸡脂肪细胞的面积和直径,进一步证实高脂组肉鸡腹脂细胞显著大于普饲组(图1E)。以上结果表明,高脂喂养可增加肉鸡腹脂沉积,增大腹部脂肪细胞直径和面积。
2.2 高脂鸡和普饲鸡中腹脂组织的基因表达差异分析
为了鉴定参与肉鸡腹脂沉积的基因,本研究将高脂和普通饲料喂养两周的肉鸡屠宰后,采集肝脏和腹脂进行转录组测序。测序结果发现,高脂组相比于普饲组,有273个基因的表达显著上调,491个基因的表达显著下调,另外17 568个基因表达差异不显著(图2A)。对所有显著差异表达的基因进行GO功能注释,发现这些基因显著富集于细胞周期、细胞分裂、染色质分离等与细胞增殖相关的生物学进程(图2B)。对这些显著差异表达基因进行KEGG通路富集分析,也发现它们可显著富集于细胞周期通路中,除此之外还能富集于蛋白质消化吸收、p53信号通路和过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)信号通路等(图2C)。本研究利用Metascape构建了这些显著差异表达基因的互作网络(图2D)。从网络中可以发现,所有与细胞周期通路相关的基因都表现出在高脂肉鸡腹脂中显著上调的现象,暗示高脂喂养可能激活了腹部脂肪组织中前脂肪细胞的增殖。
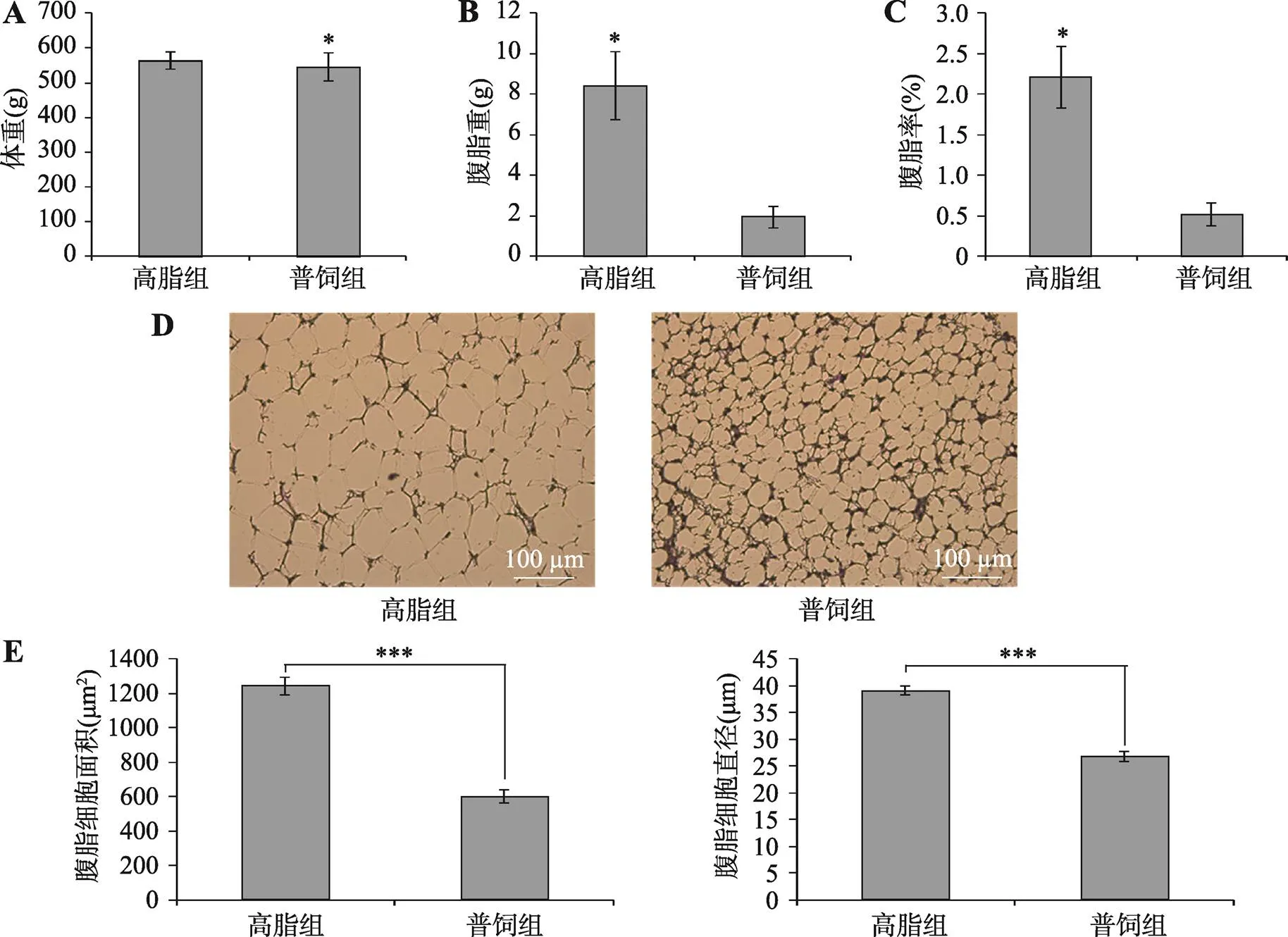
图1 高脂喂养对肉鸡腹脂沉积的影响
A:高脂组和普饲组肉鸡饲喂特定饲料2周后的屠宰前体重;B:高脂组和普饲组肉鸡腹脂重;C:高脂组和普饲组肉鸡腹脂率;D:高脂组和普饲组肉鸡腹脂细胞的切片观察;E:高脂组和普饲组肉鸡腹脂细胞的面积和直径统计分析。*<0.05,***<0.001。
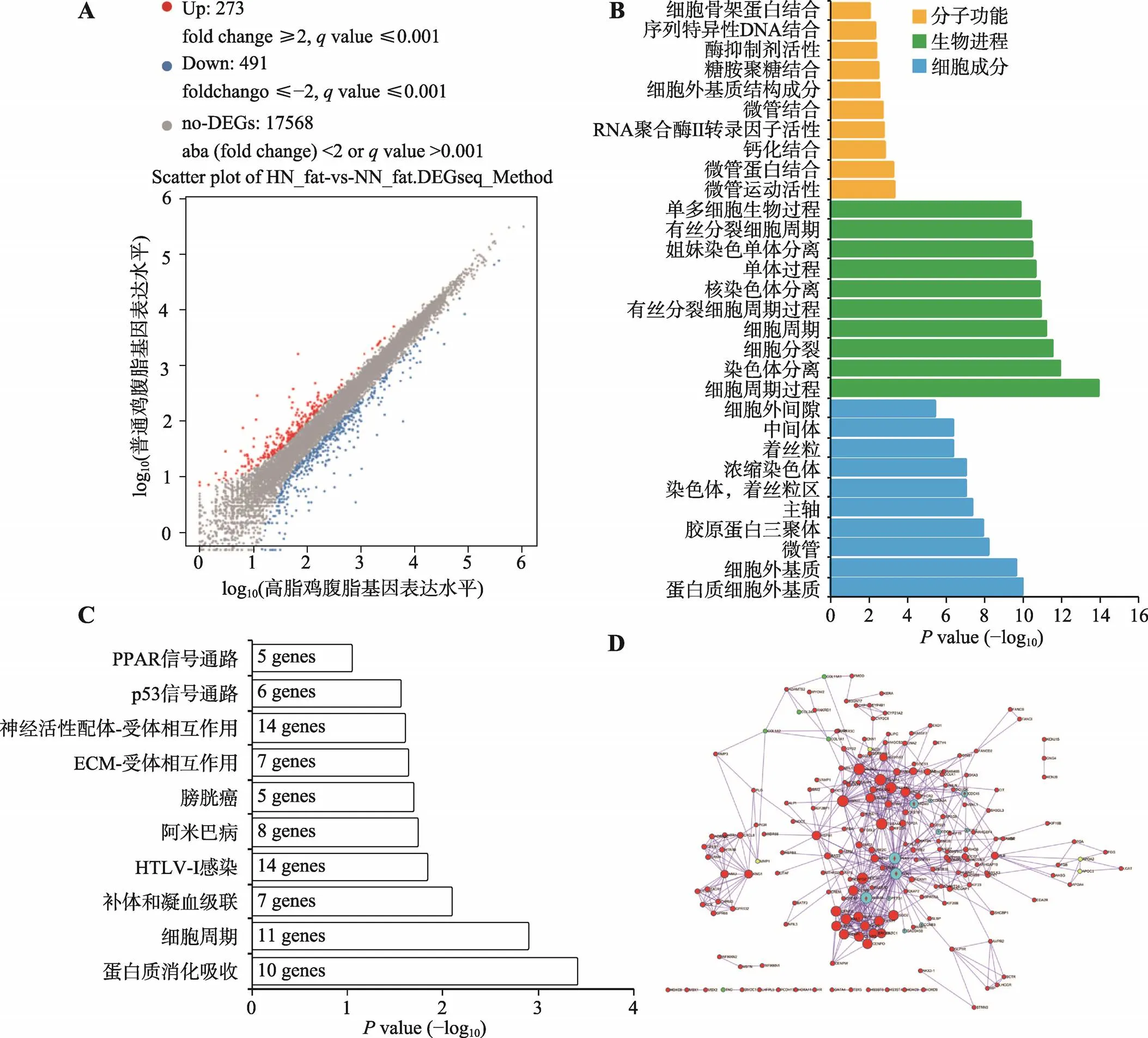
图2 高脂鸡和普饲鸡中腹脂组织的基因表达差异分析
A:Scatter plot分析高脂鸡和普饲鸡腹脂组织中的差异表达基因(HN_fat代表高脂鸡的腹脂,NN_fat代表普饲鸡的腹脂);B:显著差异表达基因的GO功能注释;C:显著差异表达基因的KEGG通路分析;D:显著差异表达基因的互作网络(浅蓝色代表细胞周期通路相关基因)。
2.3 高脂鸡和普饲鸡中肝脏组织的基因表达差异分析
肝脏是脂质代谢的核心器官,因此,除了对腹脂进行转录组测序分析之外,本研究对高脂鸡和普饲鸡的肝脏也进行了转录组测序分析。结果发现,高脂组相比于普饲组,有502个基因的表达显著上调,569个基因的表达显著下调,另外17 261个基因表达差异不显著(图3A)。对所有显著差异表达的基因进行GO功能注释,发现这些基因可显著富集于类固醇相关的生物合成和代谢进程中(图3B)。对这些显著差异表达基因进行的KEGG通路富集分析也发现,它们可显著富集于类固醇生物合成和代谢通路进程中(图3C)。除此之外,肝脏中的差异表达基因与腹脂中类似,可同样富集于细胞周期通路和PPAR信号通路中。利用Metascape构建了这些显著差异表达基因的互作网络(图3D)。从网络中也发现所有与细胞周期通路相关的基因(浅蓝色)都表现出在高脂肉鸡中显著上调表达的现象,暗示高脂喂养可能激活了肝脏组织相关细胞的增殖。
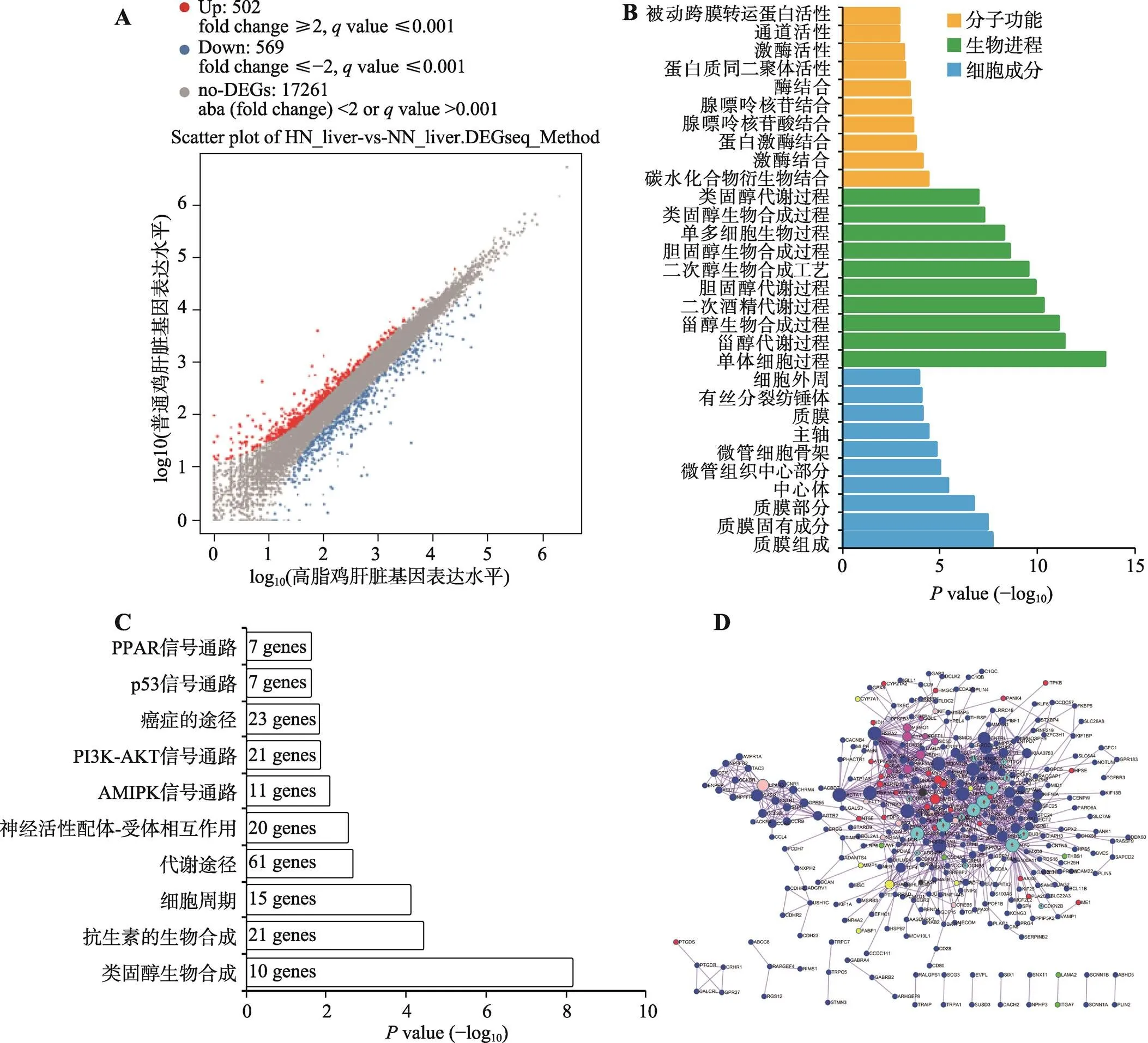
图3 高脂鸡和普饲鸡中肝脏组织的基因表达差异分析
A:Scatter plot分析高脂鸡和普饲鸡肝脏组织中的差异表达基因(HN_liver代表高脂鸡的肝脏,NN_liver代表普饲鸡的肝脏);B:显著差异表达基因的GO功能注释;C:显著差异表达基因的KEGG通路分析;D:显著差异表达基因的互作网络(浅蓝色代表细胞周期通路相关基因)。
2.4 腹脂和肝脏中的共同差异表达基因显著富集于细胞周期通路
本研究对高脂组和普饲组中在腹脂组织差异表达的基因和在肝脏组织差异表达的基因进行联合分析,发现有177个基因在两种组织中都显著差异表达(图4A)。对这177个基因进行GO功能注释,发现这些基因显著富集于细胞分裂、细胞周期、有丝分裂、细胞周期调控等相关进程(图4B),表明高脂喂养可激活肝脏和腹脂中细胞增殖相关基因的表达。为验证高通量测序结果的可靠性,本研究利用与测序相同的样本,从这177个共同差异表达基因中随机选择7个与细胞周期相关的基因(和)进行qRT-PCR验证。结果表明,在肝脏(图4C)和腹脂(图4D)中,高脂饲喂均可促进细胞周期相关基因的表达,这与测序结果相符,证实了测序结果的可靠性。
2.5 高脂培养基可促进鸡肝脏细胞和前脂肪细胞的细胞周期进程
转录组测序结果发现高脂饲料可激活肝脏和腹脂组织中与细胞周期相关基因的表达,为了在体外验证这一现象,本研究利用高脂培养基和普通培养基对鸡肝癌细胞系LMH细胞和鸡前脂肪细胞系ICP细胞进行培养,48 h后检测细胞周期。结果发现在LMH细胞和ICP细胞中,高脂培养基都可显著减少处于G1期的细胞数量,但能增加处于S期的细胞数量(图5,A和B)。进一步对高脂培养基和普通培养基培养48 h的细胞进行RNA提取,利用qRT-PCR检测与细胞周期相关并且在肝脏和腹脂中都显著差异表达的9个基因(、、、、、、、和)的表达情况。结果表明,在LMH细胞和ICP细胞中,高脂培养基都可显著提高细胞周期相关基因的表达(图5,C和D)。综上所述,高脂培养基可促进家鸡肝脏细胞和前脂肪细胞的细胞周期进程。
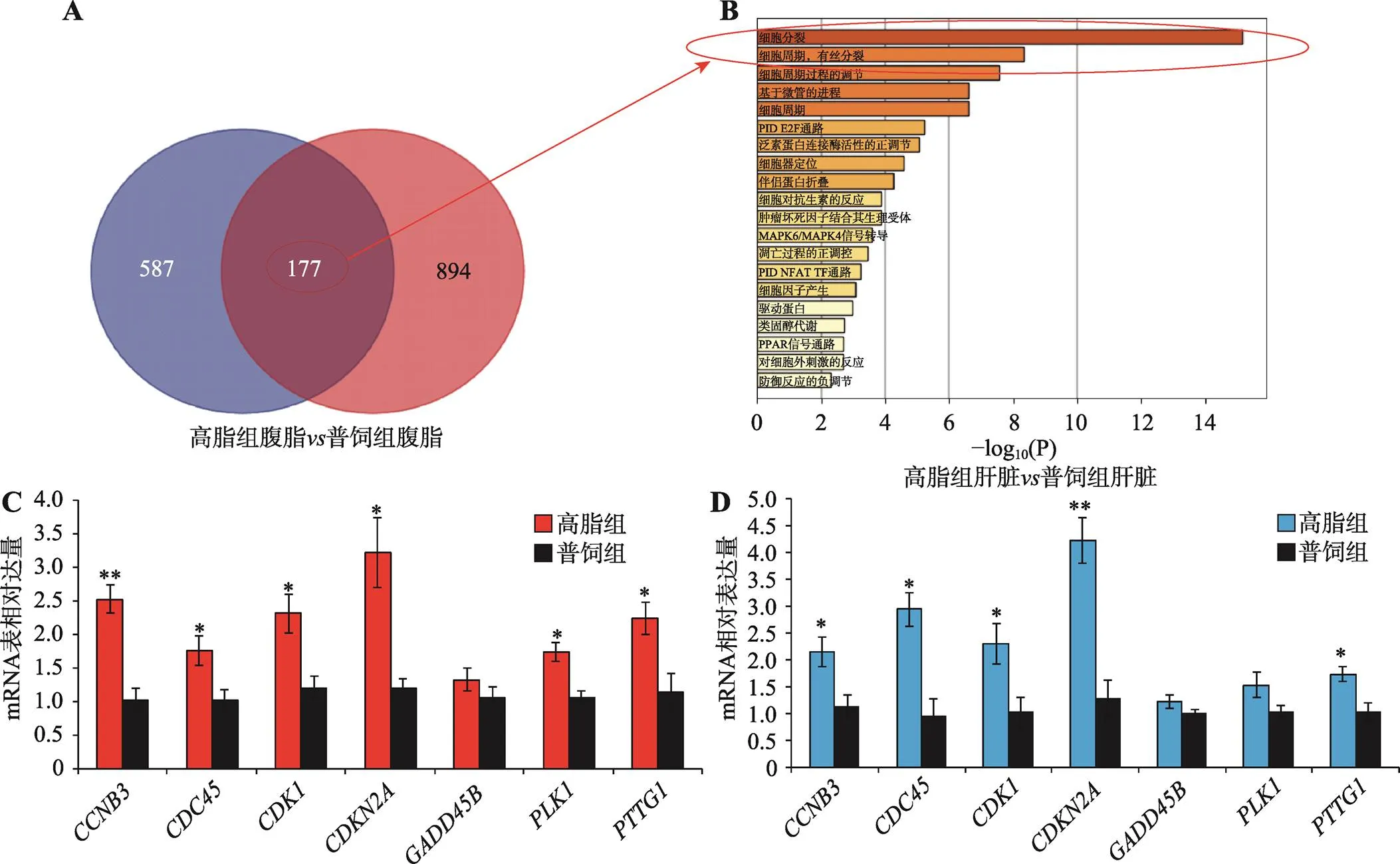
图4 腹脂和肝脏中的共同差异表达基因显著富集于细胞周期的相关进程
A:腹脂和肝脏中的共同差异表达基因韦恩图注释;B:腹脂和肝脏中的共同差异表达基因GO功能注释;C:qRT-PCR验证肝脏组织中7个与细胞周期相关基因的表达;D:qRT-PCR验证腹脂组织中7个与细胞周期相关基因的表达。*<0.05,**<0.01。
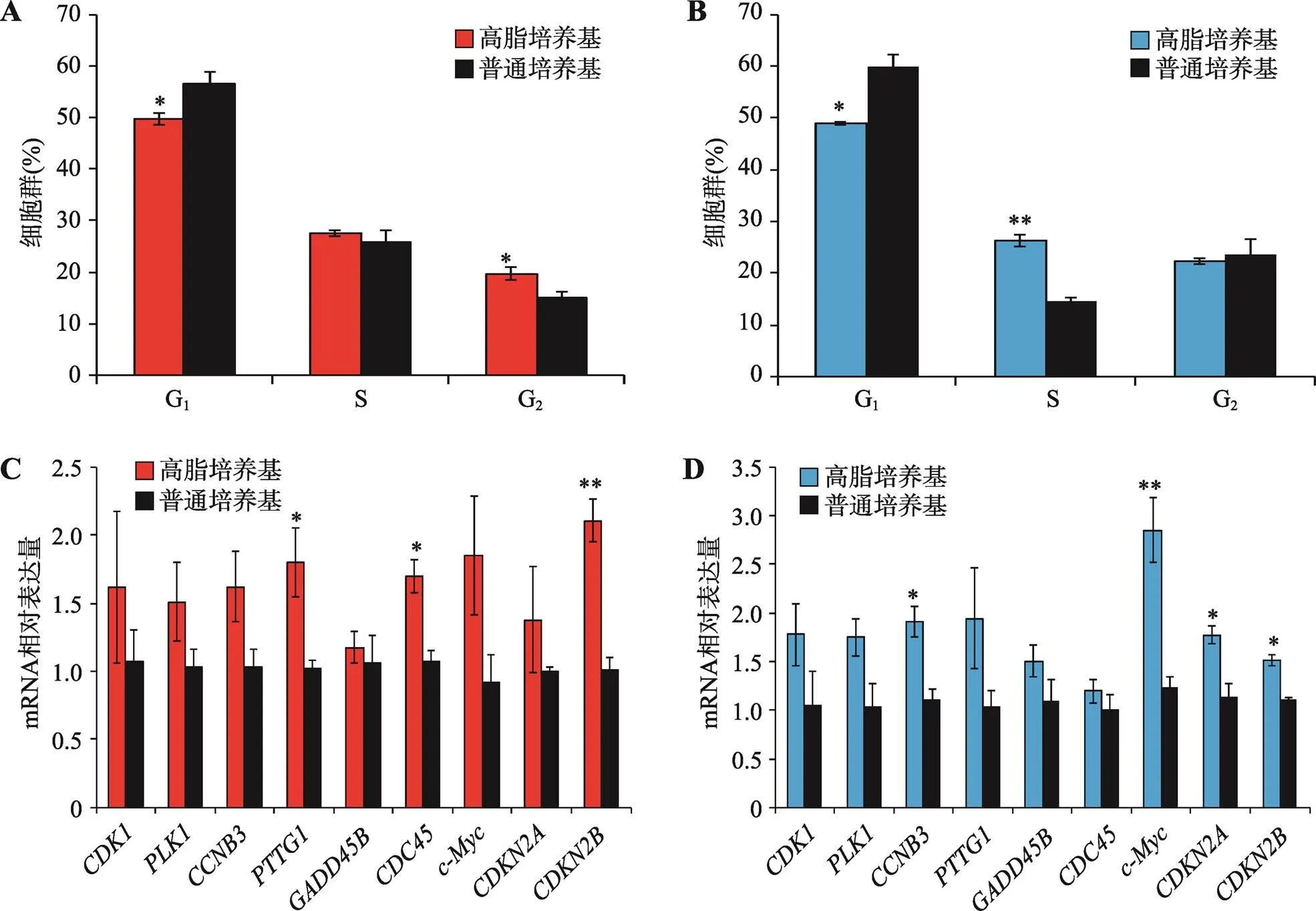
图5 高脂培养基可促进家鸡肝脏细胞和前脂肪细胞的细胞周期进程
A:LMH细胞分别由高脂和普通培养基培养48 h后细胞周期分布情况;B:ICP细胞分别由高脂和普通培养基培养48 h后细胞周期分布情况;C:LMH细胞分别由高脂和普通培养基培养48 h后细胞周期相关基因的表达情况;D:ICP细胞分别由高脂和普通培养基培养48 h后细胞周期相关基因的表达情况。*<0.05,**<0.01。
3 讨论
肥胖被认为是由能量摄入和消耗之间的长期不平衡而导致的脂肪量增加[13~15]。研究表明,肉鸡腹部脂肪总重量直接受日粮能量水平的影响。高脂饲粮通过提高日粮能量水平对肉鸡腹脂沉积有积极影响[16]。本研究用高脂饲粮对中国地方品种肉鸡进行饲养,发现高脂喂养可显著增加腹脂重和腹脂率。对腹脂细胞的切片分析表明,这种腹脂重量的增加可能是通过增大腹脂细胞的体积来实现的。另一方面,本研究通过分析高脂饲粮和正常饲粮喂养肉鸡的肝脏和腹脂中的差异表达基因,发现高脂喂养还可激活细胞周期相关基因的表达,促进细胞周期进程。因此,推测高脂喂养所导致的腹脂含量增加,可能还通过促进腹脂细胞增殖,从而增加腹脂细胞的数量来实现。
体内脂质的稳态受到多条代谢通路的调控,如PPAR信号通路、细胞外基质受体(extracellular matrix receptor,ECM-receptor)通路、Wnt信号通路、胰岛素信号通路等,而且这些通路可以相互作用形成复杂的调控网络调节脂质代谢的平衡[6]。在本研究结果中,包括PPAR信号通路和ECM-receptor通路都在差异表达基因的KEGG通路中富集。在脂代谢的研究中,PPAR家族对脂代谢的作用非常重要,其中关系最为密切的是PPARα,该蛋白主要分布于骨骼肌和肝脏[17]。PPARα是脂肪酸代谢的通用调节因子,对小鼠分别进行正常和高脂的饲喂,结果显示高脂组PPARα、三磷酸腺苷结合盒转运体A1 (ATP-binding cassette transporter A1,ABCA1)、载脂蛋白AI (apolipoprotein A-I, ApoAI)在肌肉组织中的mRNA表达与正常组相比都显著降低[18]。PPARα在血脂代谢中对降低血清甘油三酯(triglyceride, TG) 和升高高密度脂蛋白胆固醇(high density liptein cholesterol, HDL-C)有重要作用[19]。基因能正向调节前脂肪细胞的分化、脂肪酸氧化及脂质代谢[20]。抑制能阻断前脂肪细胞分化,抑制脂肪合成及沉积[20]。PPARγ是重要的细胞分化转录因子,在哺乳动物的脂肪组织中有丰富的表达[21]。研究发现PPAR在肝脏脂肪的合成中有重要的作用,并推测该基因是影响鸡脂肪代谢的主效基因[22]。高脂喂养诱导肥胖过程中不同部位的脂肪细胞PPARγ和CCAAT增强子结合蛋白α (CCAAT enhancer-binding proteins, C/EBPα)蛋白的表达均显著上调,说明高脂喂养可促进前脂肪细胞增殖和分化[23],这与本研究结果类似。在对牛的不同躯体部位脂肪组织的差异表达基因进行KEGG通路富集分析,发现ECM-receptor通路是各组差异表达基因中共同富集到的通路,同时也是许多富集通路中的1个子通路[24]。本研究中,高脂鸡和普饲鸡中腹脂组织差异表达基因也能富集于ECM-receptor通路中,表明该通路在不同物种中均可影响脂肪代谢相关进程。
Hammarstedt等[25]研究发现,鹅被填饲后,脂肪细胞中甘油三酯合成增加,脂肪细胞体积增大,这与本研究用高脂喂养肉鸡的结果类似。脂肪细胞中甘油三酯过度堆积时,会引起脂肪细胞内脂质代谢异常,脂肪酸的合成和氧化减弱,最终导致脂肪组织功能失调,甘油三酯异位沉积形成脂肪肝[26,27]。同时,高脂喂养会降低肝脏组织等对胰岛素的敏感性,从而产生胰岛素抵抗,诱发肝脏中甘油三脂的异位沉淀[28]。在瘦肉型和肥胖型肉鸡肝脏基因表达差异分析中,发现差异表达基因与Wnt、胰岛素信号和细胞周期通路有关,且这3个通路对鸡脂质代谢有重要影响[29]。本研究同样发现细胞周期通路与高脂诱导的鸡腹脂沉积相关,高脂喂养可能通过激活肝脏和腹脂组织中肝细胞和前脂肪细胞的细胞周期进程,刺激脂肪代谢和脂肪细胞增加,最终导致腹脂沉积。在高脂饮食引起的小鼠肥胖中,脂肪生成对于脂肪组织的扩张起重要作用。高脂饮食可促进早期脂肪形成过程中细胞周期的重新进入,促进脂肪生成,导致脂肪组织扩张[30]。
脂肪含量的多少是由脂肪细胞的数量和单个脂肪细胞的体积来决定的。本研究发现高脂喂养会导致单个脂肪细胞的体积增大。但没有检测高脂鸡和普饲鸡在腹脂细胞数量上的差异。利用22个月大的Spragua-Dawley雌性大鼠研究高脂肪饮食对前脂肪细胞增殖的影响,发现高脂饮食可以刺激大鼠的前脂肪细胞增殖[31]。除此之外,也有其他研究表明高脂饮食会促进小鼠或大鼠中前脂肪细胞的增殖[32,33]。高脂饮食会促使血小板反应蛋白-1 (thrombospondins-1, TSP-1)在小鼠脂肪组织发育中上调[34],TSP-1是一种典型的基质细胞蛋白[35],在大多数正常成人组织中不表达,但在损伤、肿瘤和修复中的组织中显著上调[36~38]。Kong等[39]研究发现,脂肪组织中TSP-1的上调会增加体重,并增强脂肪炎症活性,其作用可能部分通过促进前脂肪细胞增殖来实现。因此,在肉鸡中,高脂喂养所导致的腹脂增加可能与细胞周期或细胞增殖的激活紧密相关。
[1] Haslam DW, James WP. Obesity., 2005, 366(9492): 1197–1209.
[2] Luppino FS, de Wit LM, Bouvy PF, Stijnen T, Cuijpers P, Penninx BW, Zitman FG. Overweight, obesity, and depression: a systematic review and meta-analysis of longitudinal studies., 2010, 67(3): 220–229.
[3] Yan H, Zheng P, Yu B, Yu J, Mao X, He J, Huang Z, Chen D. Postnatal high-fat diet enhances ectopic fat deposition in pigs with intrauterine growth retardation., 2017, 56(2): 483–490.
[4] Tu YJ, Yu DY. Study on the effects of enclosure and grazing on growth and meat quality of local chickens., 2004, 26(19): 46–47.屠友金, 余东游. 圈放结合对土鸡生长和肉质的影响探讨. 中国家禽, 2004, (19): 46–47.
[5] Lang QQ. Study on the selection method of abdominal fat rate of high quality chicken[Dissertation]. South China Agricultural University, 2018.郎倩倩. 优质鸡腹脂率选种方法的研究[学位论文]. 华南农业大学, 2018.
[6] Abdalla BA, Chen J, Nie Q, Zhang X. Genomic insights into the multiple factors controlling abdominal fat deposition in a chicken model., 2018, 9: 262.
[7] Gong DQ, Li H, Yang S, Zhang DX, Wang QG, Yu H, Zhang HW. Selective effect of plasma VLDL concentration in broilers - body weight and plasma VLDL., 1999(11): 1–3.龚道清, 李辉, 杨山, 张德祥, 王启贵, 于赫, 张宏伟. 肉鸡血浆VLDL浓度的选择效应——肉仔鸡体重和血浆VLDL. 黑龙江畜牧兽医, 1999(11): 1–3.
[8] Wijayatunga NN, Pahlavani M, Kalupahana NS, Kottapalli KR, Gunaratne PH, Coarfa C, Ramalingam L, Moustaid- Moussa N. An integrative transcriptomic approach to identify depot differences in genes and microRNAs in adipose tissues from high fat fed mice, 2018, 9(10): 9246–9261.
[9] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method., 2001, 25(4): 402–408.
[10] Nishimichi N, Aosasa M, Kawashima T, Horiuchi H, Furusawa S, Matsuda H. Biological activity of recombinant chicken interleukin-6 in chicken hybridoma cells., 2005, 106(1–2): 97–105.
[11] Wang W, Zhang T, Wu C, Wang S, Wang Y, Li H, Wang N. Immortalization of chicken preadipocytes by retroviral transduction of chicken TERT and TR., 2017, 12(5): e0177348.
[12] Li DD. Study on the mechanism of targeted regulation of Dvl2 on BMSCs osteogenic differentiation by microRNA- 29c-3p in high-fat environment [Dissertation]. Shandong University, 2017.李多多. 高脂环境下miR-29c-3p靶向调节Dvl2对BMSCs成骨分化机制研究[学位论文]. 山东大学, 2017.
[13] Weiser M, Frishman WH, Michaelson MD, Abdeen MA. The pharmacologic approach to the treatment of obesity., 1997, 37(6): 453–473.
[14] Surwit RS, Kuhn CM, Cochrane C, McCubbin JA, Feinglos MN. Diet-induced type II diabetes in C57BL/6J mice., 1988, 37(9): 1163–1167.
[15] Stunkard AJ. Current views on obesity., 1996, 100(2): 230–236.
[16] Mabray CJ, Waldroup PW. The influence of dietary energy and amino acid levels on abdominal fat pad development of the broiler chicken., 1981, 60(1): 151– 159.
[17] Ma LA, Qiu HL, Li L, Gou DM. MicroRNAs regulate lipid metabolism through PPAR and AMPK/SREBPs signaling pathways., 2017, 37(06): 1017–1029.马柳安, 邱惠玲, 李荔, 苟德明. MiRNA通过PPAR和AMPK/SREBPs信号通路调控脂质代谢. 生命的化学, 2017, 37(06): 1017–1029.
[18] Campbell FM, Kozak R, Wagner A, Altarejos JY, Dyck JR, Belke DD, Severson DL, Kelly DP, Lopaschuk GD. A role for peroxisome proliferator-activated receptor alpha (PPARalpha) in the control of cardiac malonyl-CoA levels: reduced fatty acid oxidation rates and increased glucose oxidation rates in the hearts of mice lacking PPARalpha are associated with higher concentrations of malonyl-CoA and reduced expression of malonyl-CoA decarboxylase., 2002, 277(6): 4098–4103.
[19] Li QW, Huang LP, Wang H, Cao LJ, Zhang W. Effect of aerobic exercise on expression of PPARα, ABCA1 and ApoAI mRNA in high-fat diet rats muscles., 2009, 28(02): 172–174.李庆雯, 黄力平, 王慧, 曹龙军, 张薇. 有氧运动对高脂饲料喂养大鼠血脂及骨骼肌PPARα、ABCA1及ApoAI mRNA表达的影响. 中国运动医学杂志, 2009, 28(02): 172–174.
[20] Turay J, Grniaková V, Valka J. Changes in paraoxonase and apolipoprotein A-I, B, C-III and E in subjects with combined familiar hyperlipoproteinemia treated with ciprofibrate., 2000, 26(3): 83–88.
[21] Chen YX, Wang WM, Zhou T, Chen N. PPAR-γ and related signal transduction pathways., 2006, 28(3): 382–386.陈永熙, 王伟铭, 周同, 陈楠. PPAR-γ作用及其相关信号转导途径. 细胞生物学杂志, 2006, 28(3): 382–386.
[22] Meng H, Li H, Wang YX. Cloning and sequence analysis of cDNA encodinggene., 2004, 26(4): 469–472.孟和, 李辉, 王宇祥. 鹅基因全长cDNA的克隆和序列分析. 遗传, 2004, 26(4): 469–472.
[23] Liu SS, Zhao YJ, Zhang LJ, Jia ZY, Lian JC, He YX. Role of proliferative differentiation of preadipocytes in obesity induced by high-fat diet and exercise prevention of obesity., 2017, 36(8):667–674.刘绍生, 赵永军, 张琳静, 贾志友, 连军超, 何玉秀. 前脂肪细胞增殖分化在高脂膳食诱导大鼠肥胖及运动预防肥胖中的作用. 中国运动医学杂志, 2017, 36(8):667–674.
[24] Lee HJ, Jang M, Kim H, Kwak W, Park W, Hwang JY, Lee CK, Jang GW, Park MN, Kim HC, Jeong JY, Seo KS, Kim H, Cho S, Lee BY. Comparative transcriptome analysis of adipose tissues reveals that ECM-receptor interaction is involved in the depot-specific adipogenesis in cattle., 2013, 8(6): e66267.
[25] Hammarstedt A, Andersson CX, Rotter SV, Smith U. The effect of PPARgamma ligands on the adipose tissue in insulin resistance., 2005, 73(1): 65–75.
[26] Luo JB, Yuan QY, Tao ZR, Tian Y, Li GQ, Wang DQ, Yuan AP, Zou LL, Lu LZ, shen JD, Shi FX. Study on the tissue expression characteristics of PPARs in geese before and after feeding., 2008, 30(15): 24–27.罗锦标, 袁青妍, 陶争荣, 田勇, 李国勤, 王德前, 原爱平, 邹丽丽, 卢立志, 沈军达, 石放雄. 填饲前后鹅PPARs基因组织表达特性的研究. 中国家禽, 2008, 30(15): 24–27.
[27] Song QW. Research progress of key enzymes in animal fat metabolism., 2007, (03): 65–67.宋庆文. 动物脂肪代谢过程中关键酶的研究进展. 畜牧与饲料科学, 2007, (03): 65–67.
[28] Oakes ND, Cooney GJ, Camilleri S, Chisholm DJ, Kraegen EW. Mechanisms of liver and muscle insulin resistance Induced by chronic high-fat feeding., 1997, 46(11): 1768–1774.
[29] He Q, Wang SZ, Leng L, Na W, Wang QG, Li H. Differentially expressed genes in the liver of lean and fat chickens., 2014, 13(4):10823–10828.
[30] Qiu N, Fang WJ, Li HS, He ZM, Xiao ZS, Xiong Y. Impairment of primary cilia contributes to visceral adiposity of high fat diet-fed mice., 2017, 119(2): 1313–1325.
[31] Ellis JR, Mcdonald RB, Stern JS. A diet high in fat stimulates adipocyte proliferation in older (22 month) rats., 1990, 25(2): 141–148.
[32] Lemonnier D. Effect of age, sex, and sites on the cellularity of the adipose tissue in mice and rats rendered obese by a high-fat diet., 1972, 51(11): 2907–2915.
[33] Liu Z, Uesaka T, Watanabe H, Kato N. High fat diet enhances colonic cell proliferation and carcinogenesis in rats by elevating serum leptin., 2001, 19(5): 1009–1014.
[34] Voros G, Maquoi E, Demeulemeester D, Clerx N, Collen D, Lijnen HR. Modulation of angiogenesis during adipose tissue development in murine models of obesity., 2005, 146(10): 4545–4554.
[35] Bornstein P. Diversity of function is inherent in matricellular proteins: an appraisal of thrombospondin 1., 1995, 130(3): 503–506.
[36] Frangogiannis NG. Matricellular proteins in cardiac adaptation and disease., 2012, 92(2): 635–688.
[37] Kazerounian S, Yee KO, Lawler J. Thrombospondins in cancer., 2008, 65(5): 700–712.
[38] Kyriakides TR, Maclauchlan S. The role of thrombospondins in wound healing, ischemia, and the foreign body reaction., 2009, 3(3–4): 215–225.
[39] Kong P, Gonzalez-Quesada C, Li N, Cavalera M, Lee DW, Frangogiannis NG. Thrombospondin-1 regulates adiposity and metabolic dysfunction in diet-induced obesity enhancingadipose inflammation and stimulating adipocyte proliferation., 2013, 305(3): E439–E450.
The cell cycle pathway regulates chicken abdominal fat deposition as revealed by transcriptome sequencing
Jiahui Chen, Xueyi Ren, Limin Li, Shiyi Lu, Tian Cheng, Liangtian Tan, Shaodong Liang, Danlin He, Qingbin Luo, Qinghua Nie, Xiquan Zhang, Wen Luo
With the improvement of growth traits and feed conversion rate, the abdominal fat rate of Chinese local breeds of broilers has been increasing. Excessive abdominal fat deposition not only reduces the slaughter rate and disease resistance of broiler chickens, but also produces waste due to the difficulty of fat treatment. In order to study the regulatory genes and pathways involved in abdominal fat deposition of broilers, we used high-fat diets to feed the Xinghua Chicken, which is a Chinese local breed. Two weeks after feeding, we found that the abdominal fat weight and rate of broilers in the high-fat diet group increased significantly, and the diameter and area of abdominal fat cells also increased significantly. Transcriptome sequencing of abdominal fat and livers showed that the differentially expressed genes in the abdominal fat were mainly enriched in the cell cycle, peroxisome proliferator-activated receptor (PPAR) and extracellular matrix (ECM) receptor signaling pathways. The differentially expressed genes in livers were also significantly enriched in the cell cycle pathway, as well as in the steroid biosynthesis and PPAR signaling pathway. By analyzing the common differentially expressed genes in abdominal fat and liver tissues, we found that these genes were also enriched in cell cycle. Finally, we used the chicken LMH (chicken hepatoma cell) cell line and chicken ICP (immortalized chicken preadipocytes) cell line to do thevalidation assays. We used high-fat and common medium to culture the cells. The results showed that after 48 hours, the high-fat medium could significantly promote cell cycle and increase the number of cells in S phase. Additionally, qRT-PCR results showed that the high-fat medium could significantly promote the expression of genes related to cell cycle. In conclusion, we found that high-fat diets activate the cell cycle progressionof chicken hepatocytes and preadipocytes, promote cell proliferation, and then increase abdominal fat deposition.
Xinghua chicken; high-fat diet; abdominal fat deposition; cell cycle; differentially expressed genes
2019-04-09;
2019-07-05
国家自然科学基金项目(编号:31702105),国家肉鸡产业技术体系岗位科学家项目(编号:CARS-41-G03)和广州市科技计划项目重点项目(编号:201804020088)资助[Supported by the National Natural Science Foundation of China (No.31702105), the China Agriculture Research System (No.CARS-41-G03), and the Science and Technology Program of Guangzhou, China (No.201804020088)]
陈家辉,本科生,专业方向:动物科学。E-mail: 1046755192@qq.com
任学义,本科生,专业方向:动物科学。E-mail: 935269360@qq.com
陈家辉和任学义并列第一作者。
罗文,博士,副教授,研究方向:家禽遗传育种。E-mail: luowen729@scau.edu.cn
10.16288/j.yczz.19-098
2019/10/10 15:41:19
URI: http://kns.cnki.net/kcms/detail/11.1913.r.20191010.1100.001.html
(责任编委: 李辉)
