MTHFR基因检测及孕期补充叶酸与子痫前期发病风险的相关分析
2019-11-07卜春艳范永周郭战坤
卜春艳, 王 颖, 王 微, 范永周, 郭战坤
(保定市妇幼保健院1妇产科, 2内科, 3医教科, 河北 保定 071000)
子痫前期(preeclampsia, PE)是一种病因的异质性疾病,其主要特征为妊娠20周后出现高血压和蛋白尿症状,严重时可导致终末器官损伤。虽然子痫前期病情在分娩前仍可保持轻微,但也可能迅速演变为严重的器官或全身并发症,如严重的高血压、蛋白尿和以溶血、肝酶升高、血小板减少等为主要特征的HELLP综合征,直接威胁孕妇和胎儿健康[1-2]。研究发现,子痫前期作为全球孕产妇死亡第三大原因,大约影响2%~8%的妊娠,有超过三分之一的严重产科疾病与子痫前期密切相关[3-4]。近些年,人们发现高同型半胱氨酸血症与子痫前期密切相关,补充叶酸可影响机体同型半胱氨酸(Homocysteine, Hcy)代谢[5-6]。此外,机体叶酸代谢关键酶5,10-亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase, MTHFR)基因的突变可以影响机体叶酸和Hcy的代谢,进而影响子痫前期的发病[7]。故本研究旨在评估孕期补充叶酸和MTHFR基因多态性分析与子痫前期发病风险的相关性,为子痫前期早期风险预测和预防提供新思路。
1 资料与方法
1.1 一般资料筛选2017年6月-2018年5月于保定市妇幼保健院产科检查经子宫动脉多普勒波分析判定为子痫前期高风险的初产孕妇215例。采用随机抽样的方式将215例受试者随机分为干预组A、干预组B和对照组,各组分别为72例、72例和71例。干预组A孕妇年龄为22~31岁,平均年龄(27.8±6.1)岁;干预组B孕妇年龄为21~31岁,平均年龄(28.5±6.3)岁;对照组孕妇年龄为22~30岁,平均年龄(28.2±5.9)岁。各组受试者在年龄、肥胖(BMI>30 kg/m2)、糖尿病、H型高血压(伴有高同型半胱氨酸血症的原发性高血压)例数、血压[收缩压(SBP)、无创测量血压(NBP)]、血生化[低密度脂蛋白(LDL)、总胆固醇(TC)、甘油三酯(TG)、同型半胱氨酸(Hcy)]等方面无明显差异(P>0.05),均衡可比。纳入标准:(1)子宫动脉多普勒分析判定为子痫前期高风险;(2)有以下风险因素之一者:慢性高血压、孕前糖尿病、肥胖;(3)初次妊娠;(4)孕期为22~24周;(5)对本次研究均知情并同意。排除标准:(1)多胎妊娠者;(2)已接受其他预防性治疗者;(3)对叶酸过敏者;(4)既往有抑郁病史者。
1.2 干预方法干预组A(72例)孕妇每日服用0.8 mg叶酸(0.4 mg/片,江西制药有限责任公司,国药准字H36020872),2次/日。干预组B(72例)孕妇每日服用同一品牌叶酸0.4 mg,1次/日。对照组口服片剂相同的酵母片。
1.3 子痫前期的诊断标准入组后受试者出现SBP≥140 mmHg或NBP≥90 mmHg并伴有蛋白尿(即尿蛋白≥0.3 g/24 h)则被判定为子痫前期。如果SBP≥160 mmHg或者NBP≥110 mmHg,生化指标和血常规指标异常,并出现明显的子痫前期症状,则被评定为重度子痫前期,否则判定为轻度。本研究入组子痫前期高风险预测根据子宫动脉多普勒波参数预测,所有疾病诊断均由2名经验丰富的主治以上医师判定,减少诊断信息偏倚。
1.4 MTHFR基因C677T位点多态性检测入组次日采集受试者空腹静脉血5 mL,置于EDTA抗凝管中。用基因组DNA提取试剂盒[由天根生化科技(北京)有限公司提供]提取孕妇全血中DNA,设计PCR引物如下:上游引物:5′-TGA AGG AGA AGG TGT CTG CGG GA-3′;下游引物:5′-AGG ACG GTG CGG TGA GAG TG-3′。扩增DNA中C677T位点的198 bp基因片段。设置PCR扩增程序:95℃,5 min;95℃,30 s;65℃,30 s;72℃,30 s;72℃,10 min;32个循环。将PCR扩增所得PCR产物用Hinf I核酸内切酶酶切3 h。将酶切产物行DNA凝胶电泳,并根据电泳结果中DNA片段大小判定基因型类型和等位基因分布:野生型CC为一个198 bp的片段;纯合TT为175 bp和23 bp两个片段;突变杂合型CT为23 bp、175 bp和198 bp三个片段。T等位基因频数=TT频数×2+CT频数;C等位基因频数=CC频数×2+CT频数。
1.5 实验室检查同“1.4”收集受试者静脉血,离心取上清,Hcy和叶酸采用通过电化学发光试剂盒测定,LDL、TC、TG指标由全自动生化分析仪检测。
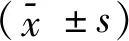
2 结果
2.1 干预组和对照组受试者基线特征比较干预组A、干预组B和对照组受试者年龄、肥胖例数、糖尿病例数、H型高血压例数差异均无统计学意义(P>0.05)。血压(SBP、NBP)、血生化(LDL、TC、TG、Hcy)指标差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 干预组和对照组受试者基线特征比较
2.2 干预组和对照组子痫前期发病情况干预组A、干预组B和对照组受试者的子痫前期发病率差异有统计学意义(P<0.05),对照组的子痫前期发病率最高,为56.3%,明显高于干预组A(33.3%)和干预组B(31.9%),干预组A和干预组B的子痫前期发病率差异无统计学意义(P>0.05)。3组轻度子痫前期的发病率差异无统计学意义(P>0.05)。对照组重度子痫前期的发病率显著高于干预组A和干预组B(P<0.05),见表2。
对干预组和对照组子痫前期并发症的发生情况进行分析,显示3组均有胎儿生长受限和羊水过少发生,但3组的发生率差异无统计学意义(P>0.05)。对照组出现2例胎盘早剥,但发生率较低,见表3。

表2 干预组和对照组子痫前期发病情况/例(%)

表3 干预组和对照组子痫前期并发症的发生情况/例(%)
2.3 PE组和正常组C677T位点基因型及等位基因分布比较根据子痫前期发生与否将所有受试者分为2组:子痫前期(PE)组和正常组。PE组根据严重程度不同又可分为轻度和重度。子痫前期组孕妇TT 基因型和T677 等位基因频率分别为34.5%和58.6%,显著高于正常组孕妇的14.1%和31.6%(P<0.05)。CC 基因型和C677 等位基因频率分别为17.2%和41.4%,显著低于正常组的50.8%和68.4%(P<0.05)。子痫前期组CT基因型与正常组差异无统计学意义(P>0.05)。在不同严重程度的子痫前期孕妇中,轻度子痫前期和重度子痫前期的基因型频率分布和等位基因分布差异均无统计学意义(P>0.05),见表4。
2.4 PE组和正常组不同基因型孕妇血清中Hcy代谢指标的含量比较子痫前期组孕妇血清Hcy含量均显著高于正常组(P<0.05)。不同基因型的比较发现,TT基因型的子痫前期孕妇Hcy显著高于CT基因型和CC基因型的子痫前期孕妇(P<0.05),但CT基因型和CC基因型的子痫前期孕妇血清中Hcy含量无明显差异(P>0.05)。正常组不同基因型的Hcy含量无明显差异(P>0.05)。

表4 PE组和正常组C677T位点基因型及等位基因分布比较/例(%)
子痫前期组孕妇血清叶酸含量均显著低于正常组(P<0.05)。在子痫前期组内部,TT基因型、CT基因型和CC基因型叶酸含量逐步递升,组间差异均有统计学意义(P<0.05)。在正常组内部,CC基因型叶酸含量显著高于TT基因型和CT基因型(P<0.05),TT基因型和CT基因型间无明显差异(P>0.05),见表5。

表5 PE组和正常组不同基因型孕妇血清中Hcy代谢指标的含量比较
注:与正常组比较,*P<0.05; 与TT基因型比较,#P<0.05; 与CC基因型比较,△P<0.05。
3 讨论
子痫前期(PE)是导致孕产妇和新生儿患病和死亡的主要原因之一,子痫前期死亡占孕产妇总死亡的16%,是妊娠相关性死亡的第三大病因[8]。子痫前期孕妇发生胎盘早剥,血小板减少,弥散性血管内凝血,肺水肿和吸入性肺炎的风险增加3~25倍,而且有PE病史的女性心血管疾病发病风险增加。因此,如何预测和预防子痫前期则变得尤为重要。
近年来,随着超声技术的发展,子宫动脉多普勒波分析在预测子痫前期中的价值逐渐显现出来。在正常妊娠中,孕妇子宫动脉助力随着孕龄的增加而降低,而PE孕妇的子宫动脉血流阻力会随着孕龄的增加而增加[9]。因此,可以通过子宫动脉多普勒检查间接检查子宫胎盘灌注的充分性,从而预测孕妇子痫前期风险[10]。本研究参考了张弘雎等[11]提出的子宫动脉阻力评分法,将总阻力分值>3分的孕妇判定为子痫前期高风险者[12],根据受试者意愿自觉选择入组与否。本研究中,对照组71例未经任何干预预防的孕妇,子痫前期发病率高达56.3%,明显高于人群3.9%的发病率[8],再次印证了子宫动脉多普勒波分析在预测孕妇子痫前期风险的价值。
子痫前期的发病机制尚未完全阐释,但更多的研究认为内皮细胞激活和损伤是其发生的重要因素,而血浆高Hcy水平可能与血管内皮细胞损伤直接或间接相关。MTHFR是叶酸代谢通路的关键酶,具有催化5,10-亚甲基四氢叶酸还原为5-甲基四氢叶酸,还原下来的甲基可参与Hcy的甲基化。MTHFR有C和T两个等位基因,野生型CC可突变为突变型TT和杂合型CT,突变后的MTHFR基因稳定性和活性均发生变化,从而使Hcy的代谢发生变化引起高Hcy血症。Hcy是甲硫氨酸代谢循环中的副产物,S腺苷半胱氨酸脱腺苷为同型半胱氨酸(Hcy),Hcy再经N5-甲基四氢叶酸转甲基酶脱甲基生成甲硫氨酸。而叶酸和Vit B12是N5-甲基四氢叶酸转甲基酶的重要辅助因子,其含量对Hcy代谢有着重要的影响。因此,研究MTHFR基因型和孕期补充叶酸与子痫前期的相关性对于科学预测和预防子痫前期有着重要的价值。
本研究通过子宫动脉多普勒分析筛选子痫前期高风险孕妇,用高、低剂量(0.8 mg和0.4 mg)叶酸给予干预。结果显示,孕期补充叶酸的干预组A和干预组B子痫前期发病率和重度子痫前期发病率均较未补充叶酸的对照组显著降低,而对轻度子痫前期发病率影响不大。值得注意的是,补充高剂量叶酸的干预组A的重度子痫前期发病率(9.7%)明显低于低剂量组(16.7%)。说明补充叶酸可以有效预防子痫前期的发病率,且高剂量叶酸补充对于降低重度子痫前期发病率有较好预防作用,此结果与郭方等[13]、毛宝宏等[14]及Wen等[15]的结果一致,但与Li等[16]的结果不一致。此外,3组子痫前期并发症发生率差异均无统计学意义,这与研究组样本量较少有关,还需要更大样本的研究探究叶酸补充对子痫前期并发症的影响。
根据子痫前期发病与否,本研究将所有受试者重新分组,分为子痫前期组和正常组,分析其基因型与发病的相关性。结果显示,TT基因型、CT基因型和T等位基因在子痫前期组中出现比例更高,而正常组中CC基因型和C等位基因出现比例较高。随后,分析不同基因型患者的血清Hcy和叶酸指标,结果显示,子痫前期组孕妇血清Hcy含量均显著高于正常组(P<0.05)。而子痫前期组内,TT基因型的子痫前期孕妇Hcy显著高于CT基因型和CC基因型的子痫前期孕妇(P<0.05)。子痫前期组孕妇血清叶酸含量均显著低于正常组(P<0.05)。在子痫前期组内,TT基因型、CT基因型和CC基因型叶酸含量逐步递升,组间差异均有统计学意义(P<0.05)。不同的是,叶酸水平与发病与否呈负相关。因此,可以推断,TT基因型和T等位基因可能通过影响血浆Hcy水平而影响子痫前期的发生,TT基因型孕妇具有更高的子痫前期风险。
综上所述,子痫前期严重危害妊娠期母婴健康,MTHFR基因C677T多态性和补充叶酸与子痫前期的发病风险有一定相关性,在子痫前期高风险孕妇中进行MTHFR基因C677T多态性分析,及时补充叶酸,有助于预防子痫前期发生。
