6种基质细胞在肺腺癌浸润前沿的分布特点
2019-11-07黄国福冷晓玲
黄国福, 冷晓玲
(新疆医科大学1第五附属医院肿瘤内科; 2附属肿瘤医院超声科, 乌鲁木齐 830011)
近年来,对肺腺癌的研究主要集中癌细胞本身,忽略了肿瘤间质在肺腺癌发生发展中的作用。肺癌的恶性基质化细胞,在肺癌发生发展过程中,即由原发病灶和转移病灶中的基质细胞逐渐变为辅助肿瘤生长并促进肿瘤细胞的侵袭和转移的细胞,是肺腺癌肿瘤微环境的重要组成[1]。其中,肿瘤相关成纤维细胞(TAF)、肿瘤相关巨噬细胞(TAM)、肿瘤相关树突状细胞(TADC)承担了重要角色,它们又分了不同亚型, TAF:普通成纤维细胞(CD34+TAF)和肌成纤维细胞(α-SMA+TAF);TAM:M1型TAM (CD68+TAM)和M2型TAM(CD163+TAM);TADC:成熟DC(CD83+DC)和未成熟DC(CD1a+DC)。其中,后者亚型均对肺癌的侵袭和转移起到辅助作用。已有研究有针对恶性基质细胞不同亚型表达差异的研究[2],但关于肺腺癌边缘带与中央区域的表达差异性及肺腺癌的边缘带作为肿瘤浸润前沿,是否有强烈的瘤周间质反应,其恶性基质细胞的分布特点是否有自身的特点未见报道。本研究以此为切入点,分析肺腺癌肿瘤相关基质细胞不同亚型和不同区域的分布差异。
1 材料与方法
1.1 临床资料选取2017年1月-2018年6月于新疆医科大学第五附属医院行肺癌根治手术、病理资料完整的肺腺癌标本56例。所有病例术前均未接受过化疗、放疗或其他抗肿瘤治疗。为了保证实验条件的同一性,肺癌组织均取自癌中央区1~2 cm,肺癌边缘带均取自从肿瘤组织边缘向瘤体内1~2 cm范围。患者年龄范围31~72岁,中位年龄49岁。
1.2 实验试剂鼠抗人单克隆CD34、α-SMA、CD68、CD163、CD83和CD1a抗体购自abcam公司,CD83购自SANTA公司,增强型二步法检测试剂盒(PV6002),DAB显色剂,均购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色取材组织包括肺腺癌中央区、边缘带及癌旁2 cm组织。4%多聚甲醛固定后,常规脱水、透明和浸蜡,石蜡包埋。制成 4 μm 切片, 每例切片8张,6张用于免疫组化6 种蛋白的染色,1张用于免疫组化的阴性对照,1张用于HE染色。组织蜡块4 μm连续切片,脱蜡水化,置入柠檬酸缓冲液中,高温高压或微波技术行抗原修复,消除内源性过氧化物酶,滴加适当比例稀释的一抗[CD83(1∶50)、CD34(1∶50)、CD68(1∶200)、α-SMA(1∶200)、CD163(1∶200)和CD1α(1∶200)],后滴加羊抗鼠的IgG/HRP聚合物标记二抗,DAB显色剂(即二氨基联苯胺显色剂)显色,苏木素复染,封片。以已知染色阳性的肺腺癌切片为阳性对照,用PBS缓冲液B取代一抗作阴性对照。
1.4 结果判定光镜下,成纤维细胞形态细长,核细长,CD34和α-SMA均以间质TAF胞浆内出现背景清晰的棕黄色或棕褐色颗粒为阳性。TAM:连续切片,分别进行CD68和CD163染色,CD68+/CD163+判断为M2型TAM。CD68和CD163着色于TAM胞浆。TADC:连续切片,分别进行CD1a和CD83的染色,以CD1a+/CD83-为未成熟TADC。光镜下,CD83+DC的形态不规则,有长短不一的树状突起,CD1a+DC形态较扁平,突起较少且短,免疫组化染色为深褐色,CD1a分子及CD83的表达部位为胞浆和胞膜。
由2位病理科医生在未知患者临床资料情况下阅片,观察靶细胞的分布特征,然后选取100倍光镜下癌间质中所要观察细胞的5个高密度区,分别计算其400倍光镜下阳性细胞数,取其平均值作为癌间质肿瘤辅助细胞的浸润数量。
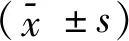
2 结果
2.1 TAF、TAM和TADC在肺腺癌组织与癌旁的分布差异CD34+TAF和α-SMA+TAF、CD68+TAM和CD163+TAM、CD83+DC和CD1a+DC数量无论在癌中央部及癌边缘带,均高于癌旁(P<0.05),见表1。
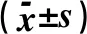
表1 恶性基质细胞在肺腺癌3个区域的表达
注:与癌旁组织相比,▲P<0.05。
2.2 不同亚型的 TAF、TAM和TADC在边缘带与中央区域的分布差异无论在癌中央区域还是边缘带,α-SMA阳性的TAF高于CD34阳性的TAF(P<0.05),CD163阳性的 M2 型TAM高于CD68阳性的M1 型TAM(P<0.05),CD83阳性的TADC高于CD1a阳性的TADC(P<0.05)。在肺腺癌边缘区域,TAM中M1 型与 M2 型数量差异明显,约 80%是 M2 型。
对各种恶性基质细胞在肺腺癌的不同区域的分布差异进行分析,α-SMA阳性的TAF数量在边缘区域较中央区域多;CD34阳性的TAF数量在中央区域较边缘区域多;在中央区域,α-SMA阳性的TAF约占TAF的50%,在边缘区域,α-SMA阳性的TAF约占TAF的60%。CD68阳性的TAM数量在边缘带及中央区域没有区别;CD163阳性的M2型TAM数量在边缘区域多于中央区域;在中央区域,CD163阳性的M2型TAM约占TAM的67%;在边缘区,CD163阳性的M2型TAM约占TAM的76%。CD83阳性的成熟TADC的数量在边缘带及中央区域没有区别;CD1a阳性的未成熟TADC的数量在边缘带多于中央区域;在中央区域,CD1a阳性的未成熟TADC约占TADC的39%,在边缘区域,CD1α阳性的TADC约占树突状细胞的72%(P<0.05),见图1、2。

图2 肺腺癌部分恶性基质细胞在区域性分布差异
3 讨论
在肺腺癌的形成阶段,抗肿瘤和促肿瘤炎症之间的平衡,依赖肿瘤生长过程中多种免疫细胞和间质细胞活化。在肺腺癌的发生及发展过程中,肿瘤浸润的免疫炎性细胞发挥了重要的作用,被招募到微环境中的免疫细胞建立了复杂的细胞间相互网络关系,可以促进肿瘤细胞向恶性发展,同时也会抑制肿瘤的增殖,这取决于肿瘤相关免疫细胞的不同亚型。在癌变与恶性基质化平行的进程中,基质中的细胞成分从保护机体的免疫机制的亚型转变为支持肿瘤细胞生长、增殖、浸润和转移的“辅助肿瘤的细胞”的亚型[1]。本研究结果也表明,CD34+TAF和α-SMA+TAF、CD68+TAM和CD163+TAM、CD83+DC和CD1a+DC数量无论在癌中央部及癌边缘带,均高于癌旁组织,也印证了恶性基质化在肺腺癌的发生发展中起了重要作用。肺腺癌的边缘区域作为肿瘤浸润前沿有着至关重要的地位,本研究对肿瘤相关免疫细胞是否也在边缘带发挥了更大作用进行了分析。
本研究表明,α-SMA阳性的TAF在边缘区域较多,CD34阳性的TAF在中央区域较多,表明TAF有空间特异性,因肌成纤维细胞总是靠近肿瘤新生血管,而新生血管常常呈网状分布于肿瘤边缘带,这可能是TAF具有明显边缘分布优势的原因。已有研究提示,TAF表型转换与肿瘤细胞距离有关,并且是肿瘤细胞随时间选择的结果,即TAF的亚型(CD34+TAF和α-SMA+TAF)有时空特异性[2-3]。肺腺癌组织中大量的细胞成分是α-SMA+TAF,其细胞增殖能力明显强于CD34+TAF,与永生化的上皮细胞共同注入裸鼠,其成瘤能力高于单独接种上皮细胞500倍[4]。其通过分泌生长因子、炎症细胞因子和刺激癌细胞内信号通路并促进肿瘤侵袭,包括肿瘤生长、转移、应激下代谢和化疗耐药。
无论在肺腺癌的中央区域还是边缘区域,M2型TAM在比例上始终占据优势;而在肺腺癌边缘带区域, M2 型与 M1 型数量差异更明显,提示M2型在肺腺癌发生发展中发挥着主要的功能。本研究提示, M2 型 TAMs 是预测肺腺癌患者预后的独立评价因素,与文献[5-7]的研究结果一致。
肿瘤细胞可以通过释放TGF-β2和IL24等细胞因子阻碍TADC的分化成熟,使TADC处于一种不利于加工和递呈抗原的体内微环境中,称为未成熟DC(CD1a+DC),其具有很强的内吞能力[8]。CD1a 阳性的CD1a+DC主要分布于肿瘤边缘带、癌性间质中, 很少见于周围肺组织。另有研究发现,随着肺癌组织VEGF表达的增强 ,其CD1a+DC密度明显升高。肺腺癌边缘区域往往有较中央密集的网状肿瘤血管,按此推测,边缘区域的未成熟DC密度要高于中央区域,本研究结果正好印证了这一推论。
本研究发现: 肺腺癌边缘带辅助肿瘤生长的恶性基质细胞显著高于癌中央区及癌旁正常肺组织,且差异有统计学意义;且肺腺癌的恶性基质细胞在病灶的不同区域不仅出现数量上的改变又出现不同亚型的改变,作为肿瘤浸润前沿的边缘带,恶性基质细胞无论是数量及与细胞功能有关的亚型都比中央区域更具有侵袭性,边缘带的恶性基质化导致的功能失调以及免疫抑制应该是肺腺癌浸润发展的重要手段,故可考虑用肺腺癌边缘区恶性基质细胞数量及亚型的特点作为病理上判断肺腺癌的侵袭性的依据。
