温度和时间对临床应用间充质干细胞长距离运输的影响
2019-11-07苏鸿君邓雯冯佩苏春燕杨洁文
苏鸿君,邓雯,冯佩,苏春燕,杨洁文
(中山大学孙逸仙纪念医院 生物治疗中心,广东 广州 510120)
0 引言
间充质干细胞是一种具有多向分化潜能和免疫调节能力的成体干细胞,源于发育早期的中胚层和外胚层,存在于人体发育过程的多种组织,主要存在于结缔组织和器官间质中。1976 年,Freidenstein首次发现在骨髓里存在一群不纯的细胞,这群细胞在体外培养时贴壁生长,形态和成纤维细胞类似,呈克隆性生长,并提出了“骨髓间充质干细胞”的概念[1]。根据间充质干细胞的生物学特性,目前已建立了骨髓、脂肪、脐血、脐带等多种组织来源的间充质干细胞的分离、培养、扩增和鉴定的实验方法,其中以骨髓组织中含量最为丰富。间充质干细胞不仅具有强大的增殖能力,同时也具有多向分化潜能。在适宜的体内或体外环境下,MSC 不仅可分化为造血细胞,还具有分化为肌细胞、肝细胞、成骨细胞、软骨细胞、脂肪细胞、基质细胞等多种细胞的潜能[2]。MSC 可以用于细胞疗法治疗骨骼和心血管缺陷以及其他各种退化性疾病和组织损伤[3],MSC 也可以调节免疫和炎症反应用于各种临床试验比如移植物宿主免疫反应和其他自身免疫性疾病[4]。
人类间充质干细胞体外扩增至10 代,细胞形态不发生明显改变,并高表达间质细胞标记CD73、CD90、CD105,不表达造血细胞标记CD34、CD45、CD14。Cai 等发现体外扩增第1 代至第8 代期间MSC 生长速度很快,以指数形式快速增值,且MSC基因组没有显著的改变,仅有一些很低水平的单核苷酸的变化(single-nucleotide change,SNC),仅占0.1 %-1 %;第8 代以后,扩增速度明显降低。第10代到第13代,细胞体积开始增大,核/质比变大,但是细胞的分化潜能从第1 到第13 代几乎没有变化。但是在第13 代的时候,显著地出现了677 个单核苷酸的突变,17 %-36 %的MSC 出现了突变。而且这些突变导致了非同义氨基酸的突变,引发了一些基因(如NOTCH1、ZFP64、SMARCA2、KIAA2018、DCAF8L1 等)的突变。而且他们发现这些基因与成骨分化、骨代谢、肿瘤发生、干细胞干性的保持等功能相关[5]。说明MSC 在体外扩增的过程中,如果代数超过12 代,就会引起MSC 产生癌变的风险。体外扩增的MSC在临床应用上的应用最好限制在12代以内。
但是能制备间充质干细胞的医疗机构必须具备GMP 合格的千级细胞层流房,这样的医疗机构毕竟是少数,所以临床上间充质干细胞的广泛应用必须解决一个远距离运输的问题。一般制备成功的间充质干细胞长途外送过程中会遇到以下问题:(1)液氮冻存的细胞外送:不能上飞机、高铁,若选择汽车,运输时间超过12 小时以上液氮会完全挥发,冻存的细胞会升温死亡;(2)新鲜培养液加至满瓶后置于冰盒中外送:上飞机须托运,总时间长于5 小时,细胞培养液PH 值会升高,影响细胞状态,细胞形态会发生变化,影响细胞分化潜能和免疫调节能力,而且细胞受污染的风险会升高;(3)贴壁细胞用胰酶消化清洗后注射入生理盐水瓶中悬浮密封低温外送:即使随着时间延长,细胞存活率会降低。生理盐水外送的细胞可以直接注射,可以解决一些地区不具备复苏细胞和处理贴壁细胞的条件的问题,而且密封性好污染风险低。但是最佳的外送温度和时间限制的条件不明确,本实验设计以骨髓间充质干细胞为例,测量不同温度和时间对细胞存活率的影响[6]。
1 方法
1.1 人骨髓间充质干细胞的制备
髂后上棘抽取骨髓10-15 mL,加入等体积生理盐水混匀。在15 mL 离心管中加入与骨髓等体积的淋巴细胞分离液,将稀释的骨髓缓慢加入淋巴分离液液面上,水平离心机常温下以1500 r/min 的速度离心20 分钟。从界面上取出的白色的细胞层后用生理盐水洗涤2~3 次后,加适量培养液计数。按5~8×106/mL 浓度接种于25 cm2培养瓶中,每瓶含16 mL L-DMEM 完全培养液。在5 %的CO2和37 ℃的培养箱中静止培养,第3 天半量换液1 次,第6 天全换液,以后每3 天半量换液1 次,第10~12 天细胞达到90 %融合时传代。传代时先倒掉全部培养液,用无Ca2+、Mg2+的PBS 缓冲液洗涤二次,加入37 ℃预热的0.25%胰蛋白酶(含1 mmol/L EDTA)0.5 mL消化2~5 分钟,贴壁细胞层开始脱落时,加入完全培养液5mL 终止胰酶作用。吸管反复吹打后将细胞收集于15 mL 离心管中,1500 r/min 离心10 分钟后弃上清,将细胞悬浮于完全培养液中,计数后按1~2×106/瓶的密度接种于新的75 cm2培养瓶中。继续按1 比2 或1 比3 的比例传至3~4 代,即可得到纯化的人骨髓MSC,并用流式细胞仪进行鉴定。
1.2 人骨髓间充质干细胞的鉴定
将第4 代的MSC 用胰酶消化后,用完全培养液终止后,离心洗涤2 次,用生理盐水重悬细胞浓度至1×106/mL。每一个需要检测的细胞表面标记抗原设置2 支流式管,每一支流式管加入100 ul 的细胞悬液,再分别加入1 test 的同型对照抗体和对应的细胞表面标志抗原流式荧光抗体。人骨髓MSC 需要检测CD73、CD90、CD105、CD34、CD45、CD14、HLADR 等7 个细胞表面标记抗原的表达情况。同时,将每一个MSC 取3×105,种入12 孔板三个孔中,每孔加入1×105,分别加入成骨诱导分化培养基、成脂诱导分化培养基和成软骨诱导分化培养基,进行MSC分化能力鉴定。
1.3 存活率的测定
第4 代的MSC 用胰酶消化并终止后,离心洗涤4次,用生理盐水重悬至预估浓度范围为0.1-10×106/mL,吸取5 ul 细胞悬液和5 ul 台盼蓝染色液,混合均匀后加入细胞计数板,进行活细胞计数。
2 结果
2.1 人骨髓间充质干细胞的制备
淋巴细胞分离液分离后的骨髓细胞在37 ℃的5%CO2细胞培养箱中静止培养后第6-9 天,出现细胞克隆集落(图1),继续培养至10-12 天后可传代,培养30-35 天后传代至第4 代,可以得到较为纯净的人骨髓MSC(图2)。
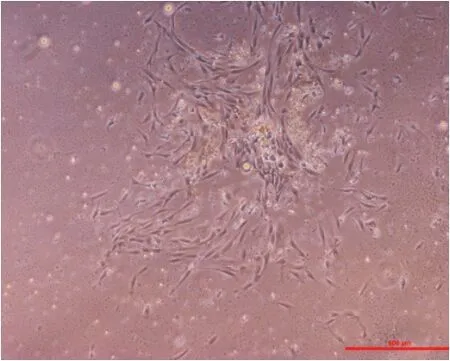
图1 人骨髓MSC P0 代细胞
2.2 人骨髓间充质干细胞的鉴定
将6 个MSC 的第4 代细胞进行细胞表面标记抗原流式鉴定,所有细胞CD73,CD90 和CD105 阳性表达达到95 %以上,CD14,CD34,CD45,HLA-DR 皆几乎不表达,表达率在0-1 %,图3 所示为其中一个MSC细胞表面标记抗原的表达情况。6 个细胞皆可以进行成骨、成脂和成软骨分化,图4 中a,b 和c 分别显示成骨、成脂和成软骨分化阳性的图示。
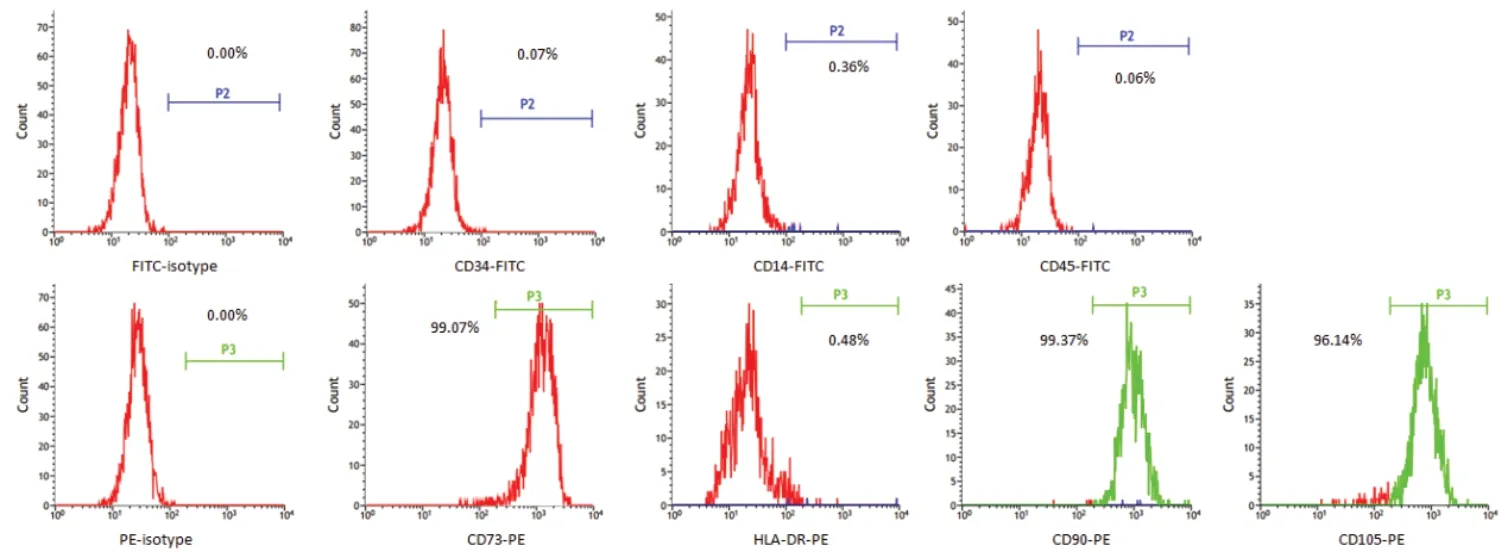
图3 人骨髓MSC 细胞表面标记抗原表达情况
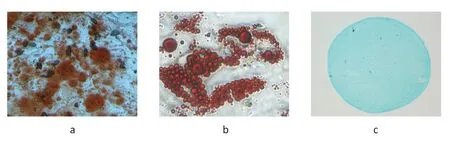
图4 人骨髓MSC 成骨、成脂和成软骨分化鉴定
2.3 时间温度对生理盐水中骨髓间充质干细胞的影响
将6 个4 代的人MSC 分别分成5 份装入100 mL密封生理盐水袋中,分别放入盛冰水混合物的保温盒(0 ℃)、4 ℃恒温车载小型冰箱、装有预先冷冻冰袋的保温盒(8-17 ℃)、常温保温盒(25 ℃左右)和37 ℃恒温培养箱(对照)。将上述30 份细胞分别在6 个时间点(0 h,2 h,4 h,6 h,8 h 和24 h)用无菌1 mL 注射器抽取少量细胞进行存活率检测。发现只有4 ℃恒温保存的细胞保持存活率在90 %上的时间最长,可以达到6 小时,其次是放入装有预先冷冻冰袋的保温盒(8-17 ℃)的细胞,可以达到2 小时(表1)。绘制成折线图后发现4 ℃恒温保存的方法细胞存活率在每个时间点都最高(图5)。
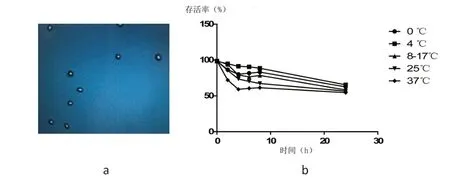
图5 时间和温度对人骨髓MSC 存活率的影响
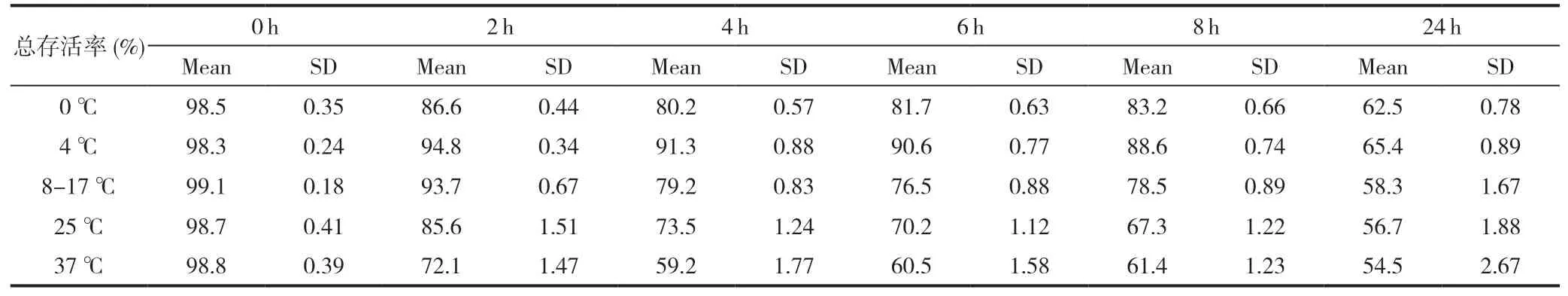
表1 6 个骨髓间充质干细胞(第4 代)制备后重悬于生理盐水中后时间和温度对存活率的影响
3 讨论
随着干细胞产业的飞速发展,干细胞进行远途运输势必会越来越频繁。本实验中发现在4 ℃的恒温保温箱中保持细胞良好活性(存活率90 %以上)的时间最长,可以达到6 小时。随着高铁、飞机等快捷交通工具的应用,这个保存条件基本可以满足干细胞远距离运输的要求。而且随着干细胞多中心的建立,跨省的干细胞运输会越来越少,远距离运输的距离会越来越短,所需时间也会越来越短。从图5,我们可以看出细胞在缺失营养的条件下,温度越低细胞活性越好,这可能与低温条件下细胞的代谢速率降低有关[7-10]。4 ℃恒温条件下细胞活性最好的原因,可能与水在4 ℃时密度最大有关。而处于冰水混合物条件(0 ℃)下细胞的存活率比8-17 ℃还低,可能是因为水虽然在0 ℃时结冰,但水在0 ℃以下,也可以保持液体状态,称为过冷却水,冰水混合物中的液态水中存在温度低于0 ℃的过冷却水。冰水混合物条件下的部分细胞温度可能低于0 ℃,细胞内部产生了结晶,在没有细胞保护液的条件下,细胞会受到伤害,细胞活性就会降低。而且0 ℃的条件也很难保持,时间长看冰水混合物中冰会融化,而将温度调节至0 ℃的小型冰箱也容易结冰。因此,4 ℃才是活细胞运输的最佳温度条件。随着技术的进步,如果出现一种安全无害且可以直接输注人体的悬浮细胞营养保存液,保存时间将远远超过6 小时。
