沙葱萤叶甲气味结合蛋白GdauOBP20的基因克隆、 原核表达及其结合特性
2019-11-07李玲谭瑶周晓榕庞保平
李玲,谭瑶,周晓榕,庞保平
沙葱萤叶甲气味结合蛋白GdauOBP20的基因克隆、 原核表达及其结合特性
李玲,谭瑶,周晓榕,庞保平
(内蒙古农业大学草原昆虫研究中心,呼和浩特 010020)
【】沙葱萤叶甲()是近年来在内蒙古草原上暴发成灾的新害虫,本文旨在克隆沙葱萤叶甲气味结合蛋白基因的cDNA全长序列,明确其重组蛋白与寄主植物挥发物的结合特性,为揭示沙葱萤叶甲嗅觉的分子机理打下基础。基于沙葱萤叶甲转录组数据,利用RACE技术对沙葱萤叶甲气味结合蛋白基因进行cDNA全长克隆;利用生物信息学软件预测分析其编码蛋白的理化特性和结构特征;通过原核表达系统表达目的蛋白,并使用Ni-NTA Agarose亲和层析柱进行重组蛋白纯化。最后采用荧光竞争结合的方法,以N-苯基-1-萘胺(N-phenyl-1-naphthylamine,1-NPN)为荧光探针,检测GdauOBP20重组蛋白与13种主要寄主挥发物的结合情况。的cDNA全长序列为567 bp(GenBank登录号MK250532),其中5′末端非编码区长24 bp,3′末端非编码区长123 bp,具有ployA尾结构;开放阅读框(ORF)全长为420 bp,编码139个氨基酸。氨基酸序列中含有4个保守的半胱氨酸位点,属于Minus-C OBP亚家族。预测蛋白三级结构中含有6个螺旋和两对由半胱氨酸形成的二硫键。成功构建了重组表达载体并获得了高纯度的重组蛋白。重组蛋白GdauOBP20与荧光探针1-NPN的结合常数为12.8 µmol·L-1,结合能力较好,可作为本试验的荧光报告子。在所测的13种主要寄主植物挥发物中,除与二烯丙基三硫醚无结合能力外,GdauOBP20重组蛋白与其他12种寄主植物挥发物均有不同程度的结合能力,其中与对二甲苯和环庚三烯的结合能力最强,解离常数分别为22.91和26.55 µmol·L-1,而与月桂烯结合能力最弱,解离常数为116.29 µmol·L-1。沙葱萤叶甲GdauOBP20能与寄主植物的多种主要挥发性物质结合,推测其可能在沙葱萤叶甲对寄主植物的定位过程中发挥重要的作用。
沙葱萤叶甲;气味结合蛋白;RACE克隆;原核表达;荧光竞争结合试验
0 引言
【研究意义】在昆虫的众多感觉系统中,嗅觉感受系统对于其生命活动起到了至关重要的作用,昆虫通过嗅觉感器接触和分析外界气味信息,从而保证其寻偶、觅食和产卵等生命活动的正常进行[1-2]。气味结合蛋白(odorant binding protein,OBP)是一类水溶性小分子蛋白,它能选择性地结合并运输疏水性气味分子通过感受器淋巴液到达相应的气味受体,从而产生神经冲动,在化学信号转导过程中起着关键的作用[2-5]。研究昆虫OBP与挥发物的结合能力,对揭示其嗅觉机理具有重要意义。【前人研究进展】沙葱萤叶甲()属鞘翅目(Coleoptera),叶甲科(Chrysomelidae),萤叶甲亚科(Galerucinae),是一种主要危害沙葱()、多根葱()、野韭()等百合科葱属植物的寡食性害虫,自2009年在内蒙古锡林郭勒盟草原上首次大面积暴发成灾以来,危害程度日益加重,已经成为内蒙古草原上重要的害虫,严重影响了草原的生态环境质量和畜牧业的可持续发展[6-7]。笔者实验室前期从沙葱萤叶甲成虫转录组中鉴定出29条编码气味结合蛋白的基因,并对它们的表达谱进行了分析,其中特异性地表达于成虫触角中,表明其可能在沙葱萤叶甲气味识别中起关键作用[8]。目前对OBP功能的研究多集中于其对不同气味物质结合特性,涉及到的昆虫种类有美洲大蠊()、中华蜜蜂()、松褐天牛()、枣实蝇()、棉铃虫()、美洲斑潜蝇()、梨小食心虫()及斜纹夜蛾()等[9-16],也有研究者开始应用RNAi[17-21]和CRISPR/Cas9[22]研究OBP的功能,有助于揭示昆虫的化学感受机理。【本研究切入点】气味结合蛋白在沙葱萤叶甲与环境化学信息交流中起着重要作用,然而,目前对沙葱萤叶甲气味结合蛋白功能的研究尚未见报道。【拟解决的关键问题】采用RACE技术克隆的cDNA全长序列,并通过构建原核表达载体诱导重组蛋白大量表达,利用荧光竞争结合试验对重组蛋白与寄主植物的主要挥发物的结合能力进行测定,为揭示沙葱萤叶甲嗅觉感受机理打下基础。
1 材料与方法
1.1 供试昆虫
2017年5月于内蒙古锡林郭勒盟镶黄旗采集沙葱萤叶甲幼虫,置于人工气候培养箱中以沙葱进行饲养。饲养条件为温度(26±1)℃,相对湿度60%—80%,光周期16L﹕8D。待成虫羽化3 d后用手术刀切取雄虫触角,用液氮速冻后存放于-80℃冰箱保存备用。
1.2 RNA的提取及cDNA的合成
取3日龄雄成虫触角40 mg,液氮迅速冷冻研磨后使用TaKaRa Mini BEST Universal RNA Extraction Kit提取总RNA,分别用1.5%的琼脂糖凝胶电泳和微量分光光度计NanoPhotometer® P 330(Implen,Germany)检测RNA完整性和测定RNA浓度。使用反转录试剂盒PrimeScriptTM1st Strand cDNA Synthesis Kit(TaKaRa)合成cDNA第一链。
1.3 GdauOBP20全长cDNA克隆
根据笔者实验室测得的转录组数据筛选并分析得到OBP20的中间片段,在序列两端设计引物(表1),以雄成虫触角cDNA为模板进行PCR扩增。反应体系:cDNA模板1 μL,正反向引物各1 μL,Premix TaqTM(V2.0 plus dye)(TaKaRa)12.5 μL,ddH2O 9.5 μL。反应条件:94℃预变性3 min;94℃变性30 s,50℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。1.5%琼脂糖凝胶电泳检测扩增产物,用DNA凝胶回收试剂盒回收纯化目的片段,连接pMD19-T克隆载体(TaKaRa),转化到大肠杆菌()感受态细胞DH5(TIANGEN)后涂布含氨苄icillin(Amp)的LB固体培养基,37℃培养12 h,挑取白色单菌落进行PCR验证,然后将验证正确的菌液于LB液体培养基中过夜培养,再将菌液进行送样测序。
3′-和5′-末端序列扩增:根据上一步测序验证结果,设计3′-和5′-特异性引物(表1),按照SMARTer® RACE 5′/3′ Kit(TaKaRa)试剂盒说明书进行末端扩增,采用降落式PCR程序如下:94℃ 30 s,72℃ 2 min,5个循环;94℃ 30 s,70℃ 30 s,72℃ 2 min,5个循环;94℃ 30 s,68℃ 30 s,72℃ 2 min,20个循环。再以扩增产物为模板进行巢氏PCR,程序如下:94℃ 30 s,68℃ 30 s,72℃ 2 min,25个循环。得到扩增产物处理方法同上。测序得到的3′-、5′-目的片段序列与中间片段进行拼接,最终得到该基因cDNA全长序列。

表1 本研究所用引物
下划线部分为酶切位点The restriction sites are underlined
1.4 GdauOBP20序列的生物信息学分析
使用PredictProtein(https://www.predictprotein. org/)预测氨基酸序列中的二硫键位置和蛋白二级结构;运用在线软件Swiss-Model(https://www. swissmodel.expasy.org/)对蛋白三级结构进行预测。
1.5 GdauOBP20重组蛋白的诱导表达与纯化
根据开放阅读编码框序列,设计带有I和R I酶切位点的引物(去除信号肽)(表1)。将PCR产物克隆到pMD19-T载体,测序成功的pMD19-T/质粒和表达载体pET-28a进行双酶切,然后将载体片段与目的片段经T4 DNA Ligase(New England Biolabs,NEB)连接。连接产物转入DH5后涂布含卡那霉素Kanamycin的LB固体培养基,37℃过夜培养,鉴定为阳性克隆送样测序。将测序验证后的pET28a/表达质粒转入大肠杆菌BL21(DE3)(TIANGEN)中,挑取单菌落经PCR鉴定,阳性克隆菌落接种于1 mL LB液体培养基中,37℃振荡过夜培养。次日,将所得菌液按1/100的比例接种于新鲜培养基中,37℃振荡培养,当OD600值达到0.6—0.8时,吸取一半的菌液于新的无菌EP管中,加入终浓度为1 mmol·L-1IPTG,另一半作为阴性对照,37℃振荡培养4 h。用SDS-PAGE检测重组蛋白表达情况。将表达良好的重组蛋白进行大量诱导,离心收集菌体,经超声波破碎后分别收集上清和沉淀,用SDS-PAGE检测重组蛋白表达形式。
使用Ni-NTA Agarose亲和层析柱(QIAGEN)进行重组蛋白纯化,用3 500 Da的透析袋在PBS缓冲液中过夜透析。经3 000 Da的超滤管浓缩后,用BCA法测定蛋白浓度。
1.6 GdauOBP20重组蛋白的配基结合试验
试验所用荧光探针1-NPN和气味标准品均购自SIGMA-ALDRICH公司,使用色谱级的甲醇配制成1 mmol·L-1的储备液。用HITACHI(F-7000)荧光分光光度计测定重组蛋白和1-NPN的结合能力。仪器参数设置如下:激发狭缝10 nm,发射狭缝10 nm,灵敏度2 s,激发光波长337 nm,扫描发射光波长范围350—700 nm。取2 mL 2 µmol·L-1的重组蛋白溶液于1 cm宽的石英比色皿中,逐次加入2 µmol·L-11-NPN直至荧光强度值达到饱和值。每次加入1-NPN后进行扫描并记录荧光值。利用其荧光值计算出该蛋白与1-NPN的结合常数,在GraphPad Prism 7.0软件中进行Scatchard分析。然后通过竞争结合试验测定气味物质和蛋白的结合能力。在竞争结合试验中,将被测气味物质逐次加入重组蛋白GdauOBP20与1-NPN的混合体系中至终浓度为100 µmol·L-1,每次记录荧光强度值。每个气味重复测定3次。利用公式Ki= IC50/(1+[1-NPN]/K1-NPN)计算结合常数,其中IC50为荧光强度降至50%时加入的配基浓度,[1-NPN]为未结合的1-NPN浓度,K1-NPN为重组蛋白GdauOBP20与1-NPN的结合常数[23]。
2 结果
2.1 GdauOBP20全长cDNA的克隆及序列分析
经3′和5′ RACE克隆和中间片段拼接得到cDNA全长序列567 bp(图1),已在GenBank中注册,登录号为MK250532。其中5′末端非编码区长24 bp,3′末端非编码区长123 bp,具有ployA尾结构。开放阅读框全长420 bp,编码139个氨基酸,含有4个保守的半胱氨酸位点,属于Minus-C OBP亚家族。蛋白二级结构预测表明,该蛋白中螺旋(helix)、折叠(strand)和卷曲环(loop)分别占56.1%、12.9%和30.9%。以西方蜜蜂()ASP5(SMTL ID:3r72.1 )为模板对其进行蛋白三级结构预测,目的蛋白与模板的氨基酸序列相似性为26.09%。模型结果显示GMQE值为0.66,GMEAN值为-2.21,该值>-4.0,说明模型的质量较高[24]。从图2可以看出,该蛋白含有6个螺旋,由4个半胱氨酸残基形成的两对二硫键Cys38- Cys69和Cys107-Cys127分别连接着1-3和4-6,维持着该蛋白空间结构的稳定。
2.2 GdauOBP20重组蛋白的表达与纯化
诱导表达结果显示,在15 kD左右出现一条蛋白条带。对重组蛋白进行不同IPTG浓度下诱导表达,结果表明GdauOBP20重组蛋白在IPTG终浓度为0.5—0.8 mmol·L-1范围内诱导表达效果最好(图3-A)。表达形式检测结果显示,GdauOBP20重组蛋白在上清中不表达,而是存在于沉淀中以包涵体的形式表达(图3-B)。因此,对包涵体进行复性处理后过柱纯化得到GdauOBP20重组蛋白。

起始密码子和终止密码子用方框标注,信号肽用下划线标注,保守的半胱氨酸用圆圈标注
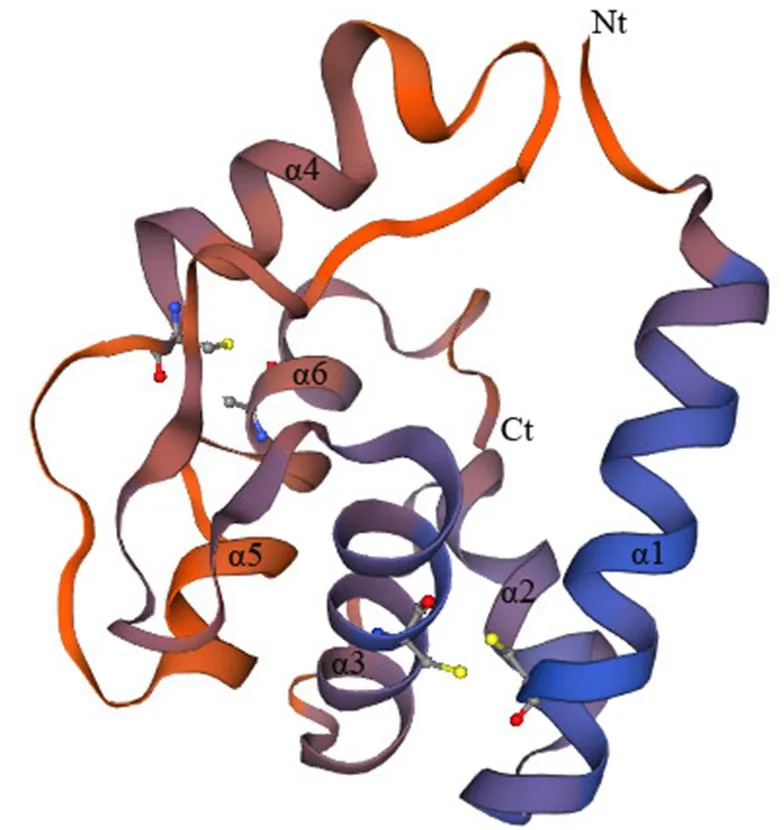
图2 GdauOBP20蛋白的3-D结构预测模型
2.3 GdauOBP20重组蛋白与配基的结合试验
重组蛋白GdauOBP20与荧光探针1-NPN的结合曲线见图4-A。随1-NPN浓度的增加,荧光强度逐渐增强,多项式拟合相关系数为0.9966,结合常数为12.8 µmol·L-1。Scatchard分析线性相关系数为0.9414(图4-B)。以1-NPN为探针,测定了13种沙葱挥发物与GdauOBP20重组蛋白的结合能力。结果显示(表2),除与二烯丙基三硫醚没有结合能力外,GdauOBP20重组蛋白与其他12种寄主植物挥发物均有不同程度的结合能力,其中与对二甲苯的结合能力最强,解离常数K值为22.91 µmol·L-1,其次为环庚三烯,K值为26.55 µmol·L-1。其他10种寄主植物挥发物的结合能力从大到小依次为二甲基三硫醚、二甲基二硫醚、苯甲酸甲酯、2-己烯醛、二烯丙基硫醚、顺-2-己烯-1-醇、己醛、1,3-二噻烷、二烯丙基二硫及月桂烯,K值范围为31.01—116.29 µmol·L-1。

表2 GdauOBP20重组蛋白与所测配基的亲和力

M:蛋白分子量标准 Protein molecular weight marker;1:未诱导对照组 Control group without induction;2—6:经不同浓度IPTG诱导的表达产物(0.1、0.5、0.8、1.0、1.5 mmol·L-1) Expressed products induced by different concentrations of IPTG;7:上清蛋白 Protein in bacterial supernatant;8:包涵体蛋白 Protein in bacterial inclusion;9:纯化的GdauOBP20重组蛋白separated and purified recombinant protein GdauOBP20

图4 GdauOBP20与1-NPN的结合分析(A、B)及与配基的荧光竞争结合(C、D)
3 讨论
在前期研究中从沙葱萤叶甲成虫转录组中鉴定出29条OBP基因,半定量RT-PCR和qRT-PCR检测结果表明,在触角中高度表达,而在头(去掉触角)、胸、腹、足和翅等组织中不表达,推测其在沙葱萤叶甲寻找寄主植物或配偶过程中起着重要作用[8]。本研究采用RACE技术克隆得到了的cDNA全长序列,并在原核表达系统中成功诱导表达出重组蛋白,为进一步研究其功能打下了基础。
笔者课题组采用顶空收集法和GC-MS技术从其最适寄主植物——沙葱中鉴定出32种挥发性化合物(未发表),本研究从中选取13种主要化合物进行了荧光竞争结合试验。结果表明,GdauOBP20与4种有机硫化物均能结合,其中二烯丙基二硫(别名大蒜素)是沙葱挥发物中含量最高的组分。这些硫化物具有强烈的刺激性气味,也是葱、蒜等百合科葱属植物的标志性成分[25-27]。这一结果与沙葱萤叶甲只取食沙葱、多根葱、野韭等百合科葱属植物相一致[6]。因此,GdauOBP20可能在沙葱萤叶甲寻找寄主植物过程中起着重要作用。对二甲苯、环庚三烯和苯甲酸甲酯在浓度为100 µmol·L-1时,能将相对荧光强度降至15%,说明GdauOBP20与这3种环状化合物均能较好地结合,推测该蛋白在结构上可能更易于与环状化合物相结合。GdauOBP20与月桂烯的结合能力较弱,解离常数为116.29 µmol·L-1,这一结果与二化螟()Minus-C CsupOBP1的结合特性一致[28],而B型烟粉虱()BtabOBP8与月桂烯的结合能力较强,解离常数为21.53 µmol·L-1[29],并且月桂烯对B型烟粉虱有吸引作用[30]。造成这一差异的原因可能是月桂烯为花香气味物质,广泛存在于绿色开花植物中[29],对B型烟粉虱等广食性昆虫具有引诱作用,而沙葱萤叶甲和二化螟等寡食性昆虫是以其寄主植物特异性挥发物作为寻找寄主的信号物质。总体上看,GdOBP20对多数供试的主要寄主挥发物的结合能力不强,可能与供试的寄主挥发物种类较少有关,也可能是其本身结合能力较弱。因此,在今后的研究中应增加寄主挥发物的种类,同时采用行为学试验、EAG及RNAi等技术进一步验证GdauOBP20在寄主植物定位中的作用。
4 结论
沙葱萤叶甲气味结合蛋白GdauOBP20具有PBP-GOBP家族的典型结构,属于Minus-C OBP亚家族。该蛋白与其寄主植物的多种主要挥发性气味物质具有不同程度的结合能力,推测其在沙葱萤叶甲对寄主植物的定位过程中可能发挥重要的作用。
[1] PILPEL Y, LANCET D. Olfaction: Good reception in fruitfly antennae.,1999, 398(6725): 285, 287.
[2] PELOSI P, IOVINELLA I, FELICIOLI A, DANI F R. Soluble proteins of chemical communication: an overview across arthropods.,2014, 5: 320.
[3] Vogt R G. Biochemical diversity of odor detection: OBPs, ODEs and SNMPs//Blomquist G J, Vogt R G.. London: Elsevier Academic Press, 2003: 391-445.
[4] Pelosi P, Zhou J J, Ban L P, Calvello M. Soluble proteins in insect chemical communication., 2006, 63(14): 1658-1676.
[5] Leal W S. Odorant reception in insects: roles of receptors, binding proteins, and degrading enzymes., 2013, 58: 373-391.
[6] 昊翔, 周晓榕, 庞保平, 张卓然, 马崇勇. 寄主植物对沙葱萤叶甲幼虫生长发育及取食的影响. 草地学报, 2014, 22(4): 854-858.
HAO X, ZHOU X R, PANG B P, ZHANG Z R, MA C Y. Effects of host plants on feeding amount, growth and development ofJoannis larvae (Coleoptera: Chrysomelidae)., 2014, 22(4): 854-858. (in Chinese)
[7] 昊翔, 周晓榕, 庞保平, 张卓然, 包祥. 沙葱萤叶甲的形态特征和生物学特性研究. 草地学报, 2015, 23(5): 1106-1108.
HAO X, ZHOU X R, PANG B P, ZHANG Z R, BAO X. Morphological and biological characteristics ofJoannis., 2015, 23(5): 1106-1108. (in Chinese)
[8] LI L, ZHOU Y T, TAN Y, ZHOU X R, PANG B P. Identification of odorant-binding protein genes in(Coleoptera: Chrysomelidae) and analysis of their expression profiles., 2017, 107(4): 550-561.
[9] HE P, LI Z Q, ZHANG Y F, CHEN L, WANG J, XU L, ZHANG Y N, HE M. Identification of odorant-binding and chemosensory protein genes and the ligand affinity of two of the encoded proteins suggest a complex olfactory perception system in., 2017, 26(6): 687-701.
[10] 李红亮, 张林雅, 庄树林, 倪翠侠, 韩宝瑜, 商晗武. 中华蜜蜂普通气味结合蛋白ASP2的气味结合功能模式分析. 中国农业科学, 2013, 46(1): 154-161.
LI H L, ZHANG L Y, ZHUANG S L, NI C X, HAN B Y, SHANG H W. Interpretation of odorant binding function and mode of general odorant binding protein ASP2 in Chinese honeybee ()., 2013, 46(1): 154-161. (in Chinese)
[11] LI N, SUN X, WANG M Q. Expression pattern and ligand-binding properties of odorant-binding protein 13 fromHope., 2017, 141(9): 751-757.
[12] LI Y, ZHOU P, ZHANG J, YANG D, LI Z, ZHANG X, ZHU S, YU Y, CHEN N.Identification of odorant binding proteins inand their binding affinity to the male-borne semiochemicals and host plant volatiles., 2017, 100: 100-107.
[13] 李兆群, 张帅, 周淑芬, 雒珺瑜, 崔金杰. 棉铃虫气味结合蛋白HarmOBP16的组织表达谱及配基结合特性分析. 昆虫学报, 2017, 60(8): 891-899.
LI Z Q, ZHANG S, ZHOU S F, LUO J Y, CUI J J. Tissue expression profiling and ligand-binding properties of HarmOBP16 of the cotton bollworm,(Lepidoptera: Noctuidae)., 2017, 60(8): 891-899. (in Chinese)
[14] 陈东凯, 张林雅, 邢振龙, 雷仲仁. 美洲斑潜蝇气味结合蛋白 OBP13 的鉴定与功能. 中国农业科学, 2018, 51(5): 893-904.
CHEN D K, ZHANG L Y, XING Z L, LEI Z R. Identification and function of the OBP13 protein from the leafminer ()., 2018, 51(5): 893-904. (in Chinese)
[15] 陈秀琳, 苏丽, 陈丽慧, 李怡萍, 仵均祥, 李广伟. 梨小食心虫Minus-C气味结合蛋白的分子克隆、表达谱及结合特性分析. 昆虫学报, 2018, 61(7): 771-783.
CHEN X L, SU L, CHEN L X, LI Y P, WU J X, LI G W. Molecular cloning, expression profiling and binding characterization of a Minus-C odorant binding protein from the oriental fruit moth,(Lepidoptera: Tortricidae)., 2018, 61(7): 771-783. (in Chinese)
[16] 孙佳斌, 刘乃勇, 李双美, 闫祺, 董双林. 斜纹夜蛾信息素结合蛋白SlitPBP4的分子克隆、组织表达谱及结合特性分析. 昆虫学报, 2018, 61(6): 657-667.
SUN J B, LIU N Y, LI S M, YAN Q, DONG S L. Molecular cloning, tissue expression profiling and binding characterization of the pheromone binding protein SlitPBP4 from(Lepidoptera: Noctuidae)., 2018, 61(6): 657-667. (in Chinese)
[17] PELLETIER J, GUIDOLIN A, SYED Z, CORNEL A J, LEAL W S.Knockdown of a mosquito odorant-binding protein involved in the sensitive detection of oviposition attractants., 2010, 36(3): 245-248.
[18] DONG K, SUN L, LIU J T, GU S H, ZHOU J J, YANG R N, DHILOO K H, GAO X W, GUO Y Y, ZHANGY J. RNAi-induced electrophysiological and behavioral changes reveal two pheromone binding proteins ofinvolved in the perception of the main sex pheromone component Z11-16:Ald., 2017, 43(2): 207-214.
[19] ZHANG X Y, ZHU X Q, GU S H, ZHOU Y L, WANG S Y, ZHANG Y J, GUO Y Y.Silencing of odorant binding protein geneby RNAi induces declining electrophysiological responses ofto six semiochemicals.,2017, 24(5): 789-797.
[20] Rebijith K B, Asokan R, Hande H R, Kumar N K K, Krishna V, Vinutha J, BAKTHAVATSALAM N. RNA interference of odorant-binding protein 2 (OBP2) of the cotton aphid,(Glover), resulted in altered electrophysiological responses., 2016, 178(2): 251-266.
[21] Sun X, Zeng F F, Yan M J, Zhang A, Lu Z X, Wang M Q. Interactions of two odorant-binding proteins influence insect chemoreception., 2016, 25(6): 712-723.
[22] ZHU G H, XU J, CUI Z, DONG X T, YE Z F, NIU D J, HUANG Y P, DONG S L. Functional characterization ofby CRISPR/Cas9 mediated genome editing.,2016, 75: 1-9.
[23] Ban L, Scaloni A, Brandazza A, Angeli S, Zhang L, Yan Y, Pelosi P. Chemosensory proteins of., 2003, 12(2): 125-134.
[24] Benkert P, Biasini M, Schwede T. Toward the estimation of the absolute quality of individual protein structure models., 2011, 27(3): 343-350.
[25] 何洪巨, 王希丽, 张建丽. GC-MS法测定大葱、细香葱、小葱中的挥发性物质. 分析测试学报, 2004, 23(增刊): 98-100, 103.
HE H J, WANG X L, ZHANG J L. Analysis of volatile components of shallots by GC-MS.s, 2004, 23(Suppl.): 98-100, 103. (in Chinese)
[26] CHENG L, LUO J, LI P, YU H, HUANG J F, LUO L X. Microbial diversity and flavor formation in onion fermentation., 2014, 5(9): 2338-2347.
[27] LIM F, LI T, LI W, YANG L D. Changes in antioxidant capacity, levels of soluble sugar, total polyphenol, organosulfur compound and constituents in garlic clove during storage., 2015, 69: 137-142.
[28] 魏丹, 叶占峰, 高建清, 董双林. 二化螟Minus-C气味结合蛋白的分子克隆及功能鉴定. 昆虫学报, 2013, 56(7): 754-764.
WEI D, YE Z F, GAO J Q, DONG S L. Molecular cloning and functional identification of a Minus-C odorant binding protein from the rice striped stem borer,(Lepidoptera: Pyralidae)., 2013, 56(7): 754-764. (in Chinese)
[29] 王然, 张晓曼, 李峰齐, 吴帆, 李红亮, 罗晨. 烟粉虱MED隐种气味结合蛋白OBP的克隆、原核表达及植物挥发物的结合特性. 植物保护学报, 2016, 43(1): 32-39.
WANG R, ZHANG X M, LI F Q, WU F, LI H L, LUO C. Cloning and prokaryotic expression of odorant binding protein OBP8 in MED cryptic speciesand the binding characteristics with plant volatiles., 2016, 43(1): 32-39. (in Chinese)
[30] 曹凤勤, 刘万学, 范中南, 万方浩, 程立生. B型烟粉虱对三种寄主植物及其挥发物的行为反应. 昆虫学报, 2008, 51(8): 830-838.
CAO F Q, LIU W X, FAN Z N, WAN F H, CHENG L S. Behavioural responses ofB-biotype to three host plants and their volatiles., 2008, 51(8): 830-838. (in Chinese)
Molecular Cloning, Prokaryotic Expression and Binding Characterization of Odorant Binding Protein GdauOBP20 in
LI Ling, TAN Yao, ZHOU XiaoRong, PANG BaoPing
(Research Center for Grassland Entomology, Inner Mongolia Agricultural University, Hohhot 010020)
【】is a new pest with outbreak status in the Inner Mongolia grasslands in recent years. The objective of this study is to clone the full-length cDNA sequence of, and clarify the binding property of the recombinant protein to main host plant volatiles, which will lay a necessary foundation for revealing the molecular mechanism of olfaction in【】RACE technique was used to clone the full-length cDNA ofbased on the transcriptome database of. the physicochemical properties and structural characteristics of the encoded protein were predicted and analyzed by bioinformatics software. The recombinant protein GdauOBP20 was induced to express by constructing prokaryotic expression system, and purified by using the Ni-NTA Agarose affinity column. Finally, the fluorescence competitive assay was applied, and N-phenyl-1-naphthylamine (1-NPN) was selected as the fluorescence probe to measure the binding profiles of GdauOBP20 recombinant protein with 13 main host plant volatiles.【】The full-length cDNA ofis 567 bp (GenBank accession number: MK250532), with the non-coding regions of 5′ and 3′ ends of 24 bp and 123 bp, respectively, and a ployA tail structure. The open reading frame (ORF) is 420 bp, encoding 139 amino acids. The amino acid sequence of GdauOBP20 contains 4 conserved cysteine residues, indicating that it belongs to Minus-C OBP subfamily. The three-dimensional structure prediction of GdauOBP20 contains six alpha helix and two pairs of disulfide bonds formed by cysteine. The recombinant expression vector was successfully constructed, and the recombinant protein with high purity was obtained. The binding capacity of the recombinant protein GdauOBP20 to the fluorescence probe 1-NPN was strong with a binding constant of 12.8 µmol·L-1, indicating that it could be used as the fluorescence reporter in this experiment. Affinities of recombinant protein GdauOBP20 with 13 main host plant volatiles were tested. Among them, except diallyl trisulfide, other 12 volatiles showed certain binding capacities with the recombinant protein, and p-xylene and 1,3,5-cycloheptatriene displayed the strongest affinity with the dissociation constants of 22.91 and 26.55 µmol·L-1, respectively, whereas myrcene exhibited the weakest binding affinity with the dissociation constant of 116.29 µmol·L-1.【】GdauOBP20 has a certain binding capacity with main host plant volatiles, suggesting that it may play an important role in the localization of host plants.
; odorant binding protein; RACE cloning; prokaryotic expression; fluorescence competitive binding assay
10.3864/j.issn.0578-1752.2019.20.020

2019-03-11;
2019-04-18
国家自然科学基金(31360441)
李玲,E-mail:279165876@qq.com。
庞保平,E-mail:pangbp@imau.edu.cn
(责任编辑 岳梅)
