猪传染性胃肠炎病毒膜蛋白亲和肽的原核表达及其病毒亲和性分析
2019-11-05于天飞董慧莹谢鹏宇孙婉姝尹海畅于志丹
于天飞,董慧莹,谢鹏宇,孙婉姝,尹海畅,黎 明,于志丹
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.黑龙江省抗性基因工程与寒地生物多样性保护重点实验室,黑龙江 齐齐哈尔 161006;3. 齐齐哈尔大学 计算机与控制工程学院,黑龙江 齐齐哈尔 161006)
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是由猪传染性胃肠炎病毒(Transmissiblegastroenteritisvirusof swine,TGEV)引起的接触性、传染性肠道疾病[1]。感染后,2 周龄以内仔猪死亡率高达100%,5 周龄以上的猪死亡率较低,成年猪一般无死亡现象[2]。TGEV为巢状病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)成员,它是仔猪急性病毒性腹泻的重要病原之一,可导致养猪业遭受破坏性的经济损失[3]。1933年,TGEV首次报告于美国。中国在1970年第1次检测到TGEV[4]。
TGEV基因组为不分节段的单股正链RNA,长度约28.5 kb,可分别编码纤突(Spike)蛋白、包膜(E)蛋白、膜(M)蛋白和核衣壳(N)蛋白等4 种结构蛋白以及5种非结构蛋白[5]。TGEV M蛋白高度糖基化,有助于病毒核衣壳与囊膜结合[6]。M蛋白羧基末端暴露于病毒颗粒外表面,具有良好的免疫原性和反应原性[7]。
病毒亲和肽可与病毒特异性结合,在诊断和治疗领域具有良好的应用前景[8]。Zou等[9]曾通过噬菌体展示技术对TGEV病毒亲和肽进行了筛选。其对含有TGEV M蛋白的重组蛋白为靶分子进行了5 轮生物淘选,成功筛选出10 种能与靶分子蛋白结合的十二肽,并通过噬菌体ELISA验证了亲和肽与病毒粒子的亲和性。本研究选取这10 种十二肽中亲和性最强的3 种,通过串联表达方法进行体外表达,并利用Western Blot、Dot-ELISA等方法检测重组蛋白的病毒亲和性。本研究为建立TGEV感染诊断方法和检测技术奠定了一定的物质基础和理论依据。
1 材料和方法
1.1 试验材料
1.1.1 菌种、质粒和抗体 原核表达载体pET-32a、pGEX-6p-1、大肠杆菌DH5α和Rosetta(DE3)由齐齐哈尔大学生命科学与农林学院动物免疫学实验室保存。TGEV阳性血清购自中国兽医药品监察所;辣根过氧化物酶(HRP)标记His标签单克隆抗体和HRP标记GST标签单克隆抗体购自Thermo Fisher公司。HRP标记羊抗猪抗体购自北京中杉金桥生物技术有限公司。TGEV H株(1×105TCID50/mL)由本实验室保存。
1.1.2 主要试剂 异丙基硫代半乳糖苷(IPTG)、DNA分子质量标准、T4DNA连接酶、BamHⅠ和XhoⅠ限制性内切酶购自TaKaRa公司。高保真KOFTaq酶、dNTP mix和4氯-1-奈酚(4-CN)购自哈尔滨超峰生物科技发展有限公司。质粒提取试剂、胶回收试剂盒,购自上海近岸科技有限公司。蛋白分子质量标准购自Thermo Fisher公司。其余常规试剂为国产分析纯。
1.2 试验方法
1.2.1 TGEV M蛋白亲和肽基因的设计与合成 根据Zuo等[9]的研究结果,从10 种可与TGEV M蛋白结合的十二肽中选取亲和力最强的3种,每种亲和肽之间用linker(AAAK)连接。根据设计好的重组蛋白序列,对其推导的核苷酸序列依据大肠杆菌偏爱密码子进行优化,并交由哈尔滨博仕生物技术有限公司进行合成,合成基因插入到pUC57质粒中,该质粒命名为pUC57-MQHT。pUC57-MQHT用无菌去离子水进行1∶10 000稀释,作为PCR模板。
1.2.2 M蛋白亲和肽基因的亚克隆 根据合成的基因序列,利用Primer Premier 5.0软件设计合成1对引物。PU:5′-CGCGGATCCGAATGCATCAAGAT CAAT-3′;PL:5′-GGGCCGCTCGAGTTAATCCGATAT TGG-3′。
上游引物PU插入BamHⅠ酶切位点,下游引物PL插入XhoⅠ的酶切位点(下划线表示)。该引物由哈尔滨博仕生物技术有限公司合成。合成后的引物稀释成50 pmol/μL,-20 ℃保存备用。
将2×Taq酶预混液(包含Buffer,dNTP)12.5 μL,PU 0.5 μL(25 pmoL/μL),PL 0.5 μL(25 pmol/μL),模板0.5 μL,ddH2O 10.5 μL,KOFTaq酶0.5 μL,共25 μL。PCR程序设计为,94 ℃ 1 min 30 s;94 ℃ 30 s,40 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 7 min,4 ℃保存。PCR产物经1.2%琼脂糖凝胶电泳检测。
1.2.3 重组表达载体的构建 PCR产物、表达载体pET-32a和pGEX-6p-1分别用BamHⅠ与XhoⅠ双酶切。酶切产物经胶回收。将回收后的PCR产物与pET-32a或pGEX-6p-1连接,转化大肠杆菌DH5α感受态细胞,涂布含氨苄青霉素(Amp)100 μg/mL 的LB平板,37 ℃过夜培养。挑取单菌落接种至含有Amp 100 μg/mL的液体LB中,37 ℃过夜培养,提取质粒。单、双酶切鉴定质粒。将相应克隆菌寄送哈尔滨博仕生物科技有限公司进行序列测定。测序鉴定正确的重组质粒分别命名为pET-32a-MQHT和pGEX-6p-MQHT。
1.2.4 重组蛋白的诱导表达 将重组质粒pET-32a-MQHT和pGEX-6p-MQHT分别转化大肠杆菌Rosetta(DE3),涂布LB平板(Amp,100 μg/mL)。过夜培养,挑取单菌落,获得重组菌株。重组菌首先接种LB液体培养基(Amp,100 μg/mL),37 ℃振荡培养过夜。再以1%比例转接新鲜的LB液体培养基,37 ℃振荡培养2~3 h后,测菌液OD600达0.5~0.6时,加入至终浓度1.0 mmol/L IPTG 37 ℃诱导1~4 h后收获细菌,进行SDS-PAGE电泳分析。重组蛋白分别命名为TRX-MQHT和GST-MQHT。
1.2.5 重组蛋白的纯化及鉴定 重组蛋白经SDS-PAGE电泳后,用0.3 mol/L 4 ℃预冷的KCl溶液预染5 min,切下含目的蛋白的凝胶,碾碎,加入PBS悬起,反复冻融3 次,10 000 r/min离心5 min,取上清液。采用Bradford检测法分别对重组蛋白TRX-MQHT和GST-MQHT的含量进行测定[10]。纯化的重组蛋白经SDS-PAGE后,转印至硝酸纤维素(NC)膜,5%脱脂乳4 ℃封闭过夜,PBST洗3 遍,浸入1∶100稀释的HRP标记的His标签单克隆抗体或HRP标记的GST标签单克隆抗体中,37 ℃作用2 h,PBST洗涤3 次后用4-CN显色。
1.2.6 Western Blot鉴定重组蛋白的病毒亲和性 纯化的重组蛋白TRX-MQHT或GST-MQHT经SDS-PAGE后,转印至NC膜上,5%脱脂乳4 ℃封闭过夜,PBST洗3 遍,3 min/次,浸入TGEV H株(1×105TCID50)稀释液中,37 ℃作用2 h,PBST洗3 遍,3 min/次,浸入PBS稀释的质量浓度为1 mg/mL的重组蛋白GST-MQHT或TRX-MQHT中,室温作用2 h,PBST洗涤3 遍,3 min/次,浸入1∶1 000稀释的HRP标记GST标签单克隆抗体或His标签单克隆抗体中,室温作用1 h,PBST洗涤3 遍,3 min/次,用4-CN显色。
1.2.7 Dot-ELISA鉴定重组蛋白病毒亲和性 按照以下步骤进行Dot-ELISA操作。在NC膜表面划4 mm×4 mm小方格,先将NC膜在去离子水中浸泡10 min,取出置于室温晾干。用微量移液器吸取1 μL 1 mg/mL的重组蛋白TRX-MQHT或GST-MQHT,点于小方格的正中央,置于室温晾干。将包被的膜片放入5%脱脂乳中,37 ℃封闭作用60 min后取出,PBST洗涤3 次,2 min/次,室温晾干。将膜片裁剪成小片,点样面朝上置于96 孔酶标板孔内,加入100 μL PBS 倍比稀释的TGEV H株中(1∶100,1∶200,1∶400,1∶800),37 ℃ 60 min;每孔加入150 μL PBST泡洗3 次,2 min/次,再用PBS洗涤1 遍,2 min;加入100 μL 1 mg/mL的重组蛋白GST-MQHT或TRX-MQHT中,37 ℃ 60 min;弃去重组蛋白,每孔加入150 μL PBST泡洗3 次,2 min/次,再用无磷酸盐缓冲液洗涤1 遍,2 min;每孔加入100 μL 1∶1 000稀释的GST标签单克隆抗体或His标签单克隆抗体,37 ℃作用30 min;弃去酶标抗体,每孔加入150 μL PBST泡洗2 次,2 min/次,再用PBS洗涤1 遍,2 min;每孔加入100 μL显色液,37 ℃ 避光显色,5 min后观察;弃去显色液,每孔加入150 μL去离子水泡洗3 次,1 min/次,甩干后取出膜片干燥,拍照。
1.2.8 阻断试验 将TGEV H株分别与1∶100,1∶200,1∶400,1∶800稀释的TGEV阳性血清孵育,4 ℃作用过夜,10 000 r/min离心30 min,取上清。Dot-ELISA法检测阻断效果。膜片预处理按前述方法进行。按1.2.7中所述的Dot-ELISA方法进行检测,观察其反应情况。
2 结果与分析
2.1 重组质粒pET-32a-MQHT和pGEX-6p-MQHT的酶切鉴定
构建的重组质粒pET-32a-MQHT、pGEX-6p-MQHT分别采用BamHⅠ单酶切和BamHⅠ/XhoⅠ双酶切,经琼脂糖凝胶电泳检测,结果表明,pET-32a-MQHT经BamHⅠ单酶切获得了6 050 bp的DNA条带,BamHⅠ/XhoⅠ双酶切获得了5 900 bp的载体片段和大小为150 bp的目的条带;pEGX-6p-MQHT经BamHⅠ单酶切获得了5 140 bp的DNA条带,BamH Ⅰ/XhoⅠ双酶切获得了4 990 bp的载体片段和大小为150 bp的目的条带(图1)。上述酶切结果与预期一致。测序结果证明插入位置与阅读框均正确。
2.2 重组蛋白的表达
将构建的重组质粒pET-32a-MQHT和pGEX-6p-MQHT分别转化大肠杆菌Rosetta(DE3),经1.0 mmol/L IPTG诱导后1,2,3,4 h取样,SDS-PAGE检测全菌体细胞沉淀,结果表明,获得的重组蛋白TRX-MQHT和GST-MQHT大小分别为25,31 ku,与预期相符(图2,箭头所示)。
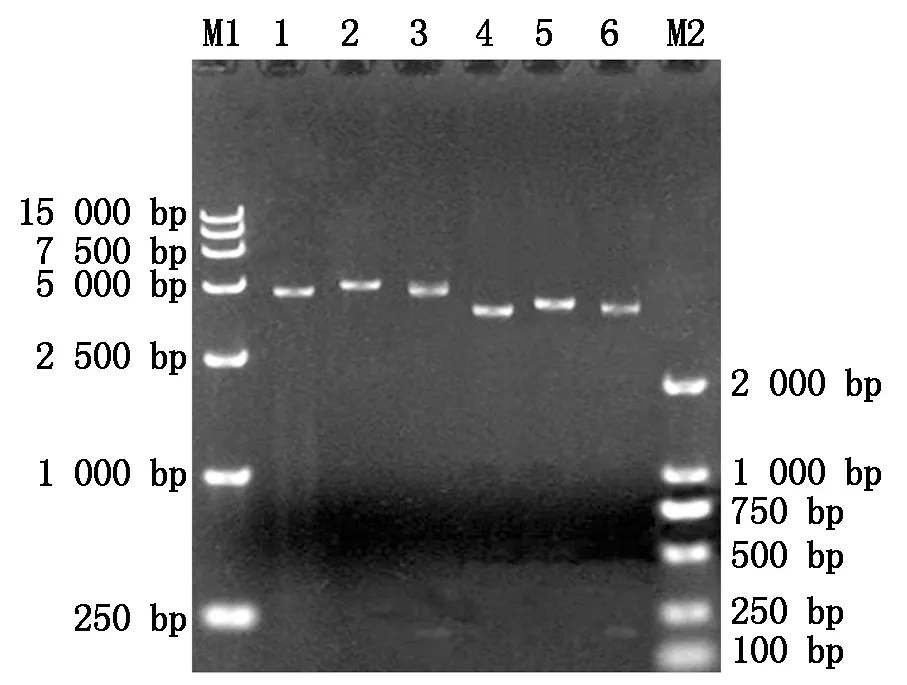
M1.DNA分子质量标准DL15000;1.pET-32a空载体BamHⅠ单酶切;2.pET-32a-MQHTBamHⅠ单酶切;3.pET-32a-MQHTBamHⅠ/XhoⅠ双酶切;4.pGEX-6p-1空载体BamHⅠ单酶切;5.pGEX-6p-MQHTBamHⅠ单酶切;6.pGEX-6p-MQHTBamHⅠ/XhoⅠ双酶切;M2. DNA分子量标准DL2000。
M1.DNA Marker DL15000;1.pET-32a digested byBamHⅠ;2.pET-32a-MQHT digested byBamHⅠ;3.pET-32a-MQHT digested byBamHⅠ/XhoⅠ; 4.pGEX-6p-1 digested byBamHⅠ;5.pGEX-6p-MQHT digested byBamHⅠ;6.pGEX-6p-MQHT digested byBamHⅠ/XhoⅠ;M2. DNA Marker DL2000.
图1 重组表达载体pET-32a-MQHT和pGEX-6p-MQHT的酶切鉴定
Fig.1 Identification of recombinant expressionvectors by restriction enzyme digestion

A.SDS-PAGE检测重组蛋白TRX-MQHT的表达: M.蛋白质分子质量标准;1.诱导前的pET-32a空载体;2.诱导后4 h的pET-32a空载体;3.未诱导的pET-32a-MQHT/E.coliRosetta(DE3)重组菌;4-7.诱导1~4 h的pET-32a-MQHT/E.coliRosetta(DE3)重组菌。B.SDS-PAGE检测重组蛋白GST-MQHT的表达:M.蛋白质分子质量标准;1.诱导前的pGEX-6p-1空载体;2.诱导后4 h的pGEX-6p-1空载体;3.未诱导的pGEX-6p-MQHT/E.coliRosetta(DE3)重组菌;4-7.诱导1~4 h的pGEX-6p-MQHT/E.coliRosetta(DE3)重组菌。
A.Detection of recombinant protein TRX-MQHT by SDS-PAGE:M.Protein Marker; 1.pET-32a/E.coliRosetta(DE3) before induction; 2.pET-32a/E.coliRosetta(DE3) induced for 4 h;3.pET-32a-MQHT/E.coliRosetta(DE3) before induction; 4-7.pET-32a-MQHT/E.coliRosetta(DE3) induced for 1-4 h. B.Detection of recombinant protein GST-MQHT by SDS-PAGE:M.Protein Marker; 1.pGEX-6p-1/E.coliRosetta(DE3) before induction; 2.pGEX-6p-1/E.coliRosetta(DE3) induced for 4 h;3.pGEX-6p-MQHT/E.coliRosetta(DE3) before induction; 4-7.pGEX-6p-MQHT/E.coliRosetta(DE3) induced for 1-4 h.
图2 重组蛋白的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of recombinant protein
2.3 重组蛋白的纯化及鉴定
重组蛋白TRX-MQHT和GST-MQHT的切胶纯化结果如图3-A所示。经His标签单克隆抗体和GST标签单克隆抗体鉴定的结果表明,所获得的表达蛋白为重组蛋白(图3-B)。
2.4 Western Blot鉴定重组蛋白的病毒亲和性
纯化的重组蛋白TRX-MQHT或GST-MQHT转印至NC膜上后,与TGEV病毒粒子孵育,再与重组蛋白GST-MQHT或TRX-MQHT孵育,最后用抗GST或His单抗进行检测,如图4所示,2种重组蛋白都显示出阳性印记,而对照TRX或GST标签蛋白无印记。
2.5 Dot-ELISA鉴定重组蛋白病毒亲和性
纯化的重组蛋白TRX-MQHT或GST-MQHT包被至NC膜上后,与TGEV病毒粒子孵育,再与重组蛋白GST-MQHT或TRX-MQHT孵育,最后用抗GST或His单抗进行检测,如图5所示,2 种重组蛋白在1×103,5×102,2.5×102TCID50/mL 3 个滴度时都显示出阳性印记,而在1.25×102TCID50/mL滴度时无可见斑点,2 种重组蛋白检测TGEV的最低滴度无明显差异,检测TGEV的敏感性为2.5×102TCID50/mL。TGEV亲和性良好。
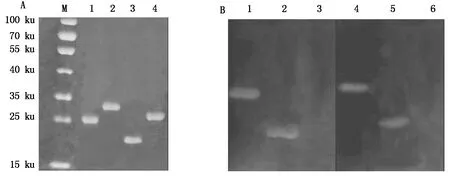
A.重组蛋白TRX-MQHT和GST-MQHT纯化结果:M.蛋白质分子质量标准;1.TRX-MQHT;2.GST-MQHT;3.TRX蛋白;4.GST蛋白。B.重组蛋白TRX-MQHT和GST-SQHT Western Blot鉴定结果:1.TRX-MQHT;2.TRX蛋白;3.GST蛋白;4.GST-MQHT;5.GST蛋白;6.TRX蛋白。
A.Purification results of recombinant protein TRX-MQHT and GST-MQHT: M.Protein Marker; 1.TRX-MQHT;2.GST-MQHT;3.TRX protein;4.GST protein.B.Identification of recombinant protein TRX-MQHT and GST-SQHT by Western Blot:1.TRX-MQHT;2.TRX protein;3.GST protein;4.GST-MQHT; 5.GST protein; 6.TRX protein.
图3 重组蛋白的纯化及鉴定
Fig.3 Purification and identification of recombinant protein

1.TRX-MQHT;2.TRX标签蛋白;3.GST-MQHT;4.GST标签蛋白。1.TRX-MQHT; 2.TRX;3.GST-MQHT; 4.GST.

A.TRX-MQHT;B.GST-MQHT:1.1×103 TCID50/mL;2.5×102 TCID50/mL;3.2.5×102 TCID50/mL;4.1.25×102 TCID50/mL。
2.6 阻断试验
以重组蛋白TRX-MQHT或GST-MQHT为包被物,以不同浓度稀释(1∶100,1∶200,1∶400,1∶800)的TGEV阳性血清预先处理的TGEV H株为捕获对象,最后以重组蛋白GST-MQHT或TRX-MQHT为二次亲和物,进行Dot-ELISA检测。检测结果表明(图6),1∶100或1∶200稀释的TGEV阳性血清可完全阻断TGEV H株(1×105TCID50/mL)与2 种亲和肽的结合。2 种亲和肽检测特异性良好。

A. 包被TRX-MQHT;B. 包被GST-MQHT。1-4. TGEV H株分别与1∶800,1∶400,1∶200,1∶100稀释的TGEV阳性血清作用。A. TRX-MQHT; B. GST-MQHT.1-4. TGEV H strain co-cultivated with 1∶800, 1∶400, 1∶200, 1∶100 diluted anti-TGEV serum, respectively.
3 结论与讨论
准确的诊断对于TGE的防控至关重要。TGE的初步诊断可根据当地的流行病学以及疑似病猪的临床症状来进行[11]。但由于TGE与猪的其他腹泻性疾病症状相似,因此,TGE的确诊必须进行实验室诊断[12]。目前,已经建立了多种TGEV检测方法,如病毒分离、免疫荧光检测[13]、电镜检测,RT-PCR、纳米颗粒辅助RT-PCR[14]、实时荧光定量RT-PCR[15]、双抗体夹心ELISA[16]、免疫过氧化物酶单层细胞试验(IPMA)[17]和DNA芯片[18]等。用于TGEV检测的RT-LAMP测定法反应时间在60 min以内,较为省时,可通过琼脂糖凝胶电泳直接观察试验结果[19-20]。M蛋白是TGEV囊膜中丰度较高的结构蛋白,保守性高,其也成为建立各种TGEV检测方法的候选蛋白。张小波[21]以原核表达的重组M蛋白作为包被抗原,建立了检测TGEV抗体的间接ELISA方法,并确定了间接ELISA的最佳工作条件。针对M蛋白制备的单克隆抗体和多克隆抗体亦具有良好的应用前景[22-23]。Rodák等[24]制备了针对TGEV N蛋白和M蛋白的单克隆抗体,并建立了竞争-阻断ELISA检测方法,敏感性为1×103TCID50/mL。
病毒亲和肽在病毒性疾病检测方面也具有良好的应用价值[8]。Zou等[9]以筛选出TGEV M蛋白亲和肽中结合力最高的3 个噬菌体建立了噬菌体ELISA,可以检测到最低的病毒量为0.02 μg。Suo等[25]采用相似的方法筛选TGEV Spike蛋白亲和肽,并以结合力最高的4 个噬菌体建立了噬菌体ELISA,结果显示可以检测到最低的病毒量为0.1 μg,略优于常规ELISA(最低病毒检测量为0.6 μg)。本研究表达的重组M蛋白亲和肽与重组的S蛋白亲和肽的TGEV亲和性是否也有相似的差异,需要进一步的试验来确定。本研究初步建立的Dot-ELISA检测TGEV的敏感性为2.5×102TCID50/mL,继续优化该Dot-ELISA反应条件后,其敏感性可能会有一定程度的提高。原核表达重组蛋白步骤简单,操作性强,试剂均为实验室常用药品不需要很高的费用[26],以重组表达的M蛋白亲和肽建立的检测方法有望应用到TGEV的临床诊断中。
