营养液浓度对封闭式槽培黄瓜品质、产量及光合特性的影响
2019-11-05孟宪敏季延海武占会储昭胜刘明池
孟宪敏,季延海,武占会,储昭胜,刘明池
(1.北京市农林科学院 蔬菜研究中心,北京 100097;2.河北工程大学 园林与生态工程学院,河北 邯郸 056038;3.农业部都市农业(华北)重点实验室,北京 100097)
无土栽培中,对植物生长发育起关键作用的是营养液配方与浓度,同一作物的不同生长阶段对营养液浓度要求大不相同,营养液浓度过高或过低均会影响作物产量、品质及光合能力。目前,我国无土栽培多为开放式栽培系统,灌溉多余的营养液会排放到周边,对生态环境造成污染。近年来欧盟开始采用营养液封闭循环式无土栽培系统,一方面可减少营养液外排,另一方面通过对营养液的回收、过滤、消毒等措施,提高营养液利用率[1-3]。针对上述情况,北京市农林科学院蔬菜研究中心设计研发出一种低成本、节水节肥的封闭式槽培系统,栽培槽为上大下小的立体梯形结构,此高脚栽培槽底部设有向下突出的圆柱形排水口,多余营养液通过排水口回流至回水管,进入营养液桶中,并选择无机珍珠岩为基质,从而实现了营养液的循环利用,多余营养液不再排放到环境中。张芳等[4]基于叶片数增长动态进行营养液调控,可促进基质培番茄增加产量和提高品质,吴晓艳等[5]表明营养液浓度对鸭儿芹幼苗有双重作用,即低浓度下随营养液浓度降低,胁迫逐渐减轻,促进幼苗生长;高浓度下随浓度升高,胁迫逐渐增强,抑制幼苗生长。然而,倪纪恒等[6]认为,营养液低EC值浇灌黄瓜的光合与产量显著低于高EC值,也可能限制植物生长[7];前人已研究营养液不同浓度对菠菜[8]、盆栽黄瓜[9]、甜瓜[10]等产量、品质、元素吸收或光合特性的影响。国内这些营养液研究多是基于开放式无土栽培的营养液配方及苗期营养液调控,对营养液可循环利用的封闭式无土栽培研究还鲜见报道;针对不同营养液浓度的光合特性方面研究较少,尤其是光能分配及叶片显微结构的差异还未见报道。本试验以黄瓜为试材,采用封闭式槽培栽培系统,从黄瓜开花后开始营养液不同EC值处理,研究营养液浓度对黄瓜生长、品质、叶片光合特性、显微结构与光能分配的影响,以筛选封闭式无土栽培条件下可提高黄瓜品质的营养液适宜浓度,并探讨提高果实品质的机理。
1 材料和方法
试验于2017-2018年在北京市农林科学院蔬菜研究中心连栋玻璃温室进行。
1.1 试验材料
供试黄瓜(CucumissativusL.)品种为中国农业科学院蔬菜花卉研究所选育的中农26,采用72孔穴盘育苗,基质为草炭∶蛭石=2∶1,常规苗期管理。采用蔬菜研究中心研发的封闭式槽培栽培方式和营养液循环供给系统,9月15日黄瓜幼苗定植于栽培槽(长×宽×高=48 cm×20 cm×13 cm)南北走向放置,每个栽培槽定植2株,基质采用珍珠岩,株距40 cm,小行距20 cm,大行距150 cm。试验期间进行单干整枝、绑蔓和摘除卷须及底部老叶片等周期性管理。采用根据日本山崎黄瓜配方[11]改良的黄瓜营养液地下水专利配方,配方内大量元素N、P、K、Ca、Mg、S含量分别为:11.6,1.3,6.51,2.24,1.00,1.39 mmol/L,微肥为通用配方。黄瓜营养液地下水配方初始EC值为2.7 mS/cm,地下水EC值1.3 mS/cm。
1.2 试验设计
试验处理前灌溉营养液EC值为2.7 mS/cm;10月9日黄瓜开花后开始处理,浇灌不同浓度营养液,以营养液初始EC值2.7 mS/cm作为对照进行调整,设EC值为2.3,2.7,3.1,3.5,3.9 mS/cm共5个处理,记作T1、T2、T3、T4、T5,贮液池体积200 L。试验期间每天采用便携式电导率仪测量贮液池营养液EC、pH值,若EC值低于设定值,及时补充营养液母液以保持设定EC值;整个生长期采用85%磷酸调整pH值为6.2±0.2;每2 d检查滴针流速。参考前人对本系统供液量的研究[12]以及滴针流速调整供液次数以及供液时间,处理前8:00-18:00供液6次,2 min/次,供液量2 L/d;处理后9:00-16:00供液5次,6 min/次,供液量5 L/d。各处理设3次重复,每重复52株,共定植780株。
1.3 测定项目及方法
1.3.1 生长指标 每重复挂牌调查6株,处理前与处理后每2周进行调查,卷尺测量株高,游标卡尺测量茎粗,直尺测量最大叶长(L)、叶宽(W),并通过回归方程计算最大叶面积[13]。最大叶面积=14.61-5.0(L)+0.94(L2)+0.47(W)+0.63(W2)-0.62(L×W)。
1.3.2 品质指标 直尺测量果实长度、果柄长,游标卡尺测量果肉厚(不包括瓤)、粗度(距果顶1/3处),计算果柄长/果实长度,果形指数=果实长度/粗度;3次重复,各重复取6根瓜。考马斯-G20染色法测定可溶性蛋白;2,6-二氯酚靛酚钠法测定VC;硫酸-蒽酮比色法测定可溶性糖[14];水合茚三酮法测定游离氨基酸[15];手持折射仪ACT-1EC(日本,ATAGO)测定可溶性固形物。摘除根瓜后,于盛瓜期取果实进行测定,各3次重复。
1.3.3 灌水量与产量 试验期间补充工作液的累计体积即灌水量,因冬季蒸发较少,蒸发量忽略不计。直至拉秧前按小区统计产量。
1.3.4 叶片显微结构 参考李和平[16]的方法,有改动。于盛瓜期取第4叶叶脉中部左右5 mm×5 mm方小块,立即置于FAA固定液,抽真空固定24 h,经脱水、透明、浸蜡、包埋、切片,番红-固绿染色,于蔡司显微镜下观察并拍照。每组10张切片,每张切片随机3个视野测量叶片、上下表皮、栅栏组织及海绵组织厚度并计算栅栏组织厚度/海绵组织厚度(即栅/海比)、栅栏组织厚度/叶片厚度、海绵组织厚度/叶片厚度。
1.3.5 叶片光合参数 于晴天9:00-11:00,采用LI-6400XT(美国,LI-COR)于盛瓜期测定第3~4片功能叶,包括光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)及蒸腾速率(Tr),采用6400-02B红蓝光源,PFD为800 μmol/(m2·s),流速500 μmol/s,CO2浓度(400±2) μmol/mol。更换6400-40荧光叶室,暗适应30 min,测定暗适应下初始荧光(Fo)、最大荧光(Fm)、暗适应下最大光化学效率(Fv/Fm),自然光下活化后,作用光PFD为800 μmol/(m2·s),测定光适应下稳态荧光(Fs)、最大荧光(Fm′)、初始荧光(Fo′)、光适应下实际光化学效率(ΦPSⅡ)、电子传递效率(ETR),计算公式参考Demmig-Adams[17]:光化学猝灭系数qP=(Fm′-Fs)/(Fm′-Fo′);非光化学猝灭系数(NPQ)=Fm/Fm′-1。参考蔡建国等[18]的方法计算光能分配,PSⅡ吸收光能用于3部分:用于光化学反应的能量消耗P=Fv′/Fm′×qP×100%;依赖于光的热耗散D=(1-Fv′/Fm′)×100%;非光化学耗散Ex=1-P-D。参考李亮等[19]PSⅠ与PSⅡ间激发能分配不平衡性(β/α-1)=(1-f)/f(f为PSⅡ反应中心开放程度,f=(Fm-Fs)/(Fm-Fo),α、β分别为PSⅠ和PSⅡ的激发能分配系数)。3次重复,取平均值。
1.3.6 光合色素 参考Arnon[20]方法测定,计算叶绿素a、b、a+b、a/b及类胡萝卜素含量。
1.4 数据分析
用Microsoft Excel 2010、CAD 2010以及SPSS 17.0统计软件进行数据处理与分析。
2 结果与分析
2.1 不同EC值对黄瓜生长的影响
表1为盛瓜期(即处理43 d)黄瓜生长指标,营养液不同EC值处理对黄瓜生长状况有显著影响。其中,株高以T3显著高于其他处理,比T2(对照)提高了6.17%。茎粗以T3最高,为10.49 mm。叶片数以T3最多,但处理间差异不显著。最大叶面积以T4显著高于其他处理,且与T3差异不显著,T3与T4分别比T2提高3.07%,4.57%。说明EC值为3.1 mS/cm(T3)的黄瓜综合生长状况较好。
2.2 不同EC值对黄瓜品质的影响
2.2.1 外部商品品质 不同浓度营养液处理对果实外部商品品质影响见表2。处理间果实长度、粗度及果肉厚有显著差异,但果柄长差异不显著。一般认为果形指数较高,则果实的外部商品性较好;本试验T3处理果形指数显著高于其他处理,与T4差异不显著,二者果形指数分别比T2处理提高了21.47%,16.27%;且T3的果柄长/果实长度较低,说明商品性较佳,而T5果实长度较低并伴随着果实粗度及果柄长最高,导致果形指数较低,果实商品性较差。说明EC值为3.1 mS/cm(T3)与3.5 mS/cm(T4)处理的果实外部商品性较优。

表1 不同浓度营养液对黄瓜生长指标的影响Tab.1 The effect of different concentration of nutrient solution on growth index of cucumber
注: 表中不同小写字母表示0.05水平差异显著(P<0.05)。表2-8同。
Note:Different lowercase letters indicated significant difference among treatments at 0.05 level. The same as Tab.2-8.
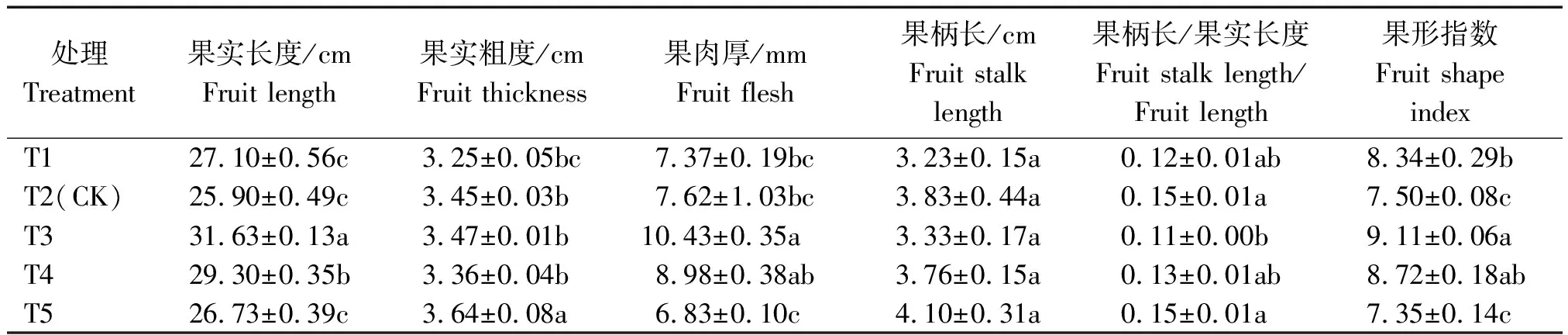
表2 不同浓度营养液对黄瓜外部商品品质的影响Tab.2 The effect of different concentration of nutrient solution on the quality of external commodity of cucumber
2.2.2 营养品质 随EC值增加,黄瓜果实可溶性糖含量升高,而VC、游离氨基酸与可溶性蛋白含量呈先升高后下降趋势,如表3。T3、T4与T5处理可溶性固形物、可溶性糖含量差异不显著,均高于其他处理;T3与T4处理可溶性糖含量分别比T2(对照)提高9.80%和16.55%,而可溶性固形物含量分别比T2显著提高12.50%和13.25%。而VC、游离氨基酸含量以T3最高,其次为T4,且二者差异不显著,T3、T4处理VC含量分别比T2提高39.35%,10.54%。可溶性蛋白含量以T4处理最高,与T3差异不显著且均高于其他处理。说明EC值3.5 mS/cm(T4)的果实内在营养品质优于其他处理,与3.1 mS/cm(T3)处理差异不显著。

表3 不同浓度营养液对黄瓜营养品质的影响Tab.3 The effect of different concentration of nutrient solution on the nutritional quality of cucumber
2.3 不同EC值对黄瓜产量的影响
本试验从11月1日开始采收黄瓜,因连栋温室冬季温度低,采收至12月15日,只采收了45 d。随营养液浓度增加,产量呈先升后降趋势,由表4可知,T3和T4产量分别高于T2(对照)31.61%和15.47%,T1与T5产量较低。由于试验采用封闭式循环方式灌溉营养液,多余营养液回收循环使用,因此各浓度处理灌水量无显著差异;但不同EC值处理使植株水分利用效率存在显著差异,以T3最高,比T2提高47.40%,其他处理间无显著差异。说明EC值为3.1 mS/cm(T3)处理植株产量最高,与3.5 mS/cm(T4)处理差异不显著。

表4 不同浓度营养液对黄瓜产量的影响Tab.4 The effect of different concentration of nutrient solution on yield of cucumber
2.4 不同EC值对黄瓜叶片光合参数的影响
2.4.1 光合色素 叶绿素含量是衡量叶片进行光合作用强弱的重要指标之一。不同EC处理下Chl a、Chl b与Chl a+b含量如表5,Chl a、Chl b、Car与Chl a+b含量在T4处理下达到最大,且黄瓜叶片中对营养液浓度较为敏感的是Chl b,T1处理叶片内Chl b含量较低,提高了Chl a/b,结合本试验初瓜期测定的光合色素数据表明,T3与T4处理的总叶绿素、叶绿素b含量均较高,Chl a/b比值降低,有利于提高叶片捕光能力,这是植株自身的调节作用。
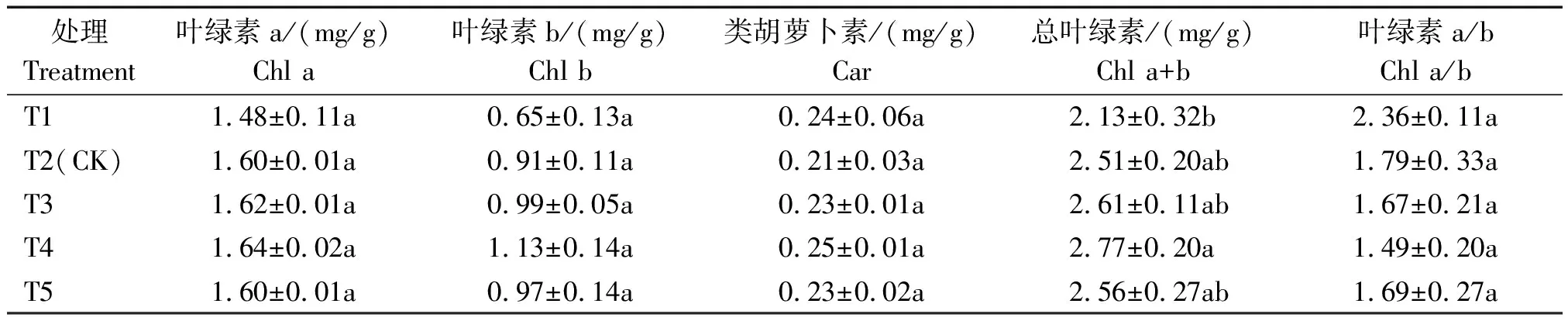
表5 不同浓度营养液对叶片光合色素的影响Tab.5 The effect of different concentration of nutrient solution on photosynthetic pigments of leaves
2.4.2 叶片光合参数 叶片光合能力与Pn、Gs和Ci也有直接关系,表6显示Pn、Gs、Ci与Tr随营养液浓度增加呈先上升后下降趋势。Pn、Gs、Tr均在T4处理下达到最大,其次为T3处理,其中,T4处理的Pn比T2提高58.85%;而T3与T4处理Tr差异不显著,T3与T4的Tr分别比T2提高46.32%,90.91%。另外,T3处理的Ci最高,其次为T4且两者无显著差异。说明EC值为3.5 mS/cm(T4)处理光合能力较强,与3.1 mS/cm(T3)处理不显著,均高于2.7 mS/cm(T2)处理(对照)。

表6 不同浓度营养液对叶片气体交换参数的影响Tab.6 The effect of different concentration of nutrient solution on the gas exchange parameters of leaves
2.4.3 叶绿素荧光参数 表7显示为叶片叶绿素荧光参数,随营养液浓度增加,初始荧光Fo呈先降低后增高趋势,Fo在T3和T4处理下显著低于其他处理,分别比T2降低2.94%,2.64%。相比其他处理,T1与T5处理的Fv/Fm降低,但Fo较高,说明浓度过高或过低均会导致植株PSⅡ系统受破坏。
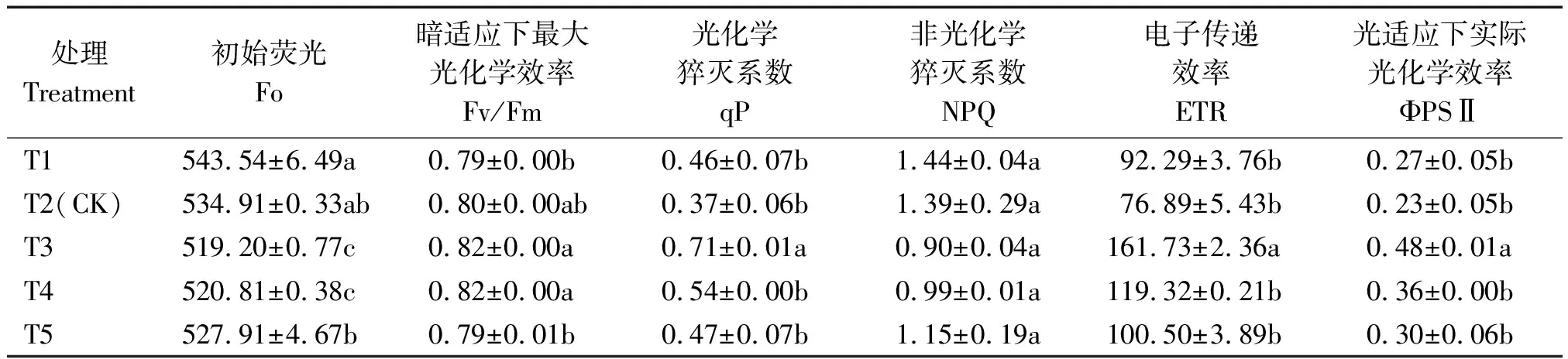
表7 不同浓度营养液对叶片叶绿素荧光参数的影响Tab.7 The effect of different concentration of nutrient solution on chlorophyll fluorescence parameters of leaves
随营养液浓度增加,Fv/Fm、ΦPSⅡ和ETR呈先升后降趋势,在T3处理下达到最大。ΦPSⅡ与ETR值处理间差异较大,以T3处理最高,ΦPSⅡ与ETR分别比T2处理提高108.70%,110.34%。另外,T3处理的qP最高,比T2增加91.90%;各处理NPQ值差异不显著,但以T3最低。说明EC值3.1 mS/cm(T3)提高了PSⅡ反应中心的实际原初光能捕获效率以及实际光化学效率,也提高了最大光化学效率,促进了叶片光合电子传递。
2.4.4 光能分配 营养液不同浓度处理对光能分配有一定影响,如图1,T3处理光能主要分配于光化学反应(P)和天线热耗散(D),分别占42%,41%,而非光化学耗散(Ex)占17%,其他处理P部分显著低于T3,占23%~36%,相对增加了Ex份额,占30%~37%;且T4用于天线热耗散D份额显著低于其他处理。β/α-1表示PSⅠ与PSⅡ间激发能去向的平衡性,值越大,分配平衡性越小[18-19]。T3处理β/α-1显著低于T2,说明T3的PS Ⅰ激发能分配较多,两系统运作相对平衡。说明EC值为3.1 mS/cm(T3)处理利用光能效率较高。
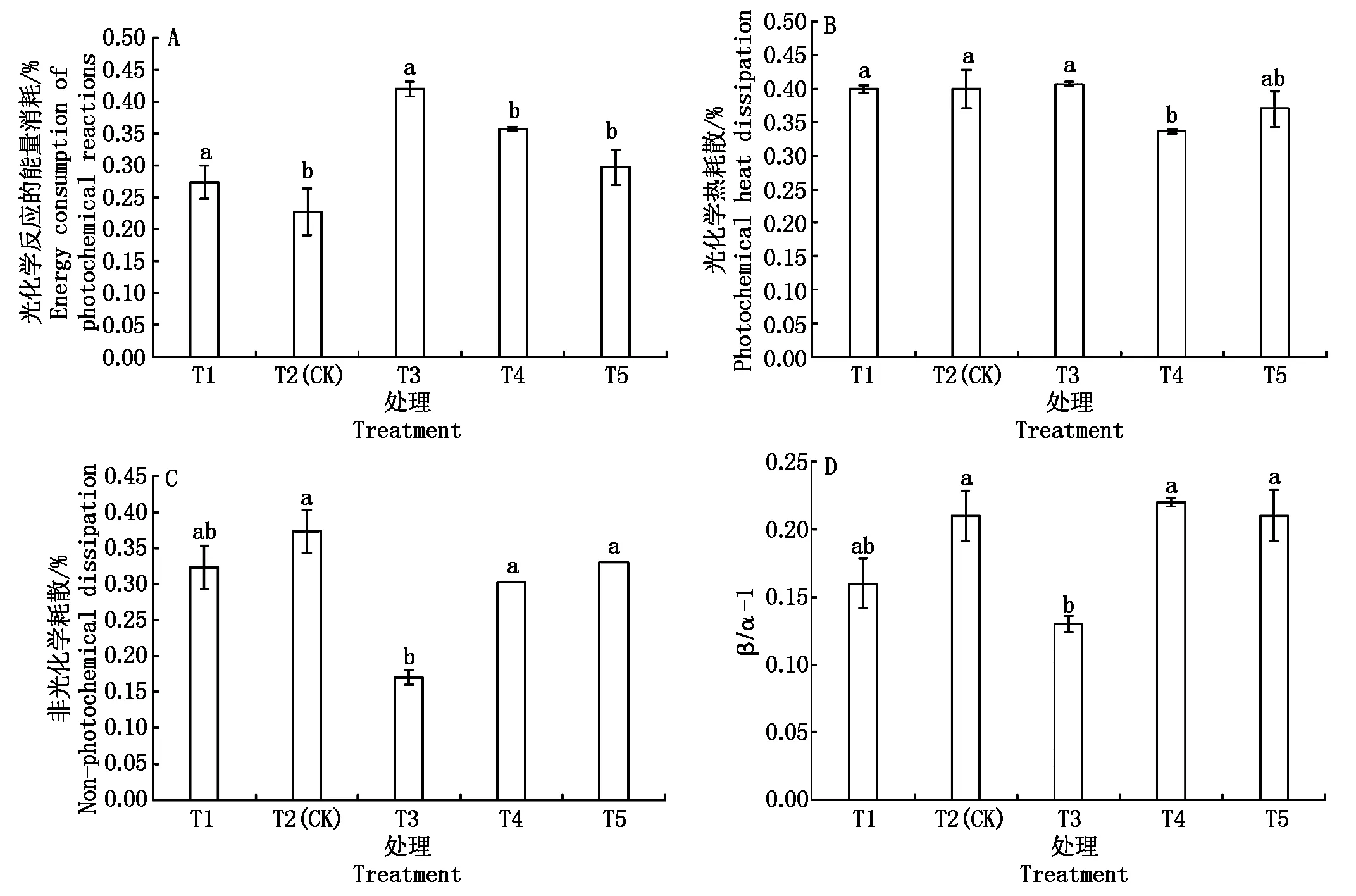
图1 不同浓度营养液对光能分配的影响Fig.1 The effect of different concentration of nutrient solution on light energy distribution
2.4.5 叶片显微结构 光学显微镜下观察叶片结构如图2,结构由上下表皮、栅栏组织及海绵组织组成,栅栏组织内分布大量叶绿体,栅栏组织越厚且排列紧密,则叶片光合能力越强[21]。由表8、图2可知,随EC值增加,叶片厚度呈先增后降趋势,而T1、T5栅栏组织呈短锥形,T2、T3、T4栅栏组织呈长棒形。其中T3处理叶片厚度、栅栏组织厚度分别比T2增加22.85%,25.93%;海绵组织厚度T3与T4处理无显著差异,分别比T2提高20.67%,23.42%;T4与T5处理的栅/海比显著低于其他处理;T4处理组织结构疏松度(海绵组织/叶片厚)显著高于其他处理,比T2提高14.58%,而组织结构紧密度(栅栏组织/叶片厚)较低。图2显示T3栅栏组织较厚且排列紧密,海绵组织相对疏松,而T1与T5叶片较薄,栅栏组织短且间隙较大。说明EC值为3.1 mS/cm(T3)处理叶片显微结构较好。

表8 不同浓度营养液对黄瓜叶片显微结构的影响Tab.8 The effect of different concentration of nutrient solution on the microstructure of cucumber leaves
3 结论与讨论
3.1 不同浓度营养液对黄瓜生长品质及产量的影响
无土栽培中,营养液浓度过高植物难以吸收,反之过低则不能满足植物对各种营养元素的需求[22]。本试验中,EC值3.1 mS/cm处理不仅提高了封闭式槽培黄瓜的株高、茎粗、叶片数,也提高了产量及VC含量,说明营养液EC值3.1 mS/cm适合封闭式槽培黄瓜植株生长发育。不同EC值处理对果实长度及果肉厚等也有显著差异,这与黄瓜植株的生长状况、营养吸收以及光合产出能力有关,但果柄长差异不显著,可能是由黄瓜品种决定的[9]。研究表明,大多数可溶性蛋白主要参与酶代谢,含量较高时可保持体内水分来缓解渗透胁迫[23],潘璐等[24]认为Rubisco关键酶对净光合速率Pn起决定性作用。本试验中,EC值3.5 mS/cm处理可溶性蛋白含量较高,可能促进了光合碳同化过程中Rubisco酶的代谢及表达[25],从而提高了固定CO2的能力,积累了较多光合产物,导致EC值3.5 mS/cm处理可溶性糖、可溶性固形物含量较高,并与EC值3.1 mS/cm处理无显著差异,均显著高于对照。
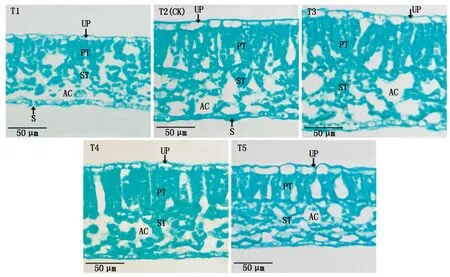
图为叶片横切面。UP.上表皮细胞;PT.栅栏组织;ST.海绵组织:AC.气腔;S.气孔。The picture is the cross section of the blade. UP.Upper epidermis cells; PT.Palisade tissue; ST.Sponge tissue; AC.Air cavity; S.Stomata.
3.2 不同浓度营养液对黄瓜叶片光合特性和显微结构的影响
研究认为叶绿素b有助于植株利用漫射光中的蓝紫光,提高叶片捕光能力、捕光色素复合体LHCP含量以及调节激发能在PSⅠ和PSⅡ间的光能分配[26],而且叶绿素含量对叶绿体的光合活性影响较大,当Chl a/b比值降低时,叶绿体对2,6-二氯靛酚的还原能力增强,进而光合磷酸化活性增强,有利于提高光合速率[27]。本试验在不同营养液浓度下,各处理叶绿素含量随EC值增加呈先升后降趋势,且Chl b较Chl a含量差异明显,Pn、总叶绿素与Chl b含量均以EC值3.5 mS/cm处理较高,其次为EC值3.1 mS/cm处理,且EC值3.1 mS/cm处理的β/α-1值较低,相当于PSⅠ与PSⅡ两系统运作相对平衡性,将较多的光能分配于非光化学耗散Ex部分,因此导致了EC值3.1 mS/cm处理的电子传递效率以及光能利用效率较高,这也与其栅栏组织厚度和紧密度有关,但叶片显微结构与PSⅠ、PSⅡ系统相互影响机制还有待研究。一般认为,类胡萝卜素Car在光合作用中为辅助色素,能耗散PSⅡ过剩能量以保护叶绿素免受分解[28]。本试验中EC值3.9 mS/cm处理Car较高,与其对较高EC值的耐受程度提高有关。
本试验中,随EC值增加,各处理Pn、Gs、Tr、Ci值呈先升后降趋势,则是气孔因素导致其他处理的Pn值降低[29],其中以EC值3.5 mS/cm处理最高,其次为EC值3.1 mS/cm处理,与本试验光合色素趋势一致,叶片吸收光合能力均较强。
研究表明,植物受环境的影响,叶片解剖结构会发生变化,而叶绿体主要存在于叶肉细胞的栅栏组织内,则叶肉细胞与栅栏组织细胞的厚度对光合作用起决定性作用,说明叶片的显微结构与光合效率有着密切关系[30-32]。李全发等[33]认为,叶片较厚又具有高度发达的栅栏组织,有利于减少植物体水分过度蒸腾。本试验中,从显微结构来看,EC值3.1 mS/cm处理叶片较厚,且通过栅栏组织的纵向伸长而增加厚度,栅栏组织排列较为紧密,海绵组织相对疏松,提高了Tr与WUE,也提高了光合能力。这一试验结果与Farquhar等[34]研究结果一致。但EC值3.5 mS/cm处理的栅栏组织/海绵组织厚度低于对照,叶片厚度高于对照,且qP、ΦPSⅡ和ETR低于EC值3.1 mS/cm处理,推测是海绵组织/叶片厚较高引起的。
营养液不同EC值对荧光参数也有显著影响。其中ΦPSⅡ是作用光存在时PSⅡ反应中心实际光化学量子效率,而ETR是衡量实际条件下的表观光化学电子传递速率。Fo是判断PSⅡ电子传递以及反应中心电子链接还原状况的指标[35],Fo值大小与叶黄素循环、叶黄素库有关,Fv/Fm代表PSⅡ最大光化学效率,若Fv/Fm降低,并伴随着Fo的上升,说明植株PSⅡ系统受严重破坏[36-37];周超凡等[38]对黄瓜的研究表明植株受到胁迫后,叶片ΦPSⅡ、Fv/Fm、ETR明显降低,Fo升高,表明叶片PSⅡ反应中心已经受到伤害。本试验中,EC值2.3,2.7,3.9 mS/cm处理的Fo显著升高且ΦPSⅡ、Fv/Fm、ETR降低,说明叶片PSⅡ受抑制程度较高。另外,ΦPSⅡ与ETR值均以EC值3.1 mS/cm处理显著高于对照,说明EC值3.1 mS/cm处理可提高PSⅡ实际原初光能捕获效率与电子传递效率。非光化学猝灭NPQ反映将PSⅡ吸收的光能,不用于光合电子传递而以热的形式耗散的部分,如果吸收了过量光能,不能及时耗散将使光合机构失活或造成破坏,因此非光化学猝灭qP可对光合机构起保护作用[39]。本试验中,NPQ值以EC值3.1 mS/cm处理低于其他处理,同时qP值较高,则说明用于非光化学热耗散较低且自我保护能力较强,与Ex值结果一致,证明EC值3.1 mS/cm处理提高了PSⅡ反应中心的活性与原初光化学效率,从而光合电子传递效率较高。结合显微结构综合分析,以EC值3.1 mS/cm处理黄瓜光能利用效率最高。
从光能分配情况来看,植物将吸收的光能分配于3个方面:用于光化学反应的能量P;用于非光化学反应消耗的能量Ex;用于热耗散的D部分[17]。有研究表明,植物在不适宜环境中叶片将会产生适应机制,主动降低对光能的吸收,会使光能的转化与分配效率降低,从而将过多的光能耗散掉以保护光合结构[40]。本试验中,2.3,3.9 mS/cm处理的Fv/Fm与qP相比较低,qP降低,则PSⅠ与PSⅡ间激发能分配平衡性降低,且Ex份额较多,说明较低或较高浓度下的植物不能将过剩光能转化,导致植物不能运行自我保护机制,从而PSⅡ反应中心活性受到了明显破坏或抑制,导致PSⅡ的电子传递链遭到损坏,叶片可能发生光损伤较严重[41];EC值3.1 mS/cm处理将光能主要分配于光化学反应P和天线热耗散D部分,表明该处理能将光合色素吸收的光能用于碳同化过程,从而避免过量的激发能在PSⅡ反应中心的积累[42],且该处理的β/α-1值最小,qP最高,有助于调节PSⅠ与PSⅡ间激发能分配平衡性,更有利于光能的合理利用。
综上,营养液不同浓度对封闭式槽培黄瓜生长发育有显著影响。相比对照,EC值3.1,3.5 mS/cm处理显著提高黄瓜果实及产量,且二者差异不显著。其中,EC值3.1 mS/cm处理叶片解剖结构较好,提高了黄瓜生长指标、果形指数及产量,且VC及游离氨基酸含量高于其他处理,也提高了光合电子传递效率与光能利用率等。EC值为3.5 mS/cm的Pn及光合色素含量较高,提高了果实内在营养品质,如可溶性糖、可溶性固形物及可溶性蛋白含量。说明在封闭式槽培栽培条件下,黄瓜营养液EC值为3.1,3.5 mS/cm处理黄瓜叶片光合能力较强,提高了黄瓜产量以及品质。
