拟南芥LBD15互作蛋白的筛选和鉴定
2019-11-05郭兆来孙旭东杨永平徐慧妮
郭兆来,孙旭东,杨永平,徐慧妮
(1.昆明理工大学 生命科学与技术学院,云南 昆明 650500;2.中国科学院 昆明植物研究所,云南 昆明 650201)
LBD(Lateral organ boundaries domain)是一类植物所特有的转录因子,具有保守的LOB(Lateral organ boundary)结构域。LOB结构域的特征是有具DNA结合活性的CX2CX6CX3C锌指结构域和Gly-Ala-Ser(GAS)域及具蛋白结合活性的LX6LX3LX6L亮氨酸拉链结构域组成[1]。LBD蛋白家族可以分为2个亚家族:Class Ⅰ和Class Ⅱ[2-3]。Class Ⅰ主要参与了植物侧生器官的发育和生长素信号的级联传递[4-6]。而Class Ⅱ主要参与了花青素的合成和氮代谢[7]。
AtLBD15是拟南芥LBD家族的一个成员,在拟南芥叶柄细胞脱分化研究中发现,AtLBD15可能参与了拟南芥叶柄细胞的脱分化过程,进一步研究发现AtLBD15表达可能受细胞分裂素的调控[12]。并且LBD15参与调控维管组织分化的调控[13]。Mangeon等[14]研究发现,LBD基因家族功能具有多样性,其多样性可能与启动子区调控域和编码区功能域的不同相关,调控区域和功能域的多样性能够导致重复基因的亚功能化或者新功能[15-16]。本研究通过酵母双杂技术筛选到一批与LBD15互作的调控蛋白,为进一步解析拟南芥LBD15的分子机理奠定基础。
1 材料和方法
1.1 试验材料
试验用拟南芥为哥伦比亚(Columbia Col-0),种植于云南省昆明市中国科学院昆明植物研究所,酵母菌株Y2HGold、Y187,大肠杆菌(Escherichiacoli)都是云南省昆明市中国科学院昆明植物研究所种质库保藏的;酵母双杂交载体的质粒为pDEST-GADT7(pGADT7,AD)、pDEST-GBKT7(pGBKT7,BD),质粒购置自ABRC。
1.2 拟南芥RNA提取及反转录
利用EastepTM Universal RNA Extraction Kit (Promega,中国上海)试剂盒提取拟南芥总RNA,用ND-1000分光光度计检测RNA浓度和质量。利用GoScriptTM®Reverse Transcription System试剂盒以提取的总RNA为模板反转录合成cDNA。以反转录的cDNA为模板用LBD15基因特异引物(ENTR-L15F:caccATGTCAAGAGAAAGGGAGAG;ENTR-L15R:ACCGAAGTAGTTGTTCTCAC)扩增得到LBD15的基因序列。利用Gateway技术将LBD15重组到质粒pGADT7、pGBKT7,PCR检测阳性克隆,阳性克隆送硕擎测序验证。
1.3 酵母转化、重组质粒细胞毒性和自激活检测
将构建好的BD-LBD15重组质粒转入到用LiAC法制备的Y2HGold酵母菌株的感受态细胞中,用SD/-T选择性平板进行筛选,将筛选到的单菌落在SD/-T液体培养基中培养,并且用作酵母杂交的种子液。
1.4 通过酵母cDNA文库筛选结合蛋白
将上述转化到酵母Y2HGold菌株中的重组质粒BD-LBD15,通过选择性平板(SD/-T)筛选后,在28 ℃摇床中培养到OD260=0.8,然后将其与含有cDNA文库的酵母Y187菌株混合培养24 h,将混合培养后的酵母细胞离心,弃多余的上清,剩下100 μL重悬沉淀后,涂到TDO(SD/-Trp/-Leu/-Ade)的平板上,放入28 ℃培养箱中黑暗培养2~3 d取出,在超净台里用灭过菌的枪头将平板上的菌落转移到QDO(SD/-Trp/-Leu/-Ade/-His)平板上,菌落的编号不变, 28 ℃培养箱中继续培养,挑选QDO平板上的菌落,28 ℃摇床上进行培养,用酵母质粒提取试剂盒提取质粒,然后转化大肠杆菌,在37 ℃过夜培养,挑选单菌落按编号送到公司测序,对测序后的结果进行分析。
2 结果与分析
2.1 含LBD15基因的pGBKT7载体的重组
RT-PCR克隆LBD15基因获得大小为675 bp的片段(图1-A),与预期条带相符;用Gateway技术将LBD15重组到质粒pGBKT7后转化大肠杆菌。挑选单菌落进行PCR鉴定有带,提取PCR鉴定有带的重组表达载体的质粒然后进行双酶切验证(图1-B),阳性克隆的菌送到硕擎测序公司进行测序鉴定。
2.2 重组质粒pGBKT7-LBD15的自激活检测
将构建得到的BD-LBD15和AD质粒转入到酵母Y2HGold菌株中,在选择性的二缺平板(SD/-Leu/-Trp)上进行筛选,并且将长出来的酵母菌落点滴到四缺板上(SD/-Trp/-Leu/-Ade/-His),同时共转pGADT7(AD)和BD到Y2HGold菌株中,作为负对照,放入28 ℃培养箱中黑暗培养2~3 d后观察结果,试验组和负对照没有菌落长出,说明重组质粒BD-LBD15没有自激活现象,即LBD15蛋白在酵母菌株Y2H中没有自激活的现象,适合用作互作蛋白文库的筛选(图2)。

A.LBD15基因PCR扩增;B.酵母表达载体pGBKT7-LBD15双酶切鉴定;M1.DNA分子量标准500~2 000 bp; M2.DNA分子质量标准500~2 000 bp。
A.PCR amplification ofLBD15gene; B.Identification of yeast expression vector pGKT7-LBD15by double enzyme digestion; M1. DNA Marker DL2000; M2.DNA Marker DL2000.
图1 含LBD15基因的酵母表达载体构建
Fig.1 Construction of yeast expression vectorcontainingLBD15gene

图2 pGBKT7-LBD15自激活检测Fig.2 Identification of pGBKT7-LBD15 for auto-activation
2.3 互作蛋白的筛选与分离
将共转化酵母菌株Y2H感受态细胞中的BD-LBD15质粒和拟南芥cDNA文库均匀的涂布于DDO/X/A的固体培养基上进行培养;挑选阳性的单克隆进一步接种到QDO/X/A固体培养基上进行培养。将候选的阳性单克隆转接到DDO/X固体培养基进行培养,然后筛选分离出蓝色阳性单克隆(图3)。

图3 候选蛋白在DDO/X固体培养基中的筛选Fig.3 Screening of candidate proteins in DDO/X solid medium
2.4 LBD15 cDNA文库的筛选结果
把在TDO板上得到的酵母菌落,在转移到新的TDO平板上保存并给予唯一编号,然后挑选单菌落,摇菌提质粒,再转化大肠杆菌,37 ℃培养箱过夜培养,挑选单菌落,摇菌后送到公司进行测序。
在本次筛库试验中,146个样送测序有107个测出序列,通过NCBI Blast分析,其中有96个获得了基因号,占总数的87.9%。根据基因号进行分类,得到了48个蛋白。然后把基因号通过网站TAIR(www.arabidopsis.org/index.jsp)查找其蛋白序列,通过http://cello.life.nctu.edu.tw/分析其亚细胞定位。每个蛋白在筛选文库中重复的次数以及功能的描述如表1所示。在筛选到的这48个蛋白中有59%的蛋白都有重复。

表1 LBD15结合蛋白及功能分析Tab.1 The functional analysis of LBD15 binding proteins
利用Blast2GO对候选的48个基因进行了Gene Ontology(GO)注释(图4),结果表明,AtLBD15候选互作蛋白参与了14个生物过程,包括细胞过程、代谢过程、刺激响应、生物过程的调控、单组织和多组织过程及发育进程调控等。

图4 AtLBD15候选互作蛋白Go Ontology注释Fig.4 Go Ontology annotation of AtLBD15 candidate interaction proteins
2.5 互作蛋白的分离和回复验证
将BD-LBD15诱饵质粒和筛选出的互作蛋白的质粒共转化酵母感受态细胞,在SD/-Trp/-Leu营养缺陷型平板上培养,挑选单菌落于1 mL YPDA液体培养基培养,吸取1 μL培养浑浊的菌液点至SD/-Trp/-Leu/-Ade/-His营养缺陷型平板上培养,结果发现,AP19蛋白及其他一些蛋白的菌落能够在营养缺陷型的平板上正常生长(图5),初步证实,AP19等候选蛋白与LBD15蛋白在酵母细胞中互作。
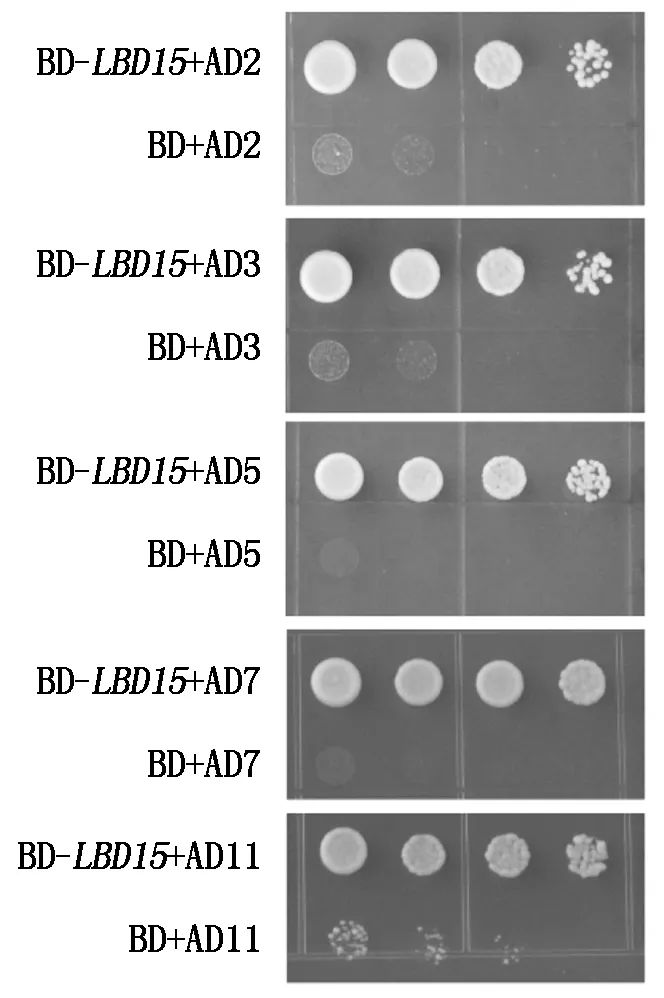
图5 酵母双杂交回复验证Fig.5 Confirmation of positive interaction by yeast two-hybrid
3 讨论
LBD是植物特有的一个转录因子家族,在植物生长发育进程中起着重要的作用。拟南芥基因组中存在42个LBD基因,分为2个亚家族,亚家族Ⅰ比亚家族Ⅱ多了一个卷曲螺旋结构,这一结构可能在蛋白互作中起作用[2]。LBD调控了大量的生长发育和代谢进程,像叶片发育、花发育、胚形成、侧根形成及氮和花青素代谢[17-18]。最近的研究发现,LBD还参与调控了花粉发育、植物再生、感病性、光形态建成、次生生长及叶柄发育[1, 19]。由植物激素诱导植物再生过程的第一步便是愈伤组织的形成, 该过程与侧根发育过程极其相似[20]。
前期工作发现,LBD15参与了植物再生、茎顶端分生组织调控及次生细胞壁的形成[12, 21-22]。最近又有研究组发现,LBD15能够直接结合到VND7启动子上激活其表达,进而促进导管的形成[23]。利用LBD5筛选酵母文库,获得了48个互作的蛋白,这些蛋白参与了多个调控网络,涉及多个方面的功能,如细胞过程、代谢过程、刺激响应、生物过程的调控和发育过程等,证实了LBD功能多样性的作用机制。在筛选的48个互作蛋白种有1个Expansin-LikeA1(EXPLA)蛋白,但是AtLBD15和EXPLA作用机理还不了解。LBD18通过结合到EXP14和EXP17启动子上激活其表达,进而参与到生长素调控的侧根原基起始过程中[9]。而LBD15与EXPLA发生互作可能与茎顶端分生细胞伸展生长有关。二者之间的互作关系的机理研究对LBD15调控茎顶端分生组织发育的调控具有一定的意义。维管形成层细胞的表面受体是PXY(Phloem intercalated withxylem), 其通过与亮氨酸的结合作用来介导维管组织的形成。近期有文章研究发现, PXY同WOX14、LBD4及TMO6(Target of monopteros 6)形成了一个复杂的转录调控网络, 协同调控维管组织的形成过程[24-25]。
近年来,泛素化过程受到越来越广泛的关注,其是植物蛋白最常见的修饰方式之一,在细胞生命活动的许多进程中发挥着重要的作用。泛素化的蛋白质会被蛋白酶体(Proteasome)识别进而被降解。3种泛素酶即:活化酶E1(Ubiquitin activating enzyme)、结合酶E2(Ubiquitin conjugating enzyme)和连接酶E3(Ubiquuitin-protein ligase)共同介导了泛素化这一过程。本试验筛到1个与AtLBD15互作的泛素结合酶E2-UBC6。推测AtLBD15和UBC6互作可能参与了刺激响应及免疫反应等。
LBD 家族蛋白在高等植物中分布广泛,在高等植物的生长发育过程中起着十分重要的作用,然而其功能的分子机制并不清楚。后续工作将主要获得拟南芥LBD15互作蛋白的遗传材料,利用遗传学和分子生物学深入研究LBD15蛋白的功能,以期更好地阐明其工作机理。
