甲状腺功能减退伴垂体增生及卵巢异常2例
2019-11-05胡永宾单鹏飞刘颖慧
胡永宾,单鹏飞,刘颖慧
(1.浙江省中西医结合医院,浙江 杭州310004;2.浙江大学医学院附属第二医院,浙江 杭州 310009)
长期严重的原发性甲状腺功能减退可伴有垂体腺瘤样增生改变,已逐渐被内分泌临床医生认识,但此类疾病还伴有生殖系统的明显异常,常被忽略。现报道2例以甲状腺功能减退伴垂体增生及卵巢异常为主要表现的患者,具体如下。
1 病例介绍
例1 女,24岁,因“月经稀少4年”于2016年6月14日入住浙江省中西医结合医院。4年前无明显诱因下出现月经稀发,间隔周期约35-80天,渐闭经,外院予黄体酮胶囊口服后重现月经,停药后又闭经;3年前出现双乳触压泌乳,量少;4个月前自觉视力下降,但未重视;3个月前妇科超声示“附件区多发膨大囊肿”,性激素检查示泌乳素(PRL)升高,垂体MRI示“垂体占位”。查甲状腺功能:TT3<0.15nmol/L(1.3~3.1nmol/L),TT4<3.9nmol/L(66~181nmol/L),TSH>150mIU/L(0.34~5.60mIU/L)。 未婚未孕,初潮14周岁,否认服用胃药史。入院查体:T 36.6℃,P 63次/min,BP 108/56mmHg,身高 160cm,体质量 53kg,颜面轻度浮肿,贫血貌,无甲状腺肿大,质地中等,未扪及结节,双乳Tanner分期5期,呈成年女性乳房,饱满并有触压泌乳。实验室检查:FT30.62pmol/L(3.5~10.4pmol/L),FT42.87pmol/L(7.5~24.1pmol/L),TSH>150mIU/L(0.34~5.60mIU/L),TPOAb 126.3mIU/L(0~60mIU/L),TGAb 正常;FSH 9.55U/L (卵泡期2.12~10.89U/L),LH0.1U/L (卵泡期 3.85~8.78U/L),PRL72.31ng/mL(3.34~26.23ng/mL),雌 二 醇(E2)1239.0pg/mL(卵泡期 24~176pg/mL),Hb85g/L(110~160g/L), 肌酸激酶 348U/L (15~195U/L),CA125834U/mL(0~35U/mL);心脏超声:心包积液,侧壁厚约25mm;垂体增强MRI:垂体大小约20mm×15mm×13mm,增强后可均匀强化,垂体瘤考虑(图1A)。妇科超声:子宫内膜厚5mm,双附件明显增大,左附件区见70mm×41mm×43mm囊性液性暗区,右附件区见76mm×44mm×45mm囊性液性暗区,内均可见多个分隔且分隔薄(图1B)。甲状腺超声:甲状腺偏小,回声不均。诊断:(1)原发性甲状腺功能减退伴垂体增生;(2)VW-G综合征;(3)继发性高泌乳素血症;(4)双侧卵巢巨大囊肿;(5)中度贫血。予左旋甲状腺素片50~100μg,1 次/d, 琥珀酸亚铁 0.2g,1 次/d,甲钴胺0.5mg,3次/d,口服治疗。3个月后随访,体质量下降6kg,贫血貌改善,复查实验室指标:FT37.42pmol/L(3.5~10.4pmol/L),FT422.53pmol/L(7.5~24.1pmol/L),TSH 1.78mIU/L(0.34~5.60mIU/L),FSH 7.35mIU/L (卵泡期 2.12~10.89U/L),LH 8.21mIU/L(卵泡期 3.85~8.78U/L),E231.4pg/mL (卵泡期 24~176pg/mL),PRL 32.56ng/mL(3.34~26.23ng/mL),CA125 15.2U/mL (0~35U/mL),Hb 109g/L (0~35U/mL)。心脏超声:心包积液消失;垂体增强MRI:垂体高约7mm,较前明显缩小(图1C);1年后复查妇科超声:左附件区32mm×21mm×19mm,右附件区33mm×24mm×21mm,较前明显变小,形态饱满,两侧均见20个左右直径2~9mm大小囊泡(图1D)。
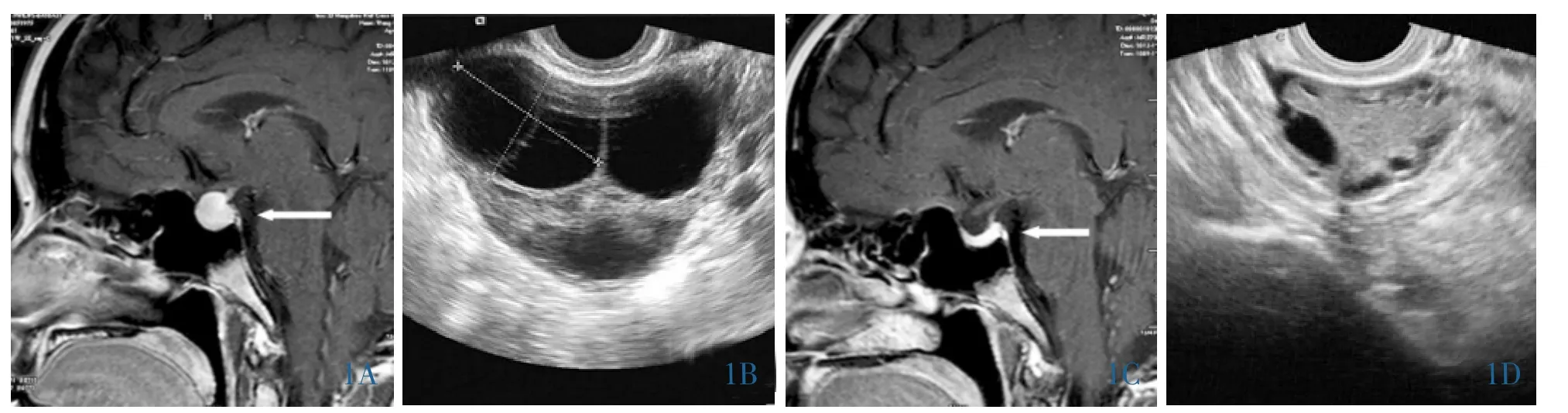
图1 例1头颅及腹部影像学表现。1A:治疗前增强MRI矢状位,垂体增大(箭头);1B:治疗前妇科超声示附件区多发巨大囊性液性暗区;1C:治疗3个月后垂体缩小至正常(箭头);1D:治疗1年后附件区多发囊性暗区明显缩小。
例2 女,23岁,因“活动后乏力2个月”于2016年9月14日就诊于浙江省中西医结合医院。2个月前渐感体力下降,10天前体检心脏超声示“心包大量积液”,无发热、胸闷胸痛。10年前患“肺结核”,正规抗结核治疗1年后治愈;8年前因左外耳道反复流脓外院诊断为“左侧慢性化脓性中耳炎”,抗生素治疗后症状缓解;未婚未育,无月经来潮。否认其他重大疾病及遗传病史。 查体:T 36.9℃,P 84 次/min,B 16次/min,BP 121/72mmHg, 身高 150.3cm, 体质量56kg,颈短且宽,多痣,后发际低,无颈蹼;双侧乳房Tanner分期3期,双侧乳头内陷,心浊音界向两侧扩大,心音遥远;左手第5指,右手第4、5指及左足第4趾均偏短。血常规:WBC 12.1×109/L,N%74%,血生化:血糖4.89mmol/L,总胆固醇7.42mmol/L,LDL-C 4.00mmol/L,肝功能、肾功能、电解质均正常。血ACTH (8am)10.70ng/L (9.2~52ng/L),8am 皮质醇13.18μg/dL(8.6~20.5μg/L),抗缪勒氏管激素 0.06ng/mL (0.76~11.74ng/L),β-胶原特殊序列 874ng/L(中青年 145~766ng/L),FT31.96pmol/L,FT42.75pmol/L,TSH>150mIU/L,TPOAb>1300mIU/L,TGAb>500mIU/L,FSH 4.1U/L,LH2.72U/L,PRL16.2ng/mL,E221.0pg/mL,Hb122g/L, 肌酸激酶 360U/L,CA125 12.6U/mL;心包穿刺并引流出淡黄色微浑液体800mL。外周血细胞染色体检查:45X,Turner综合征。垂体增强MRI及双手、足X线片见垂体增大(图2A)及多处掌骨(图2B)、指骨短畸形(图2C);甲状腺超声:甲状腺大小正常,弥漫性回声改变,考虑桥本甲状腺炎;心脏超声:主动脉瓣畸形,二叶式主动脉瓣考虑,降主动脉起始段隔膜样回声,降主动脉缩窄考虑;妇科超声:幼稚子宫及卵巢,未见明显卵泡回声;附件MRI未见阴道影像。双能X线骨密度示:骨质疏松,全腰椎T值-2.6;双侧乳突内听道CT示:左侧乳突气化差,左侧中耳乳突炎考虑。耳鼻咽喉科会诊:双耳感音神经性耳聋,左耳混合型耳聋,左耳慢性化脓性中耳炎。 最后诊断:(1)Turner综合征(45X);(2)桥本甲状腺炎;(3)原发性甲状腺功能减退;(4)甲减继发垂体增生;(5)甲减性心脏病;(6)心包积液;(7)先天性多发心血管畸形;(8)双耳感音神经性耳聋;(9)左侧慢性化脓性中耳炎。予左旋甲状腺素片75~100μg/d、补佳乐2mg/d口服。治疗3个月后复查:FT36.52pmol/L,FT414.03pmol/L,TSH 4.48mIU/L,FSH 31.29U/L,LH 9.13U/L,E25.0pg/mL,Hb 135g/L,肌酸激酶176U/L,CA125 13.7U/mL;垂体MRI示垂体较前明显缩小(图2D)。2017年5月6日补佳乐改为芬吗通口服行人工周期,2017年8月复检双乳房Tanner分期5期,骨骺端基本闭合,双能X线骨密度提示全腰椎T值为-2.2。

图2 例2头颅及四肢影像学表现。2A:初诊时增强MRI矢状位示垂体弥漫性增大,17mm×13mm×11mm,增强可明显强化;2B:双手X线正位片示多处掌骨、指骨短畸形(箭头),骨骺未闭合,TW3法测骨龄13.9岁;2C:双足正位片示左第4跖骨短畸形(箭头)2D:治疗3个月后垂体缩小。
2 讨论
本文2例均为青年女性,且存在严重的原发甲减及垂体腺瘤样增生,甲状腺素替代治疗后甲状腺功能均恢复正常,垂体增生均明显缓解。长期甲减反馈性刺激垂体TSH细胞代偿性增生,增生的垂体在影像上可呈腺瘤样改变,有时可压迫视交叉神经影响视力视野;同时,严重甲减时下丘脑生成促甲状腺素释放激素(TRH)增多,后者刺激TSH细胞及PRL细胞增生,易致PRL升高,因此甲减伴垂体瘤样增生临床上容易被误诊为垂体PRL瘤,甚至行不必要的垂体手术,术后出现医源性垂体功能减退[1],垂体瘤样改变须排除原发甲减,应引起医生的重视。
与甲减继发垂体增生不同的是垂体PRL瘤多无原发性甲减,而PRL升高更显著 (通常大于200ng/mL),E2及FSH偏低;而甲减继发垂体增生者PRL升高常有限 (通常小于150ng/mL),E2及FSH正常或升高,甲减纠正后PRL、E2及FSH均可降至正常。本文例1初诊血E2明显升高,甲状腺替代治疗后明显下降至正常。
1960年未成年女童甲减继发假性性早熟及性腺增大首次被系统性报道,被命名为 “Van Wyk-Grumbach 综合征(VWGS)”,2012 年后国内也陆续有个案报道[2-3],且多为女童,伴有双侧卵巢明显增大伴多房性囊肿。本文例1为成年女性VWGS,更为少见,表现为甲减伴双侧卵巢多发巨大囊肿。因CA125可显著性升高,易误诊为卵巢恶性肿瘤,需要及时排除。
例1卵巢大囊肿发生机制为:甲减反馈激活下丘脑-垂体轴,TRH、TSH明显升高,TSH与FSH结构相似,均为相同α亚单位及相似β亚单位组成,高水平TSH能依赖性激活FSH受体[4],且升高的TRH刺激FSH轻度升高并抑制LH分泌[5],故表现为卵巢FSH受体过度受刺激,卵泡增大,出现多囊伴囊内积液,子宫内膜增生期样改变[6]。E2显著升高是由于卵巢颗粒细胞内FSH受体持续被刺激,致芳香化酶作用增强,雄烯二酮转化为雌激素增多。CA125显著性升高与甲减对CA125清除速率下降及心包积液、卵巢巨大囊肿CA125合成过多有关[7-8]。本例甲减替代治疗后CA125及E2迅速降至正常,附件区多发大囊肿明显消退,卵巢体积较治疗前明显缩小。随访至今,患者甲状腺功能持续正常已3年,双侧卵巢仍有多发小囊肿,直径2~9mm,左侧16个,右侧 19 个,且睾酮偏高(0.85~1.21ng/dL),无自发月经,予黄体酮口服撤退治疗后月经来潮,具体机制尚不清楚。
例2与例1甲减伴垂体增生程度相似,但性腺变化截然相反,例2存在先天性卵巢发育不全,即Turner综合征(TS),表现为卵巢子宫幼稚、E2低下、身材矮小、短指/趾畸形、心血管系统畸形、骨骺闭合延迟、骨矿化不良、耳道畸形易患中耳炎等,该患者呈现出一系列的TS症状[9]。TS易患自身免疫性疾病[10],最常见的是自身免疫性甲状腺炎,后可发展至甲减[11],具体机制与一条X性染色体缺失有关。因此,年轻女性如发现原发甲减也应警惕TS的可能。TS因卵巢发育不良,合成性激素能力极差,雌激素暴露不充分致骨骺闭合延迟且易骨质疏松。该病经左甲状腺素及雌孕激素替代治疗后可纠正甲减,乳房、子宫及外阴亦可发育,骨质疏松好转,但卵巢产生卵子能力仍差,或不具备正常生育能力。
本文2例均是青年女性,均有长期严重的原发性甲减及继发垂体瘤样增生,例1表现的VWGS为原发甲减还继发双附件区巨大多房囊泡样变,E2明显增高;例2表现为子宫卵巢小而幼稚,且E2明显降低,与例1形成强烈对比,考虑先天染色体异常所致,本文2例能加深对两种疾病的认识,以减少误诊误治。
