环境中铝来源、铝毒机制及影响因子研究进展
2019-11-04蔺庆伟马剑敏彭雪孙健刘碧云吴振斌
蔺庆伟,马剑敏*,彭雪,孙健,刘碧云,吴振斌
1. 河南师范大学生命科学学院,河南 新乡 453007;2. 中国科学院水生生物研究所,湖北 武汉 430070;3. 中国市政工程中南设计研究总院有限公司,湖北 武汉 430010
铝(Al)是地壳中含量最丰富的金属元素(Zheng et al.,2005)。过去数十年,全球每年约4.38×109t原铝被用于人类社会活动(如航空、建筑、电业、工业生产、生活用具和农业等)(唐远景,1994;王冰,2014;Zhu et al.,2016)。随着生产力和经济水平的提高,铝用量每年持续增长(Zhang et al.,2016)。正常情况下或较低浓度下(<0.2 mg·L-1)铝对生物是无毒的。目前世界上约40%的耕地为酸性,而且酸雨出现的频度和范围逐渐扩大,铝在酸性条件下(pH 6.0-6.5)更易以离子态溶出,严重危害植物的产量和品质(Stodart et al.,2007;Chen et al.,2018),影响生物多样性。随着食物链的转移和富集,铝对动物乃至人体也产生损害,因而受到广泛关注(Stodart et al.,2007)。
传统铝盐絮凝剂(明矾 KAl(SO4)2·12H2O,硫酸铝Al2(SO4)3·18H2O)在给水和污水处理中具有良好效果,近年来传统和新型絮凝剂(聚合氯化铝PAC)在湖泊富营养化治理、除磷控藻方面也得到越来越广泛应用(Lin et al.,2017a;Rott et al.,2017)。处理后的尾水以及酸雨淋溶携带大量的铝盐进入河流、湖泊等自然水生态系统,长久富集的铝盐会对水生植物、鱼类、浮游生物等产生毒害(Jiri et al.,2005;Kochian et al.,2015)。前人的研究关注酸性环境中铝的毒性,且主要集中于对陆生植物的毒害作用,而对水生生物的铝毒方面研究较少,且注重室内模拟研究,关于大范围、大流域、野外原位铝毒的研究鲜有报道。本文综述了有关陆地及水生生态系统中铝的来源及存在形式,铝毒对藻类、鱼类、植物和人体的影响以及影响铝毒因子的研究进展,以期为铝的科学应用及生态系统中的铝毒风险评估提供一定的参考。
1 生态系统中铝盐的来源及存在形式
1.1 陆地生态系统中铝来源及存在形式
自然条件下,铝在地壳中主要以化合态的形式存在于各种岩石或矿石里(约占地壳总量的7.8%),如铝硅酸盐正长石K(AlSi3O8),钠长石Na(AlSi3O8),钙长石 Ca(Al2Si2O8),白榴石 K(AlSi2O6),霞石Na(AlSiO4),硅线石 Al2SiO5和高岭石Al2O3·2SiO2·2H2O 。 铝 土 矿 AlO(OH)和 冰 晶 石Na3AlF6是重要的铝矿来源。纯的氧化铝以金刚砂的形式存在,当被低含量的其他金属氧化物染色时,它会形成红宝石或蓝宝石(Namiesnik et al.,2010)。由铝的氧化物与冰晶石共熔电解可制得铝(高兰等,2015)。
经过多年的研发,人类掌握了铝的诸多特性和用途。由于铝在空气中具有良好的稳定性、以及出色的导电导热性、延展性和抗腐蚀性等特点,它被广泛应用于制作生活器具、电缆材料、热交换器、器械装置等诸多方面(李青等,2016;王冰,2014;许国栋等,2012),且质量轻强度高的特点赋予铝合金在国防军工、航空、交通等领域具有特殊用途(唐远景,1994)。不同形态的铝盐凭借其化学特性在医药、农业、造纸、净水、杀菌消毒等方面发挥各种各样的作用,如Al(OH)3凝胶液具有中和胃酸和治疗溃疡的作用;磷化铝用于谷仓杀虫的熏蒸剂(Zheng et al.,2005);硫酸铝常用作造纸的填料、媒染剂,并用于制造沉淀色料、防火布和药物;明矾是一种重要的净水剂、染媒剂(李青等,2016)。硝酸铝可用来制白热电灯丝,硅酸铝常用作颜料以及油漆、橡胶和塑料的填料等,铝的羧酸盐也常被用作防水剂、杀菌剂、消毒剂和耐热稳定剂等(贺婷婷,2013)。
铝在人类社会生活中的广泛应用也正是生态系统中铝的丰富来源。目前,除铝制炊具和自然摄入(饮用水、空气、药物)外,食品本底及含铝食品添加剂(硫酸铝钾、硫酸铵铝和部分铝色淀)成为人们日常生活中铝的主要来源。当人体通过各种途径摄入过多的铝元素(Al 2 mg·kg-1人体质量)时,我们的神经、骨骼、肝脏和生殖系统等都会受到不同程度的损伤和致毒。此外,近 50年来,铝已成为世界上应用最为广泛的金属之一(高兰等,2015),随之带来的是铝工厂、化工工业排放大量含铝的废水,对环境造成严重的污染,铝生产工厂排放的污水中含铝可达300-1000 mg·L-1,氧化铝生产工厂排放污水中含铝可达10-70 mg·L-1(周立志,2016)。作为金属,铝可以回收再造,但是回收率不高,往往以铝单体、氧化铝或合金形式流散到周围环境中,再经氧化、酸化、溶解等反应进入土壤、水体等生态系统。
中国铝土矿储量占世界总储量的2.8%,居世界第7位。中国目前是世界上铝型材生产大国,截至2007年,中国在产的铝挤压厂数量、生产能力、产量均居世界第一(许国栋等,2012;王冰,2014)。经过近几年产品结构的调整和市场调节,铝加工厂数减少,分布逐步分散;产品出口增加,成为世界上最主要的铝型材生产和净出口国家。中国铝加工材快报产量和型材逐年增高(高兰等,2015),但是铝工业废渣赤泥附液中铝含量高达3501 mg·L-1,这些废渣如果得不到科学的处置,经过漫长的迁移转化进入土壤,会对陆地生态系统产生严重污染(Zhu et al.,2016;周立志,2016)。
1.2 水生态系统中铝来源及存在形式
自然条件下,河流、湖泊中的铝来源于岩石、土壤风化产物在天然水体中的溶解,其含量和形态取决于流域岩石土壤类型、气候特点、风化类型、植被因素等条件(石慧,2016)。虽然天然水体中铝的含量很低,但是随着世界经济的快速发展,酸雨出现的频度和范围不断扩大,酸雨或其他酸性废水反复冲刷、浸渍着地表中的铝土及其伴生矿,加上土壤酸化使其中的铝被活化成为溶解态,令铝大量溶出,使陆地环境中的铝越来越多地进入水体;另一方面,酸雨或大气中酸度增加,腐蚀各种铝制品,使其快速溶解进入环境,增加环境中的铝负荷;再者,由于湖滨带和江滨带的快速发展,一些酸性土壤被扰动,采矿、冶炼、化工制药等工业产生的大量含铝废水、废渣进入水体生态系统(杨忠莲,2013)。
而且,铝盐(Al2(SO4)3、AlCl3、KAl(SO4)2·12H2O、聚合氯化铝和聚合硅酸铝类等)广泛用作水的混凝剂、“锁磷剂”、杀藻剂,在湖泊富营养化控制(Cooke et al.,2005;王艳等,2010;Nogaro et al.,2013)、除磷抑磷(Robertson et al.,2000;Lin et al.,2017a;朱广伟等,2017)和污/废水处理(Sharp et al.,2006;Agarwal et al.,2016)、引水工程预处理(Verma et al.,2012;Jin et al.,2015;张玥等,2017)、杀藻控藻(Wen et al.,2018)等方面的应用也越来越广泛,但这些可溶性铝化物在净化水的过程中,同时也给处理过的水留下了不同程度的残留铝。所以越来越多的铝包括雨水径流含铝,进入到自然水生态系统中(Wang et al.,2010)(见图1)。地表水正常铝浓度在60-300 μg·L-1之间,河流水中平均铝含量为64 μg·L-1,但是随着外来铝的汇入,日积月累富集带来一定的生态风险,不仅污染环境、危害生态,而且毒害人类健康(贺婷婷,2013)。
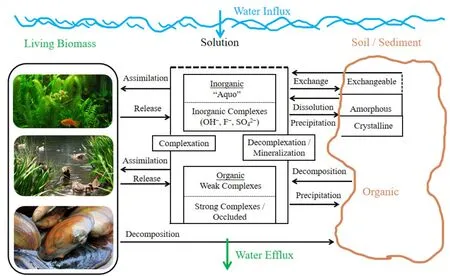
图1 水生态系统中铝循环示意图(Driscoll et al.,1996)Fig. 1 A schematic representation of the Al cycle in aquatic system (Driscoll et al., 1996)
之前的研究(王振华,2012)表明,中国主要河流长江、珠江、湘江、鸭绿江等水中的溶解铝含量为1.7-52.9 μg·L-1,而白洋淀湿地湖泊的可溶性铝含量较高,为261-429 μg·L-1。云贵高原沉积物铝含量高于东部地区,富营养化程度越高,沉积物中磷、铝含量越高。美国东部阿迪朗达克地区 203个湖泊的平均pH值为6.3,总铝含量为137.7 μg·L-1,单体铝含量为 43.2 μg·L-1(Robert et al.,1999)。在明矾处理过的地表水中,铝的浓度可达2.57 mg·L-1。在美国,地下水和地表水中铝浓度分别为140-290 μg·L-1和 16-1170 μg·L-1(Wang et al.,2010)。国外报道(Driscoll et al.,1996)佛罗里达州的168个湖泊总铝平均含量达89.1 μg·L-1,其中12%为酸性,pH 6.3。
当进入水体中,铝盐快速溶解,形成铝离子,随后通过几步反应发生水解作用(Al3++3H2O=Al(OH)3+3H+),形成一种不溶解的胶状晶体(Al(OH)3)絮状物(Ebeling et al.,2006)。硫酸铝盐可以与水体磷反应生成 AlPO4;随之AlPO4吸附到 Al(OH)3絮状物上沉淀到底部,然后经处理而被去除(Rott et al.,2017)。在湖泊中,Al(OH)3絮状物沉积底质上覆盖一层,抑制底质中磷向水体的释放。在水处理过程中,沉淀、气浮等许多工艺都要投加混凝剂,这样虽然去除了某些杂质,但是水中的铝浓度很高,一般即使经过沉淀大约仍有11%的铝残留于水中(刘言正等,2012)。
铝作为一种两性元素,在强酸性(pH<4)环境中,水合阳离子主要以[Al(H2O)6]3+存在,但在碱性条件下主要以[Al(OH4)(H2O)2]2-形式存在(Clarke et al.,1996)。pH 4.5-5.5 时,[Al(H2O)6]3+离子会与水体中的有机或无机污染物的配体结合形成混合络合物。pH 6.0左右条件下,Al(OH)3略有可溶性。pH 6.2-7.0时,铝形成一系列的中间产物,如[Al(OH)2(H2O)4]+和[Al(OH)(H2O)5]2+,但是碱性环境中,生成[Al(OH)4(H2O)2]-和[Al(OH)5(H2O)]2-(Namiesnik et al.,2010)。相当一部分铝还会与氨基酸、胺类、糖类和有机酸,及聚合大分子化合物腐殖酸(HA)、富里酸,以及含氟、氮、硫的化合物相结合。因此,自然水体中的铝通常以氢氧化物、硫酸盐、氟化物、氟铝酸盐混合物以及水解产生的许多大分子水合复合物形式存在,如[Al2(OH)2]4+,[Al3(OH)4]5+,[Al6(OH)15]3+,[Al8(OH)20]4+,[Al(OH)2(H2O)4]+,[Al(OH)(H2O)5]2+和[Al13O4(OH)24]7+,它们之间相互平衡(Burgess,1992)。
污水成分日趋复杂,随着人类对生态环境要求的不断提高,传统铝盐絮凝剂已不能满足使用要求,开发采用新型、高效环保、低残留的天然高分子絮凝剂势在必行(张亚文等,2009;Almubaddall et al.,2009;Harrelkas et al.,2009)。微生物和复合絮凝剂在今后的废水处理中将具有广大前景(Ahmad et al.,2008;Liu et al.,2017;Peng et al.,2017)。
2 铝盐的毒性效应及作用机制
铝在低浓度下(<0.2 mg·L-1)是无毒的,但是随着铝的应用、富集越来越多,环境逐渐酸化,其毒性也被关注。况且越来越多的铝进入水生态系统,由于生物富集和放大效应可能会带来生态系统风险,而且对动物和人体健康产生一定的剂量毒性效应(孔繁翔等,2000;Jiri et al.,2005)。美国关于铝的急性毒性国家环境水质标准为 Al 750 μg·L-1,旨在保护所有的水生物种(除5%短时间接触铝的水生物种)(United States Environmental Protection Agency,1988)。限制铝浓度的慢性毒性值为Al 87 μg·L-1,旨在防止铝长期暴露时的毒害(United States Environmental Protection Agency,1985)。同时,一些学者也建议,明矾剂量应使溶解铝浓度保持在 50 μg·L-1以下(Robert et al.,1999)。可以说铝污染是一个伴随着人类工业文明的进展而逐步受到关注的问题。
目前关于铝盐对淡水藻类、水生无脊椎动物、鱼类毒害研究较多,但局限在实验室模拟研究(Michelena et al.,2016),关于植物铝毒的研究主要集中在陆生植物上,尤其是农作物,而对沉水植物的影响研究鲜有报道。
2.1 对藻类的毒性效应
水生生物因其所处环境特殊,铝毒的程度完全依赖于地表水体中活性铝的浓度。对淡水藻类的研究(Gensemer et al.,1999;Golding et al.,2015)表明,铝作用会引起浮游藻类和底栖藻类群落结构组成显著变化,鼓藻(Cosmarium)和硅藻(Bacillariophyta)对铝敏感,而金藻(Chrysophyta)和一些绿藻(Chlorophyta)对铝相对耐受。关于浮游植物对南海铝富集的响应研究表明,单独添加铝能促进硅藻和束毛藻属(Trichodesmium)的生长和固氮作用,但抑制腰鞭毛虫(Dinoflagellates)和聚球菌属(Synechococcus)的生长。然而,单独添加铝对整个浮游植物群落的叶绿素 a浓度没有影响(Zhou et al.,2018)。浮游植物对铝富集的反应机制可能与环境中共存的营养物质有关,特别是有限的营养物质,主要原因为铝可能通过抑制酸性磷酸酶活性而降低藻类对磷的吸收速率,也可能通过Al-P结合物将P元素沉淀至沉积物中而降低磷营养可利用性(Gensemer,1991)。此外,铝也影响硅藻对SiO2的吸收和利用。
在近中性湖泊中明矾处理控制藻化可以致使磷供应和藻类生长长期降低,尤其是在具有良好分层的碱性湖泊中。而铝在偏酸条件下(pH 6.0左右)对藻类毒性最强,尽管聚合铝形态在pH 6.0时可能也具有一定的毒性,Al3+或无机单体铝是对藻类毒性最大的铝形态,Ca2+和H+可能通过在藻类体表竞争阳离子结合位点削减其受铝毒(Gensemer et al.,1995)。在pH 6时,水体硬度增加可以减弱铝毒对月牙藻(Pseudokir-chneriella subcapitata)的毒性强度,而pH 8时,硬度增加可能增强月牙藻对铝的敏感性(Robert et al.,2018)。此外,Al2(SO4)3絮凝剂可以均匀地单层分布吸附在小球藻表面,吸附絮凝剂后,微藻对 Al2(SO4)3的静电排斥作用降低,絮凝收获微藻的效率达到60%-80%(Wen et al.,2018)。
2.2 对鱼类的毒性效应
铝对成鱼是一种鳃毒性物质,可引起离子调节和呼吸紊乱。铝的离子调节作用在低pH值时占优势,通常被认为与H+单独的毒性机制相同。而铝对鱼类呼吸作用的影响在中酸性水中占主导,其影响机制是铝的沉淀或聚合,因为酸性、富铝的水经过鱼鳃会积累到最基本的鳃微环境。鱼可以适应铝,但需要消耗代谢能力(Robert et al.,1999)。
有学者(Sutela et al.,2017)发现,在芬兰的沃林乔基,最低平均pH值为4.55时,最高平均铝浓度为7.4 mg·L-1,几乎没有鱼,在pH值<5的河流中,59%的监测位点未检测到鱼的出现。室内研究中,罗非鱼(Oreochromis mossambicus)暴露在亚致死浓度(120、150和 180 mg·L-1)Al2O3纳米粒子下96 h,对照组鱼器官未见组织学异常,而处理组鱼的脑、鳃、肠、肾和肌肉组织有严重损伤和广泛的结构丢失,尤其在 180 mg·L-1时效果明显(Murali et al.,2018)。此外,铝对鱼肝脏酶活性也产生影响,在不同pH(7,5)和不同浓度铝(0,0.8 μg·L-1)混合溶液中培养鲤鱼(Cyprinus carpio)幼鱼 1、3、9 d,发现暴露 3、9 d后,鲤鱼肝脏Na+/K+-ATP酶和Ca2+-ATP酶活性明显下降,而且血液学指标失调,红细胞增加,白细胞减少(Sun et al.,2018)。Miri et al.(2017)研究也表明铝的出现干扰鲤鱼鱼鳃、肝脏和肌肉中天冬氨酸转氨酶、丙氨酸转氨酶和碱性磷酸酶的转氨作用和代谢过程。Ramirez-Duarte et al.(2017)在软水中pH5.3的条件下,将日本青鳉(Oryzias latipes)仔鱼暴露于不同浓度的溶解铝4 d,6.2和16.7 pg·L-1铝使全机体组织匀浆中谷胱甘肽过氧化物酶活性显著降低,16.7 pg·L-1铝使谷胱甘肽还原酶活性显著降低;虽然过氧化氢酶活性和谷胱甘肽浓度整体下降,但与对照组相比差异不显著。此外,Chen et al.(2017)发现AlCl3暴露可能导致斑马鱼(Barchydanio rerio)胚胎发育障碍以及幼鱼神经行为异常。
早期文献(Freeman,1978)报道,在pH 8-9偏碱的水中,铝酸根离子>0.5 mg·L-1时可使鲑鱼(Oncorhynchus keta)致死;沉淀的Al(OH)3不会使鲑鱼急性中毒,却能引起慢性中毒。铝对鲑鱼鱼苗的毒性可能主要来自铝的无机态化合物,用柠檬酸与铝盐反应能大大地降低铝的毒性(Driscoll et al.,1980)。在硬水中当铝的有效浓度为2 mg·L-1以上时,就产生絮凝作用,由于铝盐絮凝沉淀作用,仔鱼在高铝浓度(16 mg·L-1)中4日以上也未出现死亡。因此,铝的毒性除与其浓度和价态有关外,还高度取决于水的 pH值与硬度(Ca2+含量)(张凯松等,2003;石慧,2016;Gensemer et al.,2018)。在酸性土壤中,Ca2+、Mg2+和Al3+会交换H+,土壤溶液中更多Al3+、H+溶出随径流或土壤间隙水进入湖泊河流,使水中的Al3+与H+高度正相关,并且可能达到对水生生物的毒性水平(>0.2 mg·L-1。Evans et al.,1981)。草鱼仔鱼在pH 5.0的软水中铝致死阈浓度为0.1 mg·L-1,96 h的半致死浓度LC50为0.26 mg·L-1(李威等,2007)。
2.3 对植物的毒性效应
目前关于铝盐对植物的毒性影响研究主要集中于陆生植物,尤其是农作物,比如玉米、小麦、高粱、水稻、大豆等(Poschenrieder et al.,2008;Maron et al.,2010;Delhaize et al.,2012;Tovkach et al.,2013;李婷等,2017;Chen et al.,2018),而对水生植物的铝毒影响研究还很缺乏,尤其是对沉水植物的毒性研究。已有研究表明铝毒首要毒害目标为植物的根系(Robert et al.,1999;Chen et al.,2018),铝毒抑制其根尖细胞的分裂和发育伸长,使得根端组织变得粗短和扭曲;影响植物对营养盐及水分的吸收(Liu et al.,2014a);而且抑制代谢过程中关键酶的活性(刘鹏等,2004),对细胞结构造成伤害等(Poschenrieder et al.,2008),进而使植物抵御外来侵害的功能变得十分脆弱。另外,铝盐对植物有直接毒害作用,也存在钝化磷从而降低植物可利用性磷供给的影响,土壤中的铝被活化而成为溶解态进入土壤溶液,与磷酸盐结合生成AlPO4,土壤中的磷被固定而不易被植物吸收,使植物缺磷而影响生长。
姬娅婵等(2013)研究不同浓度铝盐对苦草(Vallisneria natans)生长的影响,表明高剂量使用铝盐(45 mg·L-1)显著抑制苦草生长速率,其块茎和分株数小于低剂量组(15 mg·L-1)。有研究表明高于 700 μg·L-1的铝盐浓度对五刺金鱼藻(Ceratophyllum oryzetorum)的生长产生明显损害,其叶绿素含量显著降低,SOD活性、POD活性、可溶性蛋白及MDA含量变化表现出受胁迫特征,且导致刚毛藻体的死亡(张玥等,2016a)。菹草(Potamogeton crispus)可能对铝盐具有较高的耐受性,(350±50)-(1100±150) μg·L-1Al剂量组的明矾溶液对菹草叶绿素、可溶性蛋白含量、POD活性、游离脯氨酸含量无显著影响,不同处理浓度的铝盐投加对菹草的生长没有造成明显损害(张玥等,2016b)。Lin et al.(2017a)研究表明水体残余铝盐显著抑制苦草和黑藻(Hydrilla verticillata)生长形态学发展,其生理指标叶绿素、蛋白含量和丙二醛含量变化也显示受铝盐的胁迫。长期≥1.2 mg·L-1的 Al显著抑制菹草石芽的萌发且影响其幼苗的生长,叶绿素含量和根系活力随着铝盐浓度升高而降低(Lin et al.,2017b)。
在器官、组织和细胞水平上铝对植物均产生毒性作用(Liu et al.,2014b),降低农作物产量(Poschenrieder et al.,2008;Ribeiro et al.,2013)。前期研究表明铝对植物的毒性效应主要体现在以下几个方面(表1)。
植物遭受铝毒后,不仅在形态上和细胞学上变化明显,而且在生理生化方面的影响也很显著。铝可以与植物细胞中的蛋白质、脂质、糖类结合,还能与有机酸、三磷酸腺苷及脱氧核糖核酸等主要的生长分子发生螯合,严重干扰植物细胞内离子的正常代谢,引起代谢紊乱,影响各种生理生化过程的正常进行,出现细胞、组织伤害的综合症状,从而抑制植物的生长(王志颖等,2010)。体现如表2。
2.4 对人体的毒性效应
一定浓度范围下铝对人体可能是有益的,可以抵抗铅的毒害作用,氢氧化铝曾用来治疗胃肠疾病(崔蕴霞等,1998)。WHO和粮农组织1989年确定铝为食品污染物并进行了管理, 指出人体摄入铝的含量为 0.7 mg·kg-1。正常人体总含铝量是 50-100 mg,人体允许每日铝摄入量不能超过 0.7 mg·kg-1(贺婷婷,2013),进入胃肠道的铝吸收率为0.1%,10%左右随粪便排出体外,剩余铝经肠道吸收进入人体后,很难再从体内排出,且分布于体内各器官,肝、胃、脾、脑和甲状腺是积蓄较多的器官,如果积累过多会造成早衰和老年痴呆症(郑倩,2017)。在细胞培养中发现,铝可使细胞形态发生变化,铝一旦进入细胞,可以与某些蛋白质结合,与酶、核酸、三磷酸腺苷等重要的物质相互作用,干扰体内的多种生化反应,影响某些器官和细胞的物质代谢,导致其功能障碍(Ramirez-duarte et al.,2017)。
许多研究表明,临床上铝中毒表现主要有三大症状:铝性脑病、铝性骨病和铝贫血等(Namiesnik et al.,2010)。铝过量会造成骨质疏松软化、骨骼及肌肉变形、肾功能失调,甚至引起阿尔茨海默症、唐氏综合症等症状(杜鹏,2018;World Health Organization,2017)。铝抑制胆碱乙酰转移酶活性和合成,提高胆碱酯酶活性,破坏胆碱能神经元和影响钙离子释放等使得学习记忆功能减退。此外,铝影响细胞形态、神经递质及有关酶类在内的神经活动的多个环节,造成脑组织氧化损伤,促进脂质过氧化或还原型辅I氧化,导致超氧阴离子等活性氧的产生,对细胞造成损害(孙中蕾等,2013)。铝对神经细胞凋亡、Tau蛋白异常、神经细胞钙离子系统平衡等也有影响(夏佳蕊等,2018)。铝抑制Ca2+吸收,使甲状旁腺激素下降,影响骨钙吸收;与胶原蛋白结合沉积于骨,抑制成骨细胞与破骨细胞增殖;还可干扰骨磷酸酶产生及骨内钙磷结晶的形成(孙中蕾等,2013)。进入机体的铝能够快速在肝脏蓄积并且抑制肝脏的正常机能,低剂量的铝毒将导致肝胆部分炎症等机能障碍。此外,铝对生殖系统、免疫器官、细胞免疫、体液免疫、细胞因子等免疫系统均有不同程度的毒性(孙浩,2011;刘福堂等,2007)。
由于过去对铝毒无认识,许多国家对饮用水中铝含量没有限制要求。近 30年来,铝的毒性被发现并引起重视,一些国家先后制订了饮用水铝含量限制标准,但标准间差别较大,如前苏联对铝的限值为 0.5 mg·L-1,美国环保局为 0.05 mg·L-1(United States Environmental Protection Agency,2009),世界卫生组织为0.2 mg·L-1,中国新制定的饮用水铝浓度限值为0.2 mg·L-1(国家卫生部,2006)。世界卫生组织指出铝的最高摄入量,每人每周每千克体重不超过2 mg,相当于一名60 kg的成年人每周摄取铝含量不得高于 120 mg(World Health Organization,2010)。铝危害问题已引起社会广泛关注,美国国家标准协会将用于食品添加剂和水处理剂的铝化合物列入剧毒物品,但中国关于铝对人体毒性问题的研究,尚未作出明确的定论,控制食品及饮用水中铝含量应是改善中国铝摄入状况的有效途径之一。
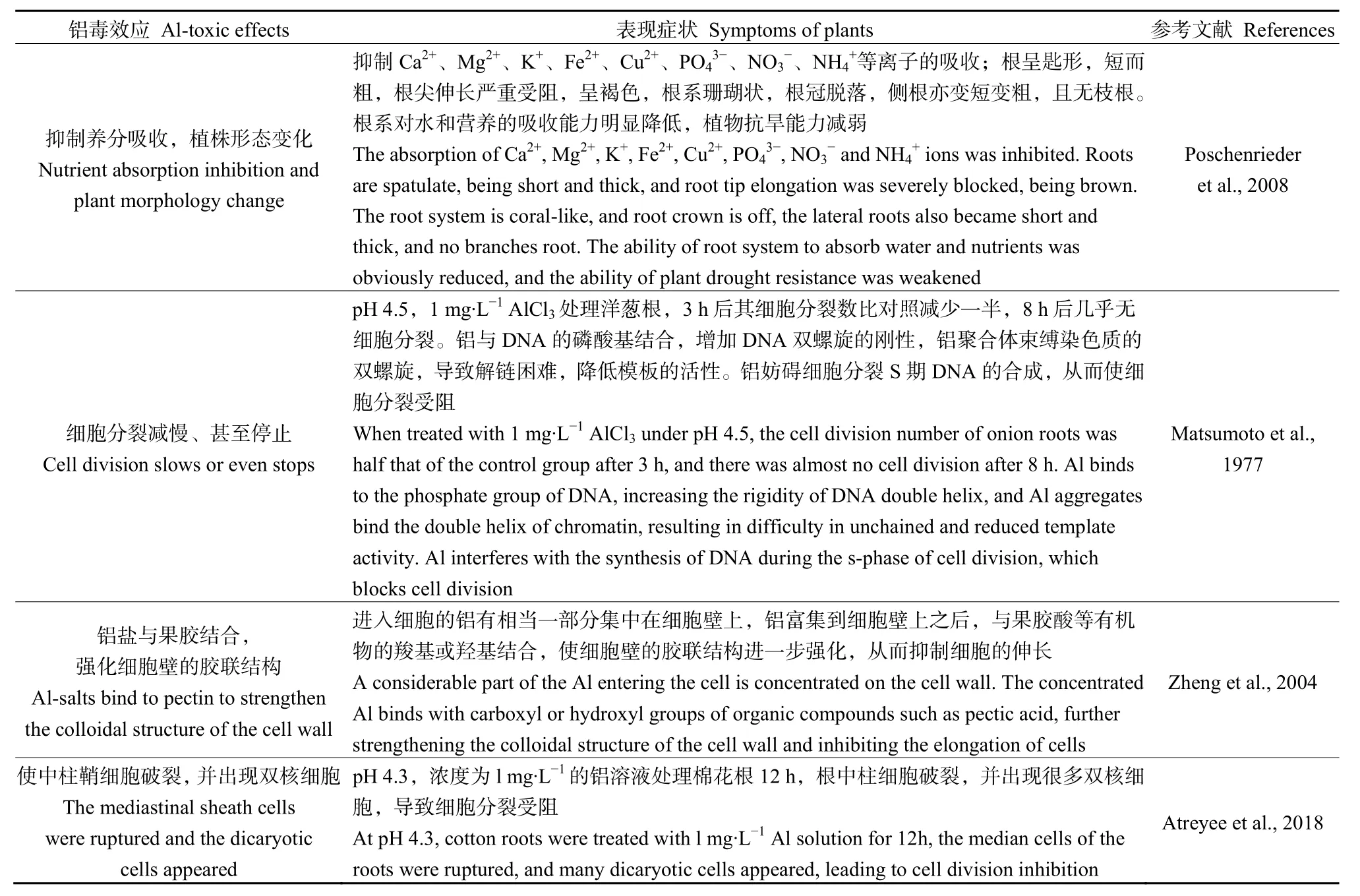
表1 铝对植物的毒性效应及症状Table 1 Toxic effects and symptoms of aluminum on plants
3 影响铝盐迁移转化及毒性的因素
大量不同形态的铝通过不同的时空方式分散进入到水生态系统中,由于富集和反应导致毒害,铝毒对饮水安全的影响受到越来越多的关注。已有研究表明,诸多外在的化学因子影响铝的迁移转化及其毒性,主要的有 pH、温度、阳/阴离子、磷结合物、有机酸种类及浓度、水体硬度、流速等(Robert et al.,1999;Namiesnik et al.,2010;Sun et al.,2018)。铝盐进入水体后会发生一系列的化学反应和物理转化迁移,诸如水解作用、螯合作用、絮凝和沉淀等(Kasper et al.,2005),因此铝的形态对其迁移转化非常重要,溶解性单体铝包括自由含水离子、氢氧化铝、硫酸盐、氟化物和小分子质量的HA和富里酸结合物。

表2 铝对植物生理生化特征的影响Table 2 Effects of aluminum on plant physiological and biochemical characteristics

图2 模拟研究水体pH 4-10变化下铝形态转化(Robert et al.,1999)Fig. 2 Aluminum speciation from simulation experiment under water pH varying 4-10 (Robert et al., 1999)
3.1 pH和阴阳离子
在铝盐水解反应中,会生成多种小分子的铝复合物,它们彼此间存在平衡:Al3+lOHAl2(OAl3(OAl8(OAl13O4(OH)Al(OH)3(Burgess,1992),这些平衡,即铝的溶解性和形态形式受pH直接控制,因此极少量的溶解铝也会因pH作用而改变(图2)。因pH与H+浓度相关,因此自由Al3+与H+活性之间存在显著相关性。铝的毒性主要表现为活性铝的毒性,由于铝是两性元素,因此,水中残留活性铝的量与 pH值和投加量密切相关。水体pH越低,溶解态的铝浓度越高,其毒性也越强(Stodart et al.,2007),铝毒在pH 5.5-6.0最强,在pH 7.0最弱。但是铝毒的受体不同,其对铝毒性的耐受力也强弱不一,此外实验条件下不同培养基和生长条件对铝毒也存在影响。
与 H+保护自由 Al3+活性相似,其他阳离子(Ca2+、Na+、Mg2+、K+)也保护铝毒对高等植物和耐酸藻类的毒害(Guo et al.,2007;Sun et al.,2018),相反,铝也干扰Ca2+的吸收和代谢。除了H+和其他阳离子外,溶解性阴离子也会通过改变 Al的形态形成而影响其毒性,包括氟化物、硫酸盐、磷酸盐、硝酸盐和硅酸盐等,这些结合物的形成会降低Al3+活性从而降低其毒性。
3.2 有机物种类及浓度
水体、湖泊底泥、土壤等都含有腐殖质,该物质带有羧基、酚基、酮基、氨基等活性基团,在环境重金属的迁移中具有重要作用(Niu et al.,2018)。其中的HA是金属离子和微量元素的络合剂,水体中的HA类物质还是卤化副产品的重要前驱物。此外,水体酸化引起腐殖质特性改变,从而对环境造成影响。铝可与包括合成的和自然的溶解性有机物(DOM)(HA和富里酸)形成或弱或强的结合物,使溶解态铝处于固化状态降低Al3+活性,而由于影响生物膜的可利用性无机铝含量下降其对生物的毒性也减弱(Robert et al.,1999;Niu et al.,2018)。
DOM 可通过降低溶液中对鱼鳃产生毒性作用的铝含量来防止铝的生理和毒理学效应。DOM 浓度越高,越多的 Al会结合到有机物,其去铝毒能力与OH/COOH基团在主链上的相对位置及它们与铝形成稳定环形结构的能力直接相关(Provenzano et al.,2004;Tamer et al.,2015)。HA不仅在自然水体中的金属形态形成方面发挥重要作用(Chang et al.,2004),而且HA能够阻挡Al3+对营养吸收的毒性影响,从而中和Al3+对植物主根和侧根生长的毒害(Schindler et al.,1992;Tamer et al.,2015)。
3.3 磷结合物
铝盐水解作用形成Al(OH)3絮状物沉淀到湖泊底质,或铝盐结合磷营养使其钝化降低植物和藻类可利用性P的供给,其絮状物覆盖在沉积物表层亦可阻止沉积物下层氮磷营养盐的释放(Agarwal et al.,2016)。磷被结合以磷酸铝盐形式沉淀是致使磷低可利用性和磷去除的主要机制(Cooke et al.,2005;Nogaro et al.,2013;Rott et al.,2017),水体中存在两种溶解性无机单体 Al-P形态(AlH2和 AlH)和一种不溶的 AlPO4(Namiesnik et al.,2010;Rott et al.,2017)。
3.4 其他因子
温度影响铝形态的变化和铝的溶解性。Lydersen(1990)研究表明温度降低15 ℃对铝形态的变化影响相当于 pH值降低 1个单位的影响。Poleo et al.(1991)也发现 270-400 μg·L-1的铝溶液对大西洋鲑鱼仔鱼的毒性随温度升高(1-19 ℃,pH 5.0)而升高。流速和人为干扰影响铝盐在水体中的迁移,从而影响其空间分布,铝盐毒性因浓度不同而产生差异。当然,铝并不是水体中唯一的潜在有毒金属,其他金属的存在对铝毒可能具有增强或降低作用,或具有协同作用(Grippo et al.,1996)。
4 结论与展望
自然条件下,铝主要以金属铝、氧化铝、铝盐化合物、含铝矿石等形态存在于陆地生态系统;水生生态系统中,铝主要以无机单体铝(Al3+,AlOH2+,Al(O,Al(O)、无定型絮状物 Al(OH)3和聚合铝(如 Al13O4(OH)24(H2)等形态存在。随着经济和社会的发展,人为原因加快了铝进入生态系统的速度,也加剧了铝对生命组分的毒害作用与危害。铝通过抑制酸性磷酸酶活性或影响营养物质的利用对藻类群落结构组成和藻细胞产生影响。铝是鳃毒性物质,引起离子调节和呼吸紊乱,对鱼类器官组织、生长发育和生理代谢具有剂量毒性作用。而且铝在人体蓄积后对神经、骨骼、肝脏、免疫等产生不同程度的损害。植物铝毒机制主要包括:(1)对根系细胞分裂及伸长的抑制;(2)对植物营养物质吸收的抑制;(3)对植物体内关键酶代谢的抑制;(4)对遗传物质及细胞结构的损伤等。不同形态的残留铝具有不同的毒性效应,尤其以溶解性单体铝毒性最强。影响铝毒的因子主要包括pH、Al3+形态及浓度、环境温度、水体硬度、腐殖酸/有机酸含量,结合配体浓度等。
铝的优越特性赋予其广泛的用途,但其作用和毒性效应与其形态、浓度及环境条件有密切关系,铝制品在使用中存在的潜在环境问题倍受人们关注(李威等,2007;World Health Organization,2017),因此,在人类生产生活中应合理科学使用铝制品,严格把控饮用水及食品中铝浓度标准。综观铝盐絮凝剂的发展过程,高分子、复合性铝盐絮凝剂比低分子、单一型的用量小、残留量低(刘睿等,2005;张亚文等,2009),聚合型的铝较单体铝和离子态的铝毒性弱,所以工业水处理中应加快研发应用高效环保的大分子聚合/微生物絮凝剂,控制水处理厂出水中残余铝浓度。
由于环境酸化越来越严重,且水环境中铝越来越多,因此,研究生态系统中铝的含量对环境的影响、产生的危害等有极其重要的实际意义,对湖泊生态系统中铝含量分布和生态风险进行调研和评估,是目前水环境保护和治理的紧迫和必要任务之一。且由于铝为两性元素,建议进一步研究铝盐在碱性环境中的毒性作用以及铝盐对水生植物、底栖动物等的毒性作用。
