DKI定量参数对卵巢良恶性肿瘤的鉴别价值及其与Ki-67的相关性研究
2019-11-02王丽芳宋晓丽牛金亮任红红
王丽芳,宋晓丽,牛金亮*,任红红
卵巢肿瘤是女性生殖系统的常见肿瘤,良恶性肿瘤的定性诊断对治疗方案的选择及预后评价有重要意义[1]。血清肿瘤标志物诊断敏感性、特异性低[2],近年来,超声、MRI是卵巢肿瘤诊断常用的方法,然而部分囊实性肿瘤定性诊断困难[3-4]。功能MRI为卵巢肿瘤诊断提供了新的思路。扩散加权成像(diffusion weighted imaging,DWI)的定量参数表观扩散系数(apparent diffusion coefficient,ADC)值已应用于卵巢肿瘤良恶性的诊断[5],传统的DWI模型认为组织水分子是均一向四周扩散,其b值的增加与信号衰减呈线性关系,然而人体组织水分子扩散受细胞膜、细胞器、细胞间隙等的限制,其扩散为非高斯分布。扩散峰度成像(diffusion kurtosis imaging,DKI)采用非高斯分布的水分子扩散模型,分析组织微结构的变化,其参数能更准确地评估肿瘤组织的微观结构[6-9]。Ki-67是肿瘤研究中的重要指标,用于评价肿瘤增殖活性,是分析卵巢肿瘤生物学特性的常用方法[10]。本研究分析平均扩散峰度(mean kurtosis,MK)值、平均扩散系数(mean diffusivity,MD)值、各向异性分数(fractional anisotropy,FA)值及ADC值在鉴别卵巢肿瘤良恶性的应用价值,并探讨各参数值与Ki-67表达的相关性。
1 材料与方法
1.1 临床资料
收集2017年9月至2018年12月在我院发现卵巢肿瘤且拟于我院行手术治疗的患者资料。纳入标准:(1)本院超声及MRI发现有卵巢肿瘤的患者;(2)术前未接受手术、放化疗的患者;(3)签署知情同意书,并配合完成完整MRI检查的患者;(4)MRI检查后行手术治疗并获得病理结果的患者。排除标准:(1)MRI图像质量较差或无法配合完成完整MRI检查的患者;(2)病灶内无实性成分,或实性成分最大径<1.0 cm的患者。最终符合上述标准患者48例。良性肿瘤23例,年龄25~77岁,平均48岁;恶性肿瘤25例,年龄22~79 岁,平均53岁。共55个病灶,其中良性肿瘤(25个)包括卵泡膜纤维瘤13例、成熟畸胎瘤4例、浆液性乳头状囊腺瘤5例(2例为双侧)、良性brenner瘤1例。恶性肿瘤(30个)包括高级别浆黏液性癌16例(3例双侧)、透明细胞癌2例、卵巢高/中分化宫内膜样癌2例(1例双侧)、无性细胞瘤1例、恶性混合性生殖细胞瘤1例、转移癌3例(1例为双侧)。
1.2 图像采集与处理
MR扫描方法:使用3.0 T扫描仪(GE Discovery Silent MR750W,美国GE公司)相控阵腹部线圈进行扫描。患者采取平卧位,自由呼吸。行常规MRI扫描(轴位、矢状位、冠状位T2WI序列,轴位T2WI脂肪抑制序列、T1WI序列);FOV 32×32;层厚5 mm;层间距1 mm。DWI、DKI扫描均采用EPI序列,DWI序列扫描序列:TR/TE:5000/65 ms;层厚5 mm;层间距1 mm;FOV 32×32;矩阵128×128;激励次数(NEX)1;b值分别为0、1500 s/mm2;研究参数:ADC值。DKI序列:TR/TE:6500/95 ms;层厚5 mm;层间距1 mm;FOV 24×24;矩阵128×128;NEX 2;扩散方向25;b值分别为0、1250、2500 s/mm2;扫描时间为11 min 11 s;研究参数:MK值、MD值及FA值。
1.3 图像分析
将DKI和DWI图像分别导入AW4.6后处理工作站(美国GE公司),生成ADC、MD、MK、FA伪彩图。由2名有经验的放射科医生共同观察和分析,勾画感兴趣区(region of interest, ROI)。ROI勾画原则:(1)T2WI脂肪抑制序列上显示为等低信号的实性层面;(2)避开明显囊变、出血、坏死及血管;(3)结合T2WI选取肿瘤最大实性层面画ROI,保持各参数图的ROI在同一层面;(4) ROI形状为圆形或椭圆形,面积10~130 mm2;(5)数据均测量3次取平均值。
1.4 免疫组化链霉菌抗生物素蛋白-过氧化物酶染色(streptavidin-perosidase,SP)法检测卵巢肿瘤组织Ki-67的表达
所有标本经石蜡包埋、切片及免疫组化染色,并在显微镜下观察,以细胞核染成棕黄色或者褐色为阳性细胞,每份切片选取3个高倍视野(SP×200)并记录阳性的肿瘤细胞百分数(%),求平均值。诊断结果均由对患者临床病理结果不知情的病理科医师(10年妇科病理工作经验)分析。

图1 A~F:女,58岁。A为轴位T2WI图像,病灶内部信号不均匀,实性成分呈等低信号;B~E分别为ADC、FA、MD及MK伪彩图,ADC=0.926×10-3 mm2/s,FA=1.31,MD=1.01×10-3 mm2/s,MK=0.893;F:Ki-67抗原在卵巢癌细胞核中明显表达(SP×200),病理:卵巢高级别浆液性癌。G~L:女,54岁。G为轴位T2WI图像,病灶内部实性成分呈不均匀等低信号;H~K分别为ADC、FA、MD及MK伪彩图,ADC=1.123×10-3 mm2/s,FA=1.42,MD=1.851×10-3 mm2/s,MK=0.494;L为Ki-67抗原在肿瘤组织细胞核中低表达(SP×200),病理:卵巢卵泡膜纤维瘤Fig. 1 A—F: Female, 58 years old. A: The axial T2WI image, the internal signal of the lesion is not uniform, and the solid component is lower signal; B—E: The maps of ADC, FA, MD and MK, respectively, ADC=0.926×10-3 mm2/s, FA=1.31, MD=1.01×10-3 mm2/s, MK=0.973; F: The apparent expression of Ki-67 antigen in the nucleus of ovarian cancer cells (SP×200), Pathology: Ovarian high-grade serous carcinoma. G—L: Female, 54 years old. G: The axial T2WI image, the internal solid component of the lesion is low signal; H—K: The maps of ADC, FA, MD, and MK, respectively, ADC=1.123×10-3 mm2/s, FA=1.42, MD=1.951×10-3 mm2/s, MK=0.534; L: The low expression of Ki-67 antigen in the nucleus of tumor tissues (SP×200), Pathology: Ovarian theca-fibroma.
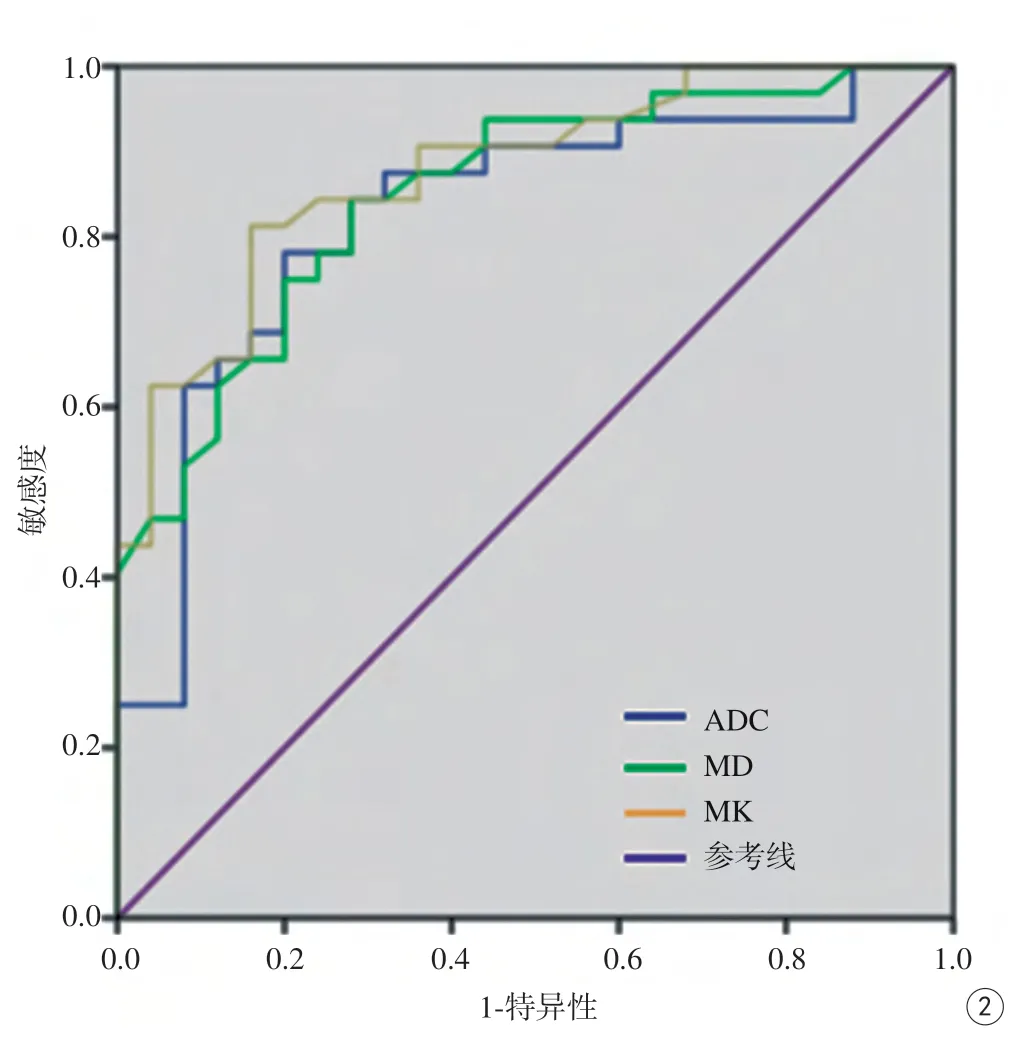
图2 DKI及DWI参数诊断卵巢良恶性肿瘤的ROC曲线图。MK值、MD值的AUC分别为0.88、0.85,ADC值的AUC为0.83Fig. 2 The ROC curve of DKI and DWI parameters for the diagnosis of benign and malignant ovarian tumors. The AUC of the MK value and the MD value are 0.88 and 0.85, respectively, and the AUC of ADC value is 0.83.
1.5 统计学分析
采用SPSS 22.0统计软件进行分析,计量资料以均数±标准差(±s)表示,采用独立样本t检验比较参数MK值、MD值、FA值、ADC值在良恶性肿瘤中的差异。通过受试者工作特征(receiver operating characteristic,ROC)曲线来确定各参数诊断效能,以曲线下面积(area under curve,AUC)表示。并根据最大约登指数确定诊断敏感性、特异性及最佳阈值。通过Spearman相关分析MK值、MD值、FA值、ADC值与Ki-67表达的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 卵巢良恶性肿瘤各参数比较
恶性肿瘤组的MK值高于良性肿瘤组(0.82±0.13 vs 0.62±0.11),MD值及ADC值明显低于良性肿瘤组[(1.1±0.29)×10-3mm2/s vs (1.54±0.34)×10-3mm2/s和(1.0±0.15)×10-3mm2/s vs (1.23±0.19×)10-3mm2/s],差异均有统计学意义(t=-6.156、5.285、4.962,P<0.001)。FA值在良恶性肿瘤组间差异无统计学意义(t=0.808,P=0.422)。见表1,图1。
表1 55个病灶MK值、MD值、FA值和ADC值在卵巢良恶性肿瘤的比较(±s)Tab. 1 Comparison of MK, MD, FA and ADC values of 55 lesions in benign and malignant tumors of ovarian (±s)

表1 55个病灶MK值、MD值、FA值和ADC值在卵巢良恶性肿瘤的比较(±s)Tab. 1 Comparison of MK, MD, FA and ADC values of 55 lesions in benign and malignant tumors of ovarian (±s)
参数 良性(n=25) 恶性(n=30) t值 P值MK 0.62±0.11 0.82±0.13 -6.156 <0.001 MD (×10-3 mm2/s) 1.54±0.34 1.10±0.29 5.285 <0.001 FA 0.19±0.03 0.18±0.03 0.808 0.422 ADC (×10-3 mm2/s) 1.23±0.19 1.00±0.15 4.962 <0.001
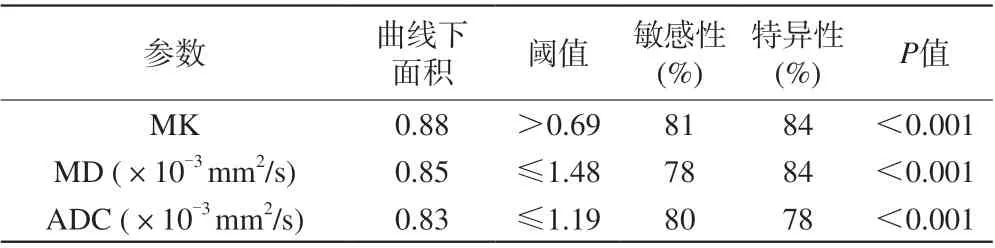
表2 DKI和DWI参数对卵巢良恶性肿瘤鉴别诊断分析Tab. 2 Analysis of differential diagnosis between benign and malignant ovarian tumors by parameters of DKI and DKI

表3 DKI、DWI各参数与Ki-67表达相关性分析Tab. 3 Correlation analysis between DKI/DWI parameters and Ki-67 expression
2.2 MK值、MD值、ADC值鉴别卵巢良恶性肿瘤的ROC曲线评价结果
MK值、MD值、ADC值鉴别卵巢良恶性肿瘤的AUC值分别为0.88、0.85、0.83。分别以0.69、1.48×10-3mm2/s、1.19×10-3mm2/s为诊断阈值时,敏感性分别为81%、78%、80%,特异性分别为84%、84%、78%。见表2,图2。
2.3 MK值、MD值、FA值、ADC值与Ki-67表达的相关性分析
MK值与Ki-67表达呈正相关(r=0.62,P<0.001),MD值(r=-0.55,P<0.001)、ADC值(r=-0.50,P<0.001)与Ki-67表达呈负相关(表3),差异均有统计学意义。FA值与Ki-67表达无相关性(r=-0.14,P=0.307)。
3 讨论
卵巢肿瘤是妇科常见病,良恶性的准确诊断直接影响患者治疗方案及预后[1]。目前,肿瘤血清标志物在临床诊断中应用广泛,但多种肿瘤可表达同一种肿瘤标志物,如CA125在正常卵巢组织、上皮来源肿瘤、乳腺癌、肺癌等均可表达,因此肿瘤标志物诊断特异性低[2]。目前超声是卵巢肿瘤诊断的常用方法,可以观察肿瘤形态、血流分布以及是否合并腹水等征象,然而对微小病灶检出困难,且对部分囊实性肿瘤定性诊断困难,如卵泡膜纤维瘤合并腹水(Meigs综合征)易误诊为恶性肿瘤[4]。MR软组织分辨率高,可以检出微小病灶,可全面分析肿瘤组织成分,但不能准确鉴别诊断低级别恶性肿瘤与部分良性肿瘤[3]。DKI与DWI是MRI功能成像技术,可反映组织微观结构信息。
3.1 DKI与DWI定量参数鉴别卵巢良恶性肿瘤的价值
ADC是DWI的主要参数,用于反映活体组织内水分子的扩散状态,通常认为恶性肿瘤的细胞密度高,水分子的扩散运动受限,DWI上高信号,ADC值低,ADC值已用于卵巢良恶性肿瘤的鉴别诊断[5,11]。本研究结果显示卵巢恶性肿瘤的ADC值明显低于良性肿瘤。鉴于DWI的理论局限性[12],Jenson等[6]提出了DKI模型,是以水分子扩散呈非高斯分布为理论基础,DKI可以获得MD值、FA值、MK值等参数,用于评估细胞异型性、细胞密度、肿瘤血管生成等组织微结构的特点。MD值是校准后的ADC值,与细胞外间隙容积分数有关,恶性肿瘤组织细胞外间隙明显减少、水分子扩散受限,MD值降低。乳腺癌与下肢骨、软组织恶性肿瘤MD值明显低于良性肿瘤[9,13],本研究中卵巢恶性肿瘤的MD值明显低于良性肿瘤,与文献报道一致。
MK值是DKI最主要的参数,反映水分子扩散受限程度及扩散的不均质性,组织结构越复杂(细胞密度及异型性越高,间质血管生成越多),MK值越大[6-17]。恶性肿瘤的MK值应明显高于良性肿瘤,高级别脑星形细胞瘤组MK值显著高于低级别组[15]。上皮来源交界性卵巢肿瘤组的MK值显著低于恶性肿瘤组[14]。本研究结果表明,卵巢恶性肿瘤组的MK值明显高于良性肿瘤组,与上述研究结果一致。
FA值是指水分子扩散各向异性分数,FA值主要用于中枢神经系统,正常神经纤维水分子沿长轴同向扩散,当神经纤维损伤时,水分子向四周扩散程度增加,各向异性减小[6,16]。FA值对肾透明细胞癌分级诊断无统计学意义[17]。本研究中,卵巢良恶性肿瘤FA值差异无统计学意义(P>0.05),说明良恶性卵巢肿瘤水分子向各方向扩散程度无明显差异,各向异性低。
本研究釆用ROC曲线评价MK值、MD值、ADC值鉴别卵巢良恶性肿瘤的效能。MK值的AUC为0.88,MD值与ADC值的AUC分别为0.85、0.83。MK值诊断效能最好,当MK诊断阈值取0.69时,敏感性、特异性最高,与乳腺肿瘤的研究结果一致[8,13],说明DKI参数值能准确反映卵巢肿瘤良、恶性的微结构的差异。另外,本研究发现恶性生殖细胞瘤MK值(1.08)大于大多数上皮来源恶性肿瘤,提示DKI在鉴别不同的卵巢肿瘤组织学分型方面可能有作用。
3.2 DKI与DWI定量参数与Ki-67表达的相关性
Ki-67表达水平高低与肿瘤恶性程度关系密切。即Ki-67表达水平越高,肿瘤细胞增殖越活跃,肿瘤细胞及新生血管的快速增生,导致肿瘤内部出现坏死、出血、囊变等,进一步增加了肿瘤组织微结构的复杂性[10-13]。乳腺恶性肿瘤研究表明MK值与Ki-67呈正相关,MD值、ADC值与Ki-67呈负相关[18]。本研究结果也发现MK值与Ki-67表达呈正相关,MD值、ADC值和Ki-67表达呈负相关。而FA值与Ki-67表达无明显相关性。因此,MK值及MD值可以从影像学角度反映肿瘤细胞的增殖程度。
3.3 本研究的局限性
首先,病变的数量较少,且种类较单一,主要为上皮、性索间质来源肿瘤,且部分良性肿瘤如囊腺瘤实性成分小,可能影响测量的准确性。下一步将收集更多卵巢肿瘤病例,分析各组织来源的肿瘤特点,研究DKI对卵巢肿瘤病理分型的价值。另外,因病例数过少,本研究中未将交界性卵巢肿瘤纳入研究,之后将继续增大病例数。
综上所述,本研究结果表明,DKI在卵巢肿瘤良恶性方面有更高的诊断效能,DKI参数MK值和MD值能无创性预测良、恶性卵巢肿瘤细胞增殖水平的差异。DKI有望成为评估卵巢肿瘤良恶性更有效的手段。
利益冲突:无。
