多聚赖氨酸对双亚基肌酸酶表面的修饰
2019-10-30高亚楠杨海麟
高亚楠,辛 瑜,张 玲,杨海麟,王 武
(江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
肌酸酶(creatinase;EC 3.5.3.3;CRE;分类名为肌酸眯基水解酶,creatinase amidinohydrolase)属于水解酶类,催化肌酸水解产生尿素和肌氨酸,是肌酐代谢中的关键酶。目前在多种细菌中均发现肌酸酶的存在,除了极少数来源的肌酸酶以单亚基的形式存在[1-2],大多数肌酸酶都是同源二聚体,即由两个相同的亚基组成[3-6],其中对Pseudomonas putida来源的肌酸酶研究最多[3,7-12],Yoshimoto等[3]人从Pseudomonas putida中纯化出肌酸酶,并首次获得酶结晶,该酶的特性研究表明,酶的相对分子质量为94 000,由2个相同的亚基组成,亚基相对分子质量为47 000。
血清和尿液中肌酐含量是诊断肾脏功能的重要指标,肌酸酶是酶法检测肌酐含量的关键酶[13]。但是由于肌酸酶的稳定性较差,造成酶活性损失严重,限制了其工业化生产和应用。已有通过添加稳定剂、分子改造和固定化等方法提高肌酸酶稳定性的报道,Schumann等[10]研究了恶臭假单胞菌肌酸酶的稳定剂,发现在酶溶液中添加DTE、BSA或甘油能改善酶的稳定性,而进一步用随机突变的方法对酶分子结构进行改造,得到了A109V、V355M、V182I、A109V+V355M 和 A109V+V355M+V182I 等5种突变体,稳定性均有所提高[11];Berberich等[12]用聚氨酯固定化修饰放线杆菌来源的肌酸酶,提高了酶的储存稳定性。
作者尝试通过化学修饰法改善双亚基肌酸酶的稳定性。多亚基酶失活的第一步通常是亚基解离,因此保护多亚基酶的首要目标是防止多亚基酶的解聚[14]。多聚赖氨酸是含有多个游离氨基的多聚物长链,可以与酶分子表面羧基相互作用形成稳定的共价键,环绕覆盖在酶表面,起到分子捆绑的作用,使酶的空间结构更加紧密,从而提高酶的稳定性。作者选取Pseudomonas putida来源的具有两个相同亚基的肌酸酶为研究对象,考察多聚赖氨酸对酶的修饰效果,该法对双亚基肌酸酶热稳定性提高具有一定的效果。
1 材料与方法
1.1 材料
3 500~4 500 的多聚赖氨酸(poly-lysine)、1-乙基-(3-二甲基氨基丙基)碳二亚胺(EDC):均购自Sigma;其他试剂均为国产分析纯或色谱纯试剂。重组E.coliBL21(DE3)/pET28a-CRE:由作者所在实验室构建。
1.2 肌酸酶基因的表达与酶的纯化
重组E.coliBL21(DE3)/pET28a-CRE 在 LB 培养基中于37℃培养过夜,种子液以体积分数5%转接于新的LB培养基中,于37℃、200 r/min培养至OD达到0.6~0.8,加入终浓度为1 mmol/L的IPTG,并把温度降至16℃,诱导培养16 h。8 000 r/min离心5 min收集菌体后,用pH 7.5、50 mmol/L的磷酸缓冲液重悬菌体,冰水浴超声破碎菌体,破壁后8 000 r/min离心10 min,上清液即为粗酶液。采用载体上的组氨酸标签,将粗酶液用镍柱进行亲和层析,获得纯酶液。
1.3 肌酸酶分子表面氨基酸分析
从PDB数据库查找Pseudomonas putida来源的肌酸酶的结构(PDB ID:1CHM),然后用Pymol软件对肌酸酶表面的酸碱性氨基酸的数目进行分析。
1.4 肌酸酶修饰正交试验
以肌酸酶表面羧基与poly-lysine氨基摩尔比(A)、CRE-COOH 与 EDC的摩尔比 (B)、 反应 pH(C)为考察因素。4℃缓慢转动混匀过夜,计算相对酶活力;将不同的摩尔比例获得的修饰酶超滤除去未结合的小分子修饰剂,置于37℃恒温水浴中,48 h后测定其酶活力,并计算其酶活力保留率。以相对酶活力与酶活保留率作为试验指标,利用正交表L9(34)设定三因素三水平正交试验,见表1。

表1 正交因素与水平Table 1 Factors and levels of orthogonal experiment
1.5 肌酸酶的活性测定
单位酶活定义:1 min内将肌酸水解产生1 μmol尿素所需要的酶量[15]。
试剂配制:0.1 mol/L肌酸溶液 (以50 mmol/L磷酸缓冲液,新鲜配制);对-二甲氨基苯甲醛溶液(溶2 g对-二甲氨基苯甲醛于100 mL二甲基亚砜中,然后加浓盐酸15 mL)。
测定方法:在试管中加入0.9 mL肌酸溶液,室温平衡5 min后加入0.1 mL待测酶液,在37℃反应10 min,然后向反应体系中加入2 mL对-二甲氨基苯甲醛溶液终止反应,并置于25℃温育20 min,在435 nm处测定吸光度值[16]。
1.6 SDS-PAGE凝胶电泳分析
用最优方案对肌酸酶进行肌酸酶的poly-lysine修饰,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对游离酶与修饰酶进行分析,推测poly-lysine对肌酸酶的修饰程度。
1.7 差示扫描量热分析(DSC)
利用TA的Nano DSC差示扫面量热仪研究游离肌酸酶及修饰酶的热稳定性。取一定量的游离酶和修饰酶,使用磷酸缓冲液为基线,温度扫描范围为20~90℃,升温速率为1℃/min。
1.8 动力学参数测定
用pH 7.5的50 mmol/L磷酸缓冲液配制浓度分别为10~100 mmol/L的肌酸溶液,于37℃反应10 min,测定游离酶和修饰酶在不同肌酸浓度时初始活力,得到反应速度V。根据Lineweaver-Burk双倒数作图法,以1/[S]为横坐标,1/V为纵坐标作图,分别计算酶游离酶与修饰酶的Km与kcat值。
1.9 稳定性分析
将游离酶溶液和修饰酶置于50 mmol/L磷酸缓冲溶液(pH 7.5)中,在不同的温度(25、30、35、40、45和 50℃)下放置30 min,测定游离酶和修饰酶酶活力,以酶活力最高值为100%计算相对活性,确定酶的热稳定性。
将游离酶溶液和固定化酶置于不同pH值的缓冲溶液(pH 4.0、5.0、6.0、7.0、8.0、9.0 和 10.0)中,25℃放置16 h,测定游离酶和修饰酶酶活力,以酶活力最高值为100%计算相对活性,确定酶的pH稳定性。
2 结果与讨论
2.1 肌酸酶分子表面酸性氨基酸分析
多聚赖氨酸的共价修饰取决于酶表面的酸性氨基酸的个数,根据肌酸酶的氨基酸序列及结构(PDB ID:1CHM) 分析,Pseudomonas putida来源肌酸酶含有108个酸性氨基酸,其中76个酸性氨基酸位于酶分子的表面,且侧链官能团暴露于酶表面,可以参与酶分子表面poly-lysine的修饰。
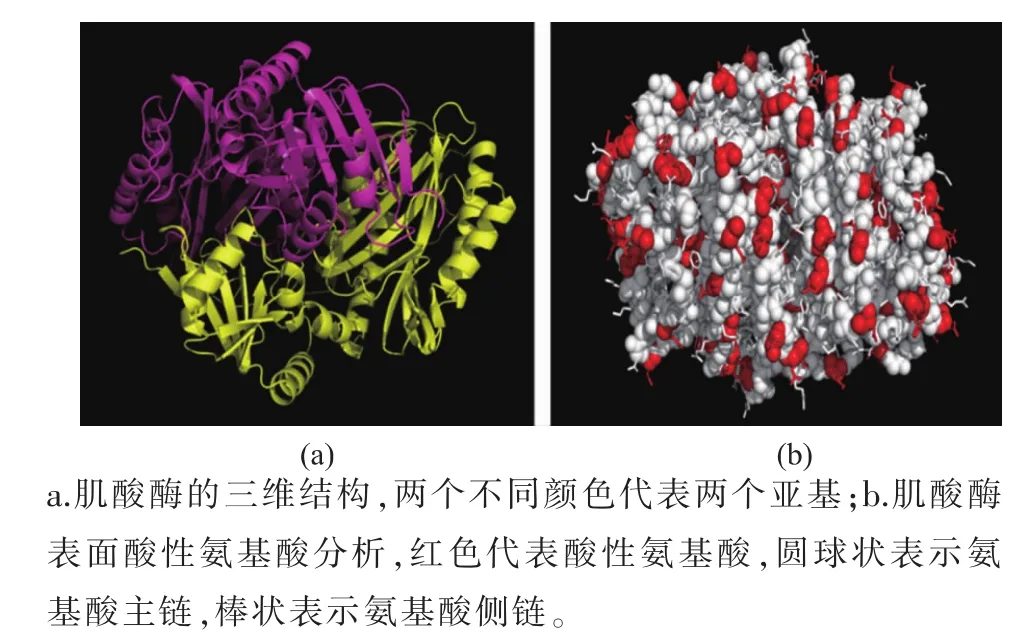
图1 肌酸酶结构分析Fig.1 Structure analysis of creatinase
多聚赖氨酸修饰肌酸酶酶分子的途径见图2。首先采用EDC活化肌酸酶分子表面羧基生成EDC-羧酸中间体,该中间体与poly-lysine中游离的氨基相互作用形成共价键[17]。poly-lysine在肌酸酶表面形成共价修饰,以增强肌酸酶的稳定性。

图2 poly-lysine表面修饰肌酸酶示意图Fig.2 Modification of creatinase with poly-lysine
由于交联类型不同,EDC活化肌酸酶后可以产生不同的交联结构。poly-lysine分别在单个亚基上形成共价修饰;poly-lysine覆盖跨越两个亚基,使两个亚基紧密结合在一起;酶分子间交联。EDC是一种异型双功能试剂,可能引起酶分子内或分子间的交联,也会引起poly-lysine分子间的交联[18]。
2.2 多聚赖氨酸修饰肌酸酶的条件优化
化学修饰反应过程中,酶与修饰剂的比例、活化反应、修饰反应的pH等均会影响修饰程度和修饰酶的性质。正交试验中有两个考察指标,它们是修饰酶的相对酶活力和修饰酶在37℃放置48 h后的酶活力保留率。根据综合平衡法,先分别考察每个因素对各指标的影响,然后进行分析比较,确定出最好的水平。
修饰剂用量会影响酶的修饰率和修饰酶的性质。修饰剂用量越大,酶分子的修饰程度也越高。另一方面,酶表面偶联的大分子修饰剂会产生空间位阻效应,使底物不易与酶活性中心相互作用而使酶活性下降[19]。从表2可知,对两个指标来说,修饰剂用量是较次要的因素,对相对酶活力来讲,取A2水平为最好,A3水平也不差,对酶活力保留率来讲,取A3水平为最好,综合考虑修饰剂用量取A3为最好,即CRE-COOH与poly-lysine-NH2的摩尔比为1∶100。

表2 正交试验结果Table 2 Orthogonal test results
EDC可以与肌酸酶分子表面的羧基反应生成具有氨基反应活性的中间体,该中间体可以迅速与多聚赖氨酸中的游离氨基反应形成稳定的交联产物,但该中间体在水溶液中是不稳定的,若不能及时与氨基反应,则会分解为原来的羧基[20]。对于酶表面羧基与EDC摩尔比,从相对酶活力来看,其影响力最小,取B1水平为最好,推测是由于高浓度的EDC会造成其在肌酸酶分子内部堆积,抑制酶活性位点与底物的结合,造成酶活力下降。从酶活力保留率来看,其极差最大,表明其对修饰酶的性质影响最大,取B3水平为最好。综合EDC用量取B3水平为最好,即CRE-COOH与EDC的摩尔比为1∶10。
pH决定了酶蛋白中反应基团的解离状态,设置不同的pH值,可以控制基团的解离程度,从而有利于修饰的专一性。pH值过低会造成酶活性损失,若pH值过高,在酶分子修饰过程中,不利于EDC活化肌酸酶表面的羧基,并且形成的中间体易发生水解反应[21]。对两个指标综合考虑,pH值取C2为最好,即最适反应pH为7.0。
综合分析优化条件,CRE-COOH:poly-lysine-NH2取 1∶100,CRE-COOH:EDC 取 1∶10,pH 为 7.0。
2.3 修饰酶的SDS-PAGE鉴定
用十二烷基硫酸钠(SDS)将蛋白质变性,在变性条件下,生物分子以变性的单体或亚基多肽-SDS复合体存在,单体或亚基多肽的分子质量差异造成了不同的迁移率。
如图3,游离肌酸酶在SDS-PAGE中表现出单一条带,单亚基相对分子质量为47 000,而修饰酶泳道出现多条带,相对分子质量最小的条带似乎略高于游离酶单亚基的位置,而高位条带的相对分子质量甚至出现倍乘的现象。说明肌酸酶表面的羧基不同程度的与poly-lysine共价结合,形成稳定的交联产物。

图3 肌酸酶修饰的SDS-PAGE分析Fig.3 SDS-PAGE analysis of creatinase modified
2.4 修饰酶与游离酶酶学性质的比较
经修饰后酶的比酶活、Km、kcat与kcat/Km均减小。Km值的减小可能是由于底物肌氨酸与两性离子型聚合物(poly-lysine)之间的相互作用,在底物结合区域维持较高的局部底物浓度,使得修饰酶与底物肌酸之间的亲和力得到加强;但也可能会造成酶分子柔性的降低及底物扩散阻力增加,使得修饰酶kcat减小。修饰后的kcat/Km值减小,说明修饰后催化效率有所下降,导致比酶活降低,见表3。

表3 修饰酶与游离酶的动力学参数比较Table 3 Kinetic parameters parameters of the free and modified creatinase
2.5 修饰酶与游离酶的稳定性比较
差式扫描量热法(DSC)一种热分析方法,可以测定蛋白质分子的半解折叠温度(Tm),分析其结构稳定性,以推测肌酸酶修饰后稳定性是否增加。结果表明,游离酶和修饰酶的热变性温度Tm分别为48.84℃和50.91℃,相同的升温速率,修饰酶比游离酶的Tm值高了2.07℃。
肌酸酶经poly-lysine修饰前后热稳定性的变化见图4(a)。游离酶在35~45℃的环境下酶活随着温度的升高而迅速降低,在40℃时酶活已下降为30%以下,而修饰酶在40℃处理30 min,酶活保留率仍在50%以上。肌酸酶经修饰后热稳定性明显提高。修饰后pH稳定性也有了明显的提高,见图4(b)。在pH值为4.0和10.0时,修饰酶酶活力仍保留在50%以上,而游离酶几乎没有活性。
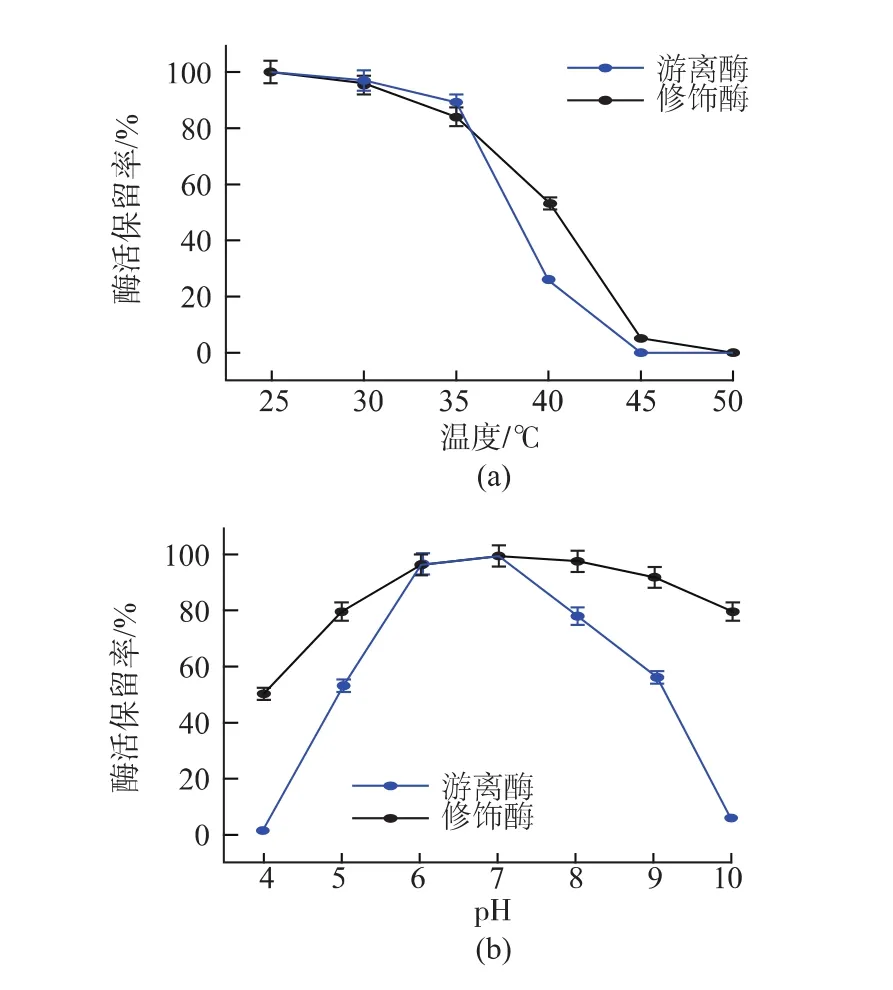
图4 游离酶与修饰酶的热稳定性与pH稳定性分析Fig.4 Thermal and pH stabilities of free and modified enzyme
推测poly-lysine修饰后,在肌酸酶酶表面形成“分子捆绑”作用,在一定程度上增强亚基间相互作用,多聚赖氨酸在单亚基表面形成覆盖层,也可使得单亚基构象次级链得到保护,从而抵御不良环境对酶的破坏,提高酶的稳定性。
3 结 语
Pseudomonas putida肌酸酶为含两个相同亚基的同源二聚体,采用相对分子质量4 000左右的poly-lysine对肌酸酶进行表面修饰,发现修饰酶的热稳定性、pH稳定性均有不同程度的提高。SDSPAGE电泳检测发现,poly-lysine分子捆绑后还出现了具倍乘关系的高相对分子质量肌酸酶聚合物的出现,可在进一步的研究中对其他修饰条件进行优化,例如调整poly-lysine的长度,肌酸酶的浓度等。本研究提供了一种新的提高肌酸酶稳定性的方法,并且也为其他多亚基酶的稳定性改造提供了一条可行的途径。
