应用高通量测序研究三文鱼片冷藏过程中的菌相变化
2019-10-30孟永宏尤毅娜郭玉蓉
房 杰,孟永宏,张 英,尤毅娜,郭玉蓉
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
关键字:高通量测序;三文鱼片;菌相分析;优势菌
目前,食源性疾病和食物中毒是食品行业的两个主要问题,威胁着消费者的身体健康和食品工业的发展[1]。许多类型的微生物都可以感染食物,从而增加食物中毒和食源性疾病的风险[2]。即食食品由于在食用前不进行加热,导致其被致病菌感染的概率大大增加。近年来,随着经济水平的提高,人们对海产品的消费不断增加,三文鱼以其鲜美的肉质、独特的口味和丰富的营养深受消费者的青睐。
由于三文鱼肉质细腻、口感爽滑、色泽鲜艳,主要以生食为主。此外,目前中国市场上的三文鱼多为挪威三文鱼,在挪威养殖捕捞、冷链运输后以冰藏方式销售[3]。冰藏温度并不足以完全抑制有害微生物的生长繁殖,生食冰鲜三文鱼的质量状况受到广泛关注。鱼的腐败是一个非常复杂的过程,涉及物理、化学及微生物三个方面[4],其中微生物是导致其腐败变质的主要原因[5]。因此,对三文鱼的菌相进行分析,探明其优势菌,对提高其防腐保鲜效果,降低食物中毒及食源性疾病发生的风险至关重要。但是,目前对三文鱼的菌相分析报道较少,且主要是通过传统培养、分离和鉴定的方法来进行研究[6]。然而传统的方法不能真正反映菌群多样性[7],难以对微生物的变化进行实时分析。此外,研究人员推测在自然界中有85%~90%的微生物目前还无法培养[8],大大限制了传统方法研究细菌群落的能力。变性梯度凝胶电泳(DGGE)虽属常规的分子生物学方法,但因操作复杂、成本高、DNA分离及测序的局限性等影响因素无法达到深入分析微生物多样性的目的[9]。2005 年,Margulies等在《Nature》上报道了一种快速、简单、成本低的测序方法—高通量测序技术(High throughput sequencing),在学术界引起了很大的反响。该方法测序信息丰富、速度快,仅100多天就可以完成对人类基因组的测序[10]。目前,许多科学家都在使用这种技术,是目前公认的分析细菌群落结构、确定优势菌的工具,已广泛应用于土壤[11-13]、水[14]、牛瘤胃[15]、肠道[16-17]等细菌群落的分析。虽然该技术已具有广泛的应用背景,但其在食品领域的应用较少。
作者以三文鱼片为研究对象,采用高通量测序技术,研究了其在冷藏过程中的群落多样性、菌相构成及菌相变化规律,并确定了优势腐败菌。
1 材料与方法
1.1 主要仪器、设备及试剂
高速离心机 (1-14型):Sigma公司;PCR仪:BIO-RAD公司;电泳仪(DYY-6C型):北京市六一仪器厂;培清JS-680B全自动凝胶成像分析仪(JS-680B型):上海培清科技有限公司。
Ezup柱式土壤基因组DNA抽提试剂盒:上海生工生物有限公司;Qubit2.0 DNA检测试剂盒:Life;SanPrep柱式DNA胶回收试剂盒:上海生工生物有限公司;引物合成及高通量测序:上海生工生物有限公司进行。
1.2 试验方法
1.2.1 三文鱼样品的处理采购于麦德龙超市的新鲜挪威三文鱼,将其分割为均匀的三文鱼片(3 cm×5 cm×0.3 cm)。放入无菌培养皿内,用聚氯乙烯保鲜膜密封,置于4℃冰箱内保存,分别于第0、1、2、3、4 天取样进行分析。
1.2.2 细菌总DNA的提取精确称取25 g肉样,用无菌剪刀剪碎放入50 mL离心管中,加入25 mL无菌水振荡混匀。4℃下2 500g离心5 min,转移上清液至10 mL离心管中,12 000g离心5 min,弃上清液。离心所得沉淀,采用Ezup柱式土壤基因组DNA抽提试剂盒,方法稍作调整。沉淀加入400 μL的SCL缓冲液,振荡混匀后,置于65℃水浴10 min,然后继续按照说明书上的操作步骤进行提取。提取的总DNA溶于40 μL TE缓冲液中,Qubit2.0检测DNA浓度,1 g/dL琼脂糖凝胶检测DNA完整性,置于-20℃保存。
1.2.3 PCR反应采用PCR扩增肉样细菌16S rRNA基因V3-V4可变区。第一轮PCR采用引物341F和 805R 进行扩增,PCR 反应体系 (50 μL):10×PCR 缓冲液 5 μL,dNTP(10 mmol/L)0.5 μL,基因组总 DNA 0.5 μL(20 ng/μL),Bar-PCR 引物 F(50 μmol/L)0.5 μL,引物 R(50 μmol/L) 0.5 μL,Plantium Taq(5 U/μL) 0.5 μL,ddH2O 42.5 μL。 PCR 扩增程序:94℃预变性 3 min;94℃变性30 s,45℃退火 20 s,65 ℃延伸 30 s,5个循环;94 ℃变性 20 s,55℃退火 20 s,72℃延伸 30 s,20个循环;72℃延伸5 min。以该PCR产物为模板进行第二轮PCR反应,第二轮扩增,引入Illumina桥式PCR兼容引物,PCR 体系 (50 μL):10×PCR 缓冲液5 μL,dNTP(10 mmol/L each)0.5 μL, 基因组总 DNA 1 μL(20 ng/μL),引物 F(50 μmol/L)0.5 μL,引 物 R(50 μmol/L)0.5 μL,Plantium Taq(5 U/μL) 0.5 μL,ddH2O 42 μL。 PCR扩增程序:95℃预变性 30 s;95℃变性 15 s,55℃退火 15 s,72℃延伸 30 s,5个循环;最后72℃再延伸5 min。PCR产物进行琼脂糖电泳检测后,对DNA进行回收。
1.2.4 DNA回收及高通量测序以PCR产物进行琼脂糖电泳后,在凝胶图像系统的紫外灯照射下切割高亮度条带所在位置的凝胶,称质量,进行胶回收。切下的凝胶置入1.5 mL EP管称重,然后加入质量∶体积=1∶1的连接缓冲液,置于56℃ 孵育,直至凝胶完全融化。取上述溶液 700 μL加入带有Hibind DNA柱子的 2 mL收集管中,室温10 000g离心 1 min。弃收集管中的液体,再加入300 μL的连接缓冲液,室温10 000g离心1 min。再次弃收集管中的液体,再加入700 μL的用无水乙醇稀释的SPW 洗脱缓冲液,室温10 000g离心 1 min。再次倒掉液体,将收集管空管室温13 000g离心 2 min,除去柱子中的无水乙醇。将Hibind DNA柱子置入新的1.5 mL离心管中,加入30 μL预热60℃的洗脱缓冲液,室温下13 000g离心1 min。所得PCR产物进行凝胶电泳检测。采用高通量测序技术,在Miseq测序平台上对回收DNA进行测序。
2 结果与分析
2.1 细菌总DNA的提取及PCR扩增结果
提取三文鱼片上的细菌总DNA,经1 g/dL琼脂糖凝胶电泳检测,表明在第 0、1、2、3、4 天从三文鱼片中均提取出了细菌总DNA且其完整性较好。以细菌总DNA为模板,采用引物341F和805R进行第一轮扩增,再以该PCR产物为模板,引入Illumina桥式PCR兼容引物进行第二轮PCR反应,将扩增产物经2 g/dL琼脂糖凝胶电泳检测后,直接对目的片段进行割胶回收,进行琼脂糖凝胶电泳检测,结果见图1,产物约为600多bp,其中包含了约为120 bp的测序接头和10 bp左右的标签,表明PCR扩增后获得约450 bp的特异性扩增片段。各样品均有较亮的带,扩增产量大,无副带或拖带,说明各样品总DNA提取成功,PCR扩增条件合适,可用于后续的高通量测序分析。

图1 样品中细菌16S rDNA的V3-V4可变区的PCR扩增产物电泳图Fig.1 PCR amplification products of V3-V4regions of sample DNA
2.2 测序基本数据分析
作者通过高通量测序技术检测三文鱼片细菌群落微生物细胞内特定的遗传物质16S rRNA,这些特定的遗传物质具有一定的保守性,保守区序列为同类微生物所共有,可变区序列反映了物种之间的序列差异[18-20]。因此,通过对可变区域序列的检测和对比分析,可以揭示三文鱼片的菌群结构及多样性。此外,作者主要在属水平对冷藏条件下三文鱼片的菌群结构进行分析,使用boot strapping方法估计分类的可信度。当可信度设为80%时,V3、V4区的序列可以正确分配到属的概率分别为98.1%和95.7%,满足分析需要。
在PCR扩增过程中会产生嵌合体和靶区域外序列,其中嵌合体是由于不同的模板混杂产生的错误序列,并非真实存在,而靶区域外序列则是引物非特异性靶定产生的序列,都会影响后续的序列分析质量。为了得到更高质量及更精准的分析结果,需要进行质量控制,即对有效序列进行去杂。如表1所示,采用高通量测序技术对三文鱼片在冷藏过程中的菌相进行分析,样品测序的总序列数为128531,其中,第 0、1、2、3、4 天五个样品的测序的序列数分别为 22742、25858、29643、25968及24320。质量控制后样品的总序列数为116180,各样品的序列数分别为21594、25356、25873、22796、20561,平均长度分别为 421.7、423.6、424.5、424.2、424.1 bp。质量控制后所有序列长度均为420~480 bp,满足前期设计引物时对目的片段约为465 bp的要求[21-22]。

表1 各样品测序基本数据信息Table 1 Basic sequencing data of each sample
2.3 样品的菌群结构
16S rRNA基因测序用于分析不同贮藏时期三文鱼样品的群落结构,在本研究中,采用高通量测序技术对16S rRNA的V3-V4区进行测序来评价三文鱼片的细菌群落结构。测序结果表明,在三文鱼片的菌群结构中含有281种菌属。如图2所示,在所有的三文鱼样品群落中,其优势菌属(>1%)为假单胞菌属 (Pseudomonas,37.20%)、发光杆菌属(Photobacterium,36.08%)、 希瓦氏菌(Shewanella,11.32%)、不动杆菌属(Acinetobacter,5.19%)、黄杆菌属 (Flavobacterium,2.48%) 和金黄杆菌属(Chryseobacterium,1.98%)。 第 0天时,样品的优势菌属依次为希瓦氏菌 (27.94%)、发光杆菌(13.74%)、假单胞菌(12.32%)、黄杆菌(12.15%)、金黄杆菌(9.54%)及不动杆菌(4.44%);第 1天时,各优势菌按其丰度大小依次为发光杆菌(40.75%)、假单胞菌(36.06%)、希瓦氏菌(10.96%)、金黄杆菌(5.44%)及不动杆菌(0.47%);第 2天时,依次为发光杆菌83.44%,假单胞菌9.74%、不动杆菌3.5%和希瓦氏菌3.1%;在第3天,各优势菌依次为假单胞菌 (64.82%)、发光杆菌 (22.83%)、希瓦氏菌(4.80%)、金黄杆菌(3.83%)及不动杆菌(2.97%);在储藏第4天,细菌群落中假单胞菌所占的丰度最大,为68.66%,其他的依次为希瓦氏菌11.88%、不动杆菌9.69%和发光杆菌8.88%。结果表明,随着储藏时间的延长,三文鱼片样品的细菌群落及优势菌的相对丰度不断地发生变化,但其主要优势菌的菌属种类保持不变。同时,在储藏后期,假单胞菌属的相对丰度达到最大,成为最优势菌属。水产品在储藏过程中其菌相不断变化,其原因可能是由于水产品上的微生物在不同的储藏条件下,其忍耐力不同,经过一定的适应、生长过程后,最终成为该条件下的优势菌[23]。三文鱼片在冷藏过程中,随着时间的延长,pH、水分、脂肪氧化程度等条件发生改变,导致在不同储藏时间其优势菌丰度的不同。

图2 三文鱼样品中优势菌属的相对丰度分布图Fig.2 Relative abundances of dominant bacterial genus in all salmon samples
2.4 样品多样性分析
选取Chao1指数、ACE指数、香农指数(Shannon Index)及Simpson指数初步评价样品的菌群丰度及多样性。Chao1指数及ACE指数常用于计算样品的菌群丰度,估计群落中含OTU数目。Shannon指数及Simpson指数用于估算样品中微生物的多样性,Shannon指数越大,群落多样性越高,Simpson指数越大,群落多样性越低。在97%的序列相似度下,从5个三文鱼样品中共鉴定出17 382个OTU,第 0、1、2、3、4 天时,样品 OTU 数目分别为3 322、4 053、3 259、3 412 及 3 336 个。
如表2所示,在第0天时,样品的Chao 1指数及ACE指数最大,表明此时三文鱼片上的细菌群落的OUT数目最多,菌群丰度最大。同时,其Shannon指数数值最大,而Simpson指数数值最小,表明在第0天时,三文鱼片的细菌群落的多样性最高。此外,Simpson指数在第2天时最大,表明第2天时样品的群落多样性最低。结合图2可知,可能是由于在第2天时,发光杆菌大量繁殖,其相对丰度已达到83.44%,抑制了其他微生物的生长,导致细菌群落多样性降低。此外,从各样品多样性指标可以看出,三文鱼片在冷藏过程中,其细菌群落的OTU数目及多样性均不断变化。
2.5 不同时间的三文鱼样品上的菌群结构的比较
作者采用高通量测序技术对三文鱼片在冷藏过程中第 0、1、2、3、4天的细菌群落进行深度分析,将所测得的序列按其序列间的距离进行聚类,在97%的相似度下分为操作分类单元 (OTU)。采用VENN图统计样本中共有的和独有的OTU数目,直观地展现出样品之间的异同。
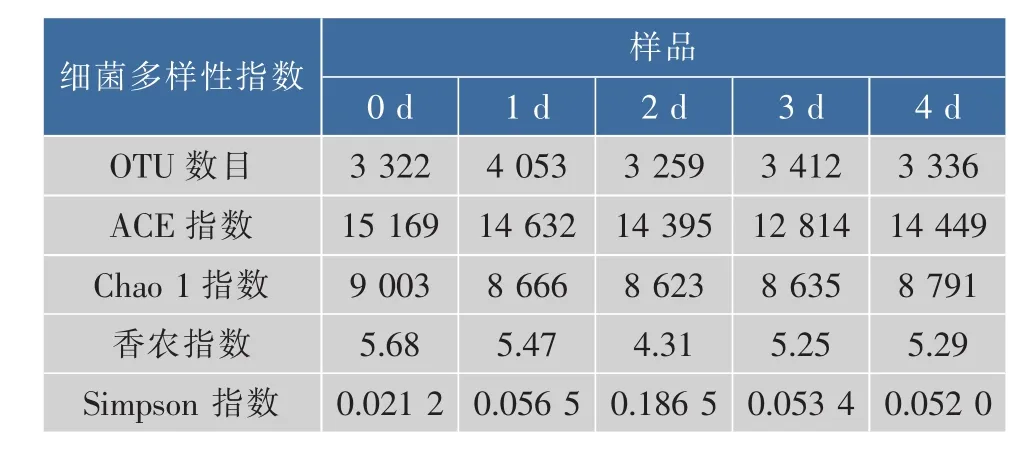
表2 三文鱼样品细菌多样性指数Table 2 Bacterial richness indices of salmon samples
在97%的序列相似性条件下,各样品的OTU数目共计17 382,每个样品平均含有3 476个OTU。 在第 0、1、2、3、4 天五个样品含有 502 个共有OTU,第0天与第1天、第1天与第2天、第2天与第3天以及第3天与第4天的共有OTU数目分别为 1 357、1 409、1 178 及 1 260,见图 3。 同时,第 0、1、2、3、4天五个样品的独有 OTU数目分别为1 644、1 498、1 478、1 271 及 1 396。 结果表明,三文鱼片在冷藏过程中,在第 0、1、2、3、4 天五个样品既有共有OTU也有各自独有的OTU,其细菌群落快速变化。结合前面的细菌群落丰度图,可以看出,尽管三文鱼片在冷藏过程中其菌群结构变化很大,但其主要优势菌属基本相同。
3 结 语
本研究首次应用高通量测序技术研究了三文鱼片在冷藏过程中的优势菌及菌相变化。结果表明,高通量测序所得序列中,相似度在97%以上且其丰度大于0.1%的有16个菌属,其中丰度大于1%的有6个菌属,分别为假单胞菌属(Pseudomonas)、发光杆菌属 (Photobacterium)、 希瓦氏菌(Shewanella)、不动杆菌属(Acinetobacter)、黄杆菌属 (Flavobacterium) 和 金 黄 杆 菌 属(Chryseobacterium)。 在第 0 天时,Chao 1 指数及ACE指数表明,样品细菌群落的丰度最高;多样性指数表明,此时其微生物多样性最高。随着储藏时间的延长,样品的多样性逐渐降低,且假单胞菌的丰度逐渐增大。而第2天时,由于发光杆菌大量繁殖,其相对丰度已达到83.44%,抑制了其他微生物的生长,导致其微生物多样性减少,假单胞菌的丰度降低。在第3、4天时,样品细菌群落中发光杆菌的相对丰度减少,假单胞菌属的相对丰度最大;在第4天时已达到68.66%,其优势性最强。高通量测序结果表明,三文鱼片在储藏过程中其菌相不断变化,但其主要的优势菌属保持不变。此外,在储藏后期(第4天),假单胞菌属成为三文鱼片最主要的优势菌。

图3 三文鱼样品维度图Fig.3 Venn diagram of all salmon samples
