肿瘤免疫治疗时代的NK细胞治疗
2019-10-30邓学文卢进张礼照沼裕
邓学文,卢进,张礼,照沼裕
135-0051 东京,日本生物治疗研究所(邓学文);610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 肿瘤内科中心(卢进、张礼);100-0004 东京,东京诊所(照沼裕)
1 肿瘤免疫治疗
手术、化疗和放疗作为肿瘤三大标准治疗方法,在提高肿瘤病人生存率、延长生存时间方面发挥着重要作用。但是,根治肿瘤之路依然任重道远,迫切需要开发新的治疗方法。2013年,美国科学杂志发布肿瘤免疫治疗时代来临[1]。近年来,免疫治疗作为肿瘤第四治疗方法,正在快速发展并受到极大关注。免疫治疗不同于传统标准治疗直接杀伤癌细胞,而是通过激活机体免疫系统来驱除和消灭癌细胞。
目前,免疫治疗包括以CTLA-4和PD-1为代表的免疫检查点抑制剂和免疫细胞治疗。研究CTLA-4的美国人詹姆斯·艾莉森和研究PD-1的日本人本庶佑获得2018年诺贝尔生理学/医学奖,这不仅是对他们研究成绩的肯定,更充分证明了肿瘤免疫治疗的前景和价值。有人把CTLA-4和PD-1在肿瘤治疗领域的成功与抗菌素史上发现青霉素比肩,预示着免疫治疗肿瘤的新纪元。因此,我们可以大胆预测,今后将会出现越来越多利用免疫原理的抗肿瘤药物。免疫细胞治疗包括多种不同细胞类别。目前,美国食品药品管理局已批准了树突状细胞疫苗(Sipuleucel-T)治疗前列腺癌和CAR-T细胞治疗小儿B细胞白血病和淋巴瘤。随着研究的进展,将会开发出更多肿瘤免疫治疗的细胞制剂。
2 自然杀伤(natural killer,NK)细胞
NK细胞是淋巴细胞的一种,发现于二十世纪七十年代中期,因不需要预先致敏直接杀伤癌细胞而命名[2]。NK细胞是自然免疫的重要成分,通过直接攻击应急的、感染的和变质的细胞,对机体保持内环境稳定发挥着重要作用[3-4]。
NK细胞占外周血淋巴细胞的10%~20%[5],其表现型为CD3-CD14-CD19-CD56+CD16+。目前,一般通过流式细胞仪测定NK细胞(图1)。NK细胞根据CD56分子发现强度和CD16分子表达又可进一步分为功能不同的两个亚型[6-7]。CD56dimCD16+NK细胞占外周血液和脾脏NK细胞的90%,主要以细胞杀伤功能为主,CD56brightCD16dim/-NK细胞主要分布在淋巴结,以产生细胞因子、免疫调节功能为主[6,8]。

图1流式细胞仪测定的外周血NK细胞
从外周血中分离单个核白细胞,用CD3荧光抗体和CD56荧光抗体染色后,BECKMAN COULTER FC500流式细胞仪测定,CYTOMICS CXP软件分析NK细胞及其亚型。横轴为CD3抗体荧光强度,纵轴为CD56抗体荧光强度。在淋巴细胞集团中,CD3阴性CD56阳性细胞集团为NK细胞。NK细胞中CD56荧光表达弱的细胞集团为CD56dimNK细胞亚型;CD56荧光表达强的细胞集团为CD56brightNK细胞亚型。
NK细胞的功能活动取决于NK细胞表面活性化受体和抑制性受体刺激信号的强弱对比,当活性化信号强于抑制性信号时,NK细胞就活性化,反之就处于抑制状态。每个NK细胞表面至少发现有一个抑制性受体,这些抑制性受体主要包括Killer-Ig-Like Receptors(KIRs)和CD94-NKG2A异聚体,它们分别认识细胞表面的组织相容性抗原HLA-Ⅰ和HLA-E,以保护正常细胞不受NK细胞伤害[9-10](图2)。NK细胞通过抑制性受体识别靶细胞,同时,抑制性信号在NK细胞成熟过程中给与其功能训练[11-12]。没有受到抑制性信号刺激的NK细胞是低反应细胞。只有经过自己组织相容性抗原抑制性信号刺激的NK细胞才赋予其功能[13-14]。因此,NK细胞识别癌细胞,病毒感染细胞主要是由于这些细胞的组织相容性抗原MHC-Ⅰ表达减弱或消失(图2)。当然,仅有MHC-Ⅰ表达减弱或消失还不足以活化NK细胞[14]。
NK细胞活性化受体包括NKG2D,以及自然活性受体(natural cytoxicity receptors, NCRs)NKp46,NKp44和NKp30等[15]。当NKG2D与靶细胞表面的糖蛋白MICA、MICB或ULBPs结合,或NCRs与硫酸肝素结合时,就会启动NK细胞内活性信号[16-17]。癌变细胞表面活性化受体表达增强就会激活NK细胞发挥免疫监视效应,使之发现和清除新发生的癌细胞。特别是当癌细胞MHC-Ⅰ表达降低并同时表达活性受体,NK细胞识别癌细胞并活性化,进而释放穿孔素和颗粒酶,启动癌细胞凋亡和杀伤机制[18]。同时,活性化的NK细胞还会释放IFNγ、TNFα等细胞因子,不但协同杀伤癌细胞,还可以活化其它免疫细胞,增强免疫防御能力(图2)。
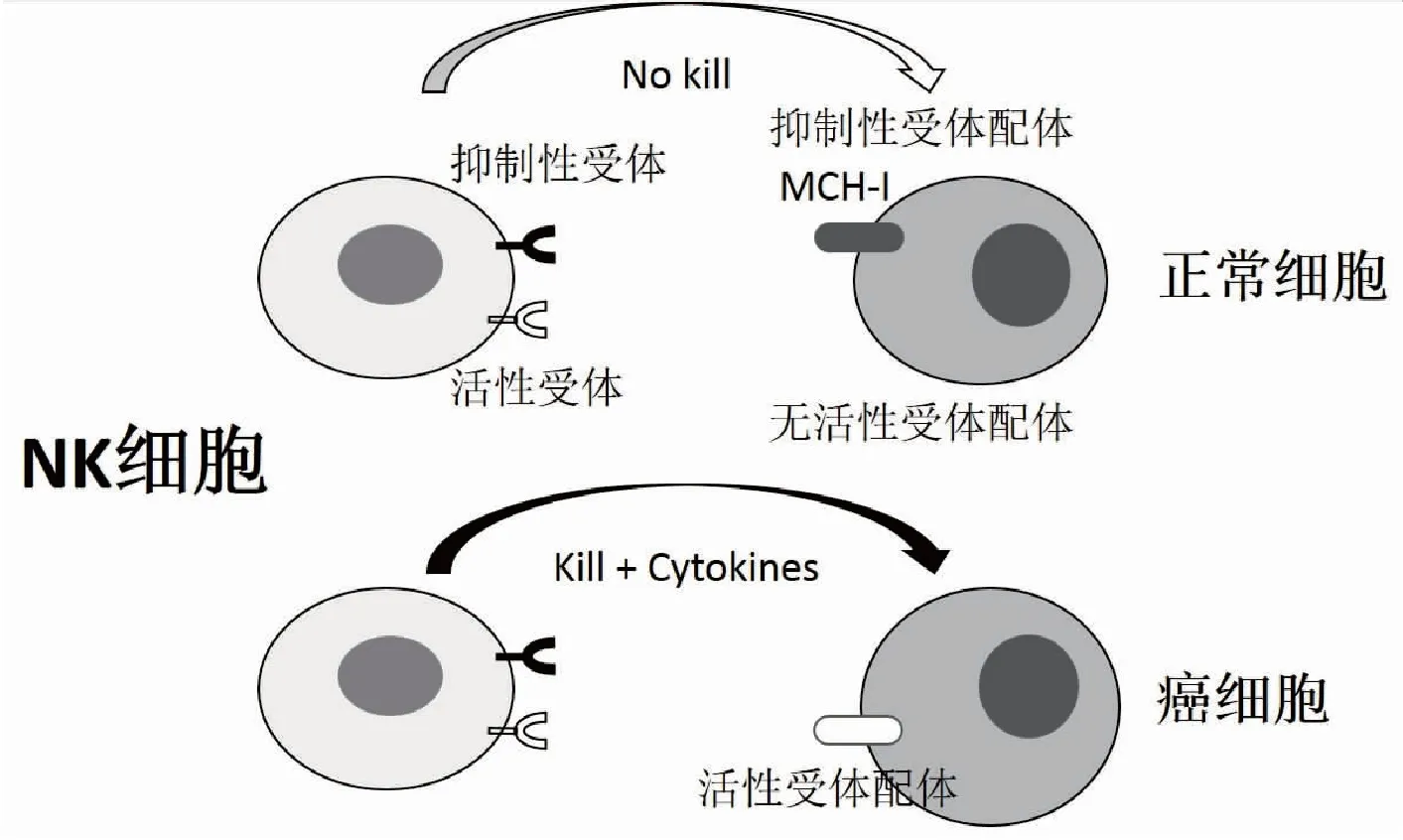
图2 NK细胞识别正常细胞和癌细胞
上图,正常细胞表达抑制性受体配体MHC-I而无活性受体配体表达,因此,NK细胞功能被抑制,不会杀伤正常细胞。下图,癌细胞抑制性受体配体MHC-I表达消失并且表达活性受体配体,因此,NK细胞活性化,直接杀伤癌细胞,同时释放细胞因子活性化免疫反应。
3 NK细胞与癌症的发生和进展
动物模型研究表明,癌症发生率在缺失NK细胞的鼠比野生鼠更高[19-20]。使用缺失获得性免疫功能的鼠模型证明,NK细胞具有肿瘤免疫监视和免疫编辑作用[21]。日本研究人员Imai等[22]对3625名日本居民随访11年发现,NK细胞活性低的人群比中或高人群患癌风险明显增高。我们对乳腺癌的研究也表明,乳腺癌病人的NK细胞活性明显低于健康人,有转移的乳腺癌病人NK细胞活性进一步降低[23]。胃癌[24]、大肠癌[25]和肾癌[26]等的临床病理研究表明,癌组织中NK细胞浸润的多寡与病人预后有关,NK细胞浸润越多预后越好。因此,NK细胞在癌症的发生和进展中发挥着重要作用。
4 外科手术与NK细胞功能
手术作为实体瘤的主要治疗方法,在肿瘤治疗中发挥着重要作用。但是,肿瘤病人手术后的复发和转移,严重影响病人长期生存的事实不可否认,并早已引起广泛关注[27-28]。Demichi等回顾分析了1 173名接受了手术治疗的乳腺癌病人和250名非手术乳腺癌病人的生存时间,发现手术病人有两个死亡高峰,分别出现在第3年和第8年,而非手术病人只有一个死亡高峰出现在第4年[29-30]。因此,部分病人甚至可能因为手术而加速肿瘤的复发和转移,导致病人生存时间缩短。动物研究表明,手术促进癌细胞转移,降低生存率[31-32],其原因部分与手术本身有关。近年研究表明,免疫细胞功能障碍与手术后复发转移密切相关[33-34]。
NK细胞作为先天性免疫细胞,在外伤、手术以及危重状态时会出现严重的功能障碍[33,35-36]。NK细胞功能障碍的程度和时间与损伤强度有关。NK细胞功能障碍可以是一过性的,但其生物学影响则可能长期持续,包括对感染和损伤修复的影响[37-38]。研究表明,手术切除实体瘤可能增加肿瘤复发、转移甚至死亡风险[39-40]。早在1913年就已观察到肿瘤手术切除与转移的关系[27],但是直到近年的研究才发现细胞免疫功能障碍在其中所扮演的角色[33-34]。特别是围手术期NK细胞功能障碍与肿瘤手术后的复发和转移密切相关[33-34]。研究表明,NK细胞功能在手术后第1天已经降低,并与肿瘤的转移程度相关[31]。肿瘤病人复发率也与术后NK细胞功能障碍程度密切相关[41]。因此,在围手术期使用增强免疫功能的细胞因子,如IL-2、GM-CSF、TNFα、IFNα等可以降低手术后肿瘤的复发和转移[42-43]。鉴于这些细胞因子都有增强NK细胞活性的功能,进一步验证了NK细胞在防御肿瘤手术后复发和转移中的作用。
手术后NK细胞功能障碍的机制复杂,涉及手术后血液高凝状态,释放抗炎性反应因子和免疫抑制性细胞增加等[44]。对这些机制的深入研究,将有利于开发肿瘤围手术期免疫治疗的新方法,降低肿瘤手术后的转移和复发,提高肿瘤病人治疗效果和预后。
5 活性化NK细胞治疗
基于NK细胞的肿瘤免疫作用,特别是不受组织相容性抗原和肿瘤抗原限制直接杀伤癌细胞的特性,自然会想到使用NK细胞治疗肿瘤[45-46]。由于外周血中NK细胞数量少,肿瘤病人NK细胞活性降低,因此需要在体外扩增和活性化NK细胞[46]。国际上报道了一些NK细胞活性化培养方法,其中多数需要使用滋养细胞刺激培养,为临床转化应用和监管带来了一些难度[46]。日本开发了一种不使用滋养细胞培养NK细胞的技术,并已做成试剂盒(BINKIT®)在国际上推广使用[47]。BINKIT®操作简单,可以从外周血单个核细胞中直接培养活性化NK细胞,在2至3周内使外周血NK细胞活性化扩增上千倍[48]。BINKIT®培养的NK细胞高表达活性受体,并且细胞因子产生能力比培养前的NK细胞明显提高,对癌细胞的杀伤活性也明显增强[48]。同时,培养NK细胞的细胞杀伤活性明显强于培养γδT细胞和培养αβT细胞[49]。因此,培养NK细胞是非特异性免疫细胞治疗的首选。培养NK细胞静脉注射后可使体内免疫活性化,外周血NK细胞活性增强[47]。使用BINKIT®培养自己NK细胞开展肿瘤免疫细胞治疗,在日本一般是每2至3周治疗1次(图3),6次为一个疗程。近10年就有超过6万人次以上NK细胞治疗,除偶有发热等不良反应外,没有需要治疗的副作用发生,证明NK细胞治疗的临床安全性。NK细胞治疗通常与树突状细胞治疗,温热治疗和低剂量化疗联合应用,已观察到可以延长进展期胰腺癌的生存时间[50],以及提高乳腺癌单抗治疗效果等作用[51]。随着治疗案例的累积,NK细胞治疗的效果将会得到进一步发挥和体现。

图3NK细胞治疗流程模式图
一般1次采取30mL~50mL外周血,从中分离单个核白细胞,选择性培养NK细胞。培养时间为2~3周。经过细菌,真菌,支原体和内毒素检测确定安全性后,静脉点滴回输到病人体内。癌症病人治疗时一般1个疗程6次,NK细胞回输前采取下次NK细胞培养的血液。
6 发挥NK细胞治疗作用的方法和策略
鉴于肿瘤病因/病理机制的复杂性,使任何单一肿瘤治疗方法都有其局限性。因此,需要扬长避短,综合治疗。手术是实体瘤的重要治疗方法,特别是对减轻肿瘤负荷具有非常重要的作用[52]。但是,手术本身以及其对机体免疫功能的影响,又可能引起和促进肿瘤的复发和转移[39-40]。特别是围手术期NK细胞功能障碍与术后肿瘤复发/转移密切相关[33-34],因此,尽量减少手术对机体免疫功能的影响,以及术后尽早提高和恢复免疫功能,包括开展NK细胞等免疫细胞治疗,对于预防和控制复发/转移,提高治疗效果具有积极意义[31-33]。
近年来,分子靶向治疗的迅速发展,为肿瘤病人提供了新的治疗手段和希望[53]。靶向药物包括阻断癌细胞表面信号的抗体和细胞内信号传递的药物。抗体药物不仅可以阻断细胞表面信号传递抑制癌细胞增殖,还可以通过其Fc激活免疫细胞,发挥抗体依存性细胞毒性活性(antibody-dependent cell-mediated cytotoxicity, ADCC)[54]。NK细胞表达CD16分子,可以与抗体Fc结合,是重要的ADCC效应细胞[54]。我们以表皮生长因子受体表达阳性的A549肺腺癌细胞株为靶细胞测定培养NK细胞的杀伤活性,即便A549细胞表达抑制性受体配体MHCⅠ,培养NK细胞仍然可以杀伤A549细胞,当同时添加西妥昔单抗时,则显著提高培养NK细胞对A549细胞的杀伤活性(图4)。因此可以期待,当抗体药物与NK细胞治疗联合应用时,可以发挥协同效应。临床上,我们也观察到曲妥珠单抗治疗耐药的乳腺癌病人,当联合NK细胞治疗后,其病情明显改善[51]。另外,阻断癌细胞内信号传递的靶向药物,在抑制癌细胞增殖的同时,也使癌细胞表面NK细胞活性化受体表达增强,有利于NK细胞发挥免疫监视作用[55]。因此,分子靶向药物联合NK细胞治疗有望提高治疗效果,有待今后的临床研究。
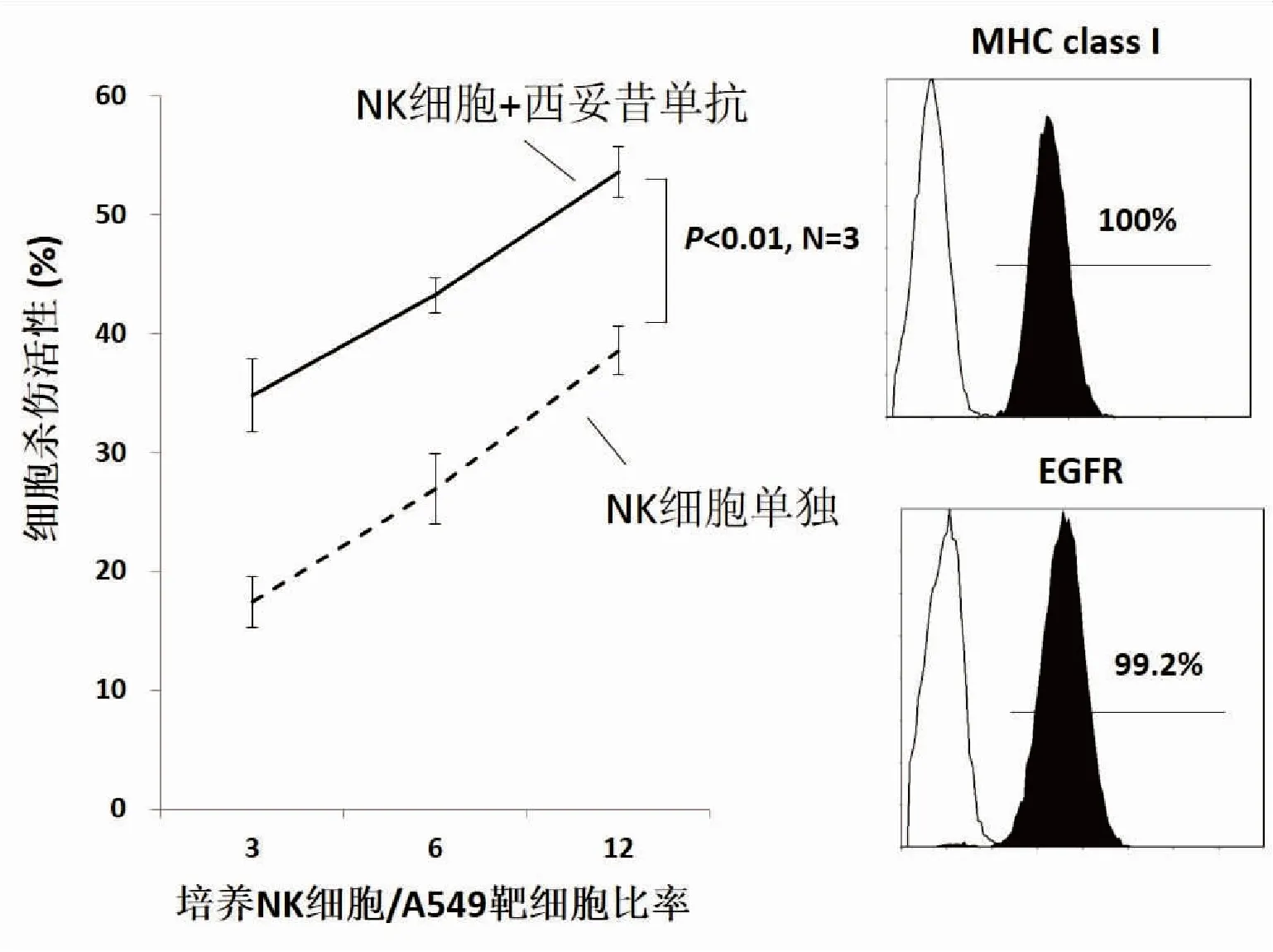
图4西妥昔单抗增强培养NK细胞杀伤癌细胞活性
右图,靶细胞A549肺腺癌细胞株表达MHC-I和表皮生长因子受体。左图,横轴为培养NK细胞与靶细胞的比率,纵轴为细胞杀伤活性。用Calcei-AM染色A549后,按一定比率与培养NK细胞共同培养。用TERASCAN VP测定培养前/后的荧光量,根据荧光量的变化计算出细胞杀伤活性。虚线为培养NK细胞单独杀伤A549的活性,实线为培养NK细胞与A549培养时添加西妥昔单抗后的细胞杀伤活性。西妥昔单抗明显增强培养NK细胞对A549的细胞杀伤活性。
肿瘤治疗的重点和难点在于复发和转移。其中上皮间叶转化(epithelial-mesenchymal transition, EMT)是肿瘤转移的重要机制[56]。虽然EMT可以逃逸T细胞免疫[57],但是其表达NK细胞活性分子,可以致敏NK细胞免疫监视机制[58]。因此,增强NK细胞活性,包括NK细胞治疗,将有助于阻止和预防肿瘤的转移。
7 总结与展望
总之,随着肿瘤免疫研究的进展,今后将会有越来越多利用免疫机制的治疗药物和方法进入临床,造福肿瘤病人。NK细胞作为可以直接杀伤癌细胞的免疫细胞,如何在肿瘤综合治疗中发挥作用,特别是对肿瘤微小病变,以及肿瘤复发/转移中发挥功效,有待深入临床研究。
