硫化氢可通过改善肺动脉内皮间质转化减轻野百合碱诱导的大鼠肺动脉高压
2019-10-29蔺艳军毛承誉潘建安张绘莉
张 卉, 蔺艳军, 毛承誉, 潘建安, 张绘莉
上海交通大学医学院附属第九人民医院心内科,上海 200001
肺动脉高压(pulmonary artery hypertension,PAH)是一种由多种病因引起的以肺动脉血管压力持续升高及肺血管重构为特征的慢性进行性疾病。这种疾病严重限制了右心室的功能,并导致右心功能衰竭,甚至死亡[1]。内皮间质转化(endothelial-to-mesenchymal transition,EndMT)是一种复杂的生物学过程,即内皮细胞失去内皮细胞特异性蛋白的表达,呈现典型的间充质细胞形态和功能,获得细胞运动性和收缩性[2]。EndMT不仅参与胚胎发育过程,还与炎症、纤维化、PAH等疾病密切相关[3-7]。
硫化氢(hydrogen sulfide,H2S)是继一氧化氮和一氧化碳之后的第3种细胞内气体信号分子,通过蛋白质过硫化物的形成或蛋白质硫化水解参与多种生理和病理过程[8-9]。H2S参与调节细胞凋亡、细胞周期和氧化应激,在心血管系统中具有重要的生理作用[10-13]。研究[14-15]表明,H2S可减轻肺血管重构和PAH。然而,H2S与PAH中EndMT之间的关系鲜有报道。因此,本研究拟通过大鼠PAH模型和细胞研究,探讨H2S能否调控肺动脉EndMT过程,及其与H2S抗PAH作用之间的关系。
1 材料与方法
1.1 实验动物及分组 40只SPF级雄性SD大鼠,10周龄,体质量(250±15) g,由上海交通大学医学院附属第九人民医院动物房提供。大鼠适应性喂养2 d后,随机分为对照组、模型组、硫氢化钠(NaHS)组和炔丙基甘氨(PAG,H2S合成抑制剂)组,每组10只。除对照组给予0.9%氯化钠溶液注射外,其他3组动物一次性腹腔注射MCT 60 mg/kg制备PAH模型,注射7 d后分别腹腔注射等体积0.9%氯化钠溶液、NaHS 1 mg·kg-1·d-1、PAG 10 mg·kg-1·d-1。
1.2 细胞培养及分组 人肺动脉内皮细胞(HPAECs)购自ScienCell公司。细胞在含有5%的胎牛血清(FBS)、100 U/mL的青霉素、100 μg/mL的链霉素和1%内皮细胞生长因子的内皮细胞培养基(ECM)中培养,在干预24 h前接种于6孔板中。干预前,用无血清培养基冲洗细胞2次,将细胞分别予以0.9%氯化钠溶液或硫氢化钠NaHS 50、100、200 μmol/L预处理2 h;以转化生长因子β1(TGF- β1)10 ng/mL分别刺激1 h、3 d、10 d,收获细胞。分别观察Snail、血管内皮钙黏蛋白(VE-cadherin)、α平滑肌肌动蛋白(α-SMA)表达水平和细胞形态学变化。
1.3 大鼠血流动力学和右心室肥厚指标测定 大鼠经腹腔注射4%水合氯醛0.9 mL/kg麻醉后[14],暴露右侧颈外静脉并将PE导管引导通过上腔静脉、右心房、右心室进入肺动脉。通过BL-420S生物机能实验系统,将导管体外末端连接到压力传感器以记录肺动脉压的连续变化,包括收缩期肺动脉压(PASP)、舒张期肺动脉压(PDSP)和平均肺动脉压(mPAP)。处死大鼠后,分离和洗涤大鼠心脏,沿房室沟锐性剪掉左右心房组织,分别剪取右心室游离壁(RV)及左心室+室间隔(LV+S),用滤纸吸去心室表面血液后称质量,计算右心室肥厚指数(right ventricular hypertrophy index,RVHI)。RVHI=RV/(LV+S),RVHI>0.33时表示右心室肥大。
1.4 苏木精-伊红(H-E)染色观察大鼠肺血管结构变化 将大鼠肺组织于4%多聚甲醛中固定后,石蜡包埋切片(5 μm),脱蜡和水化后行H-E染色。在光学显微镜(200倍和400倍)下观察血管外径为50~100 μm的小血管。采用Image J图像分析软件测量肺小动脉管壁厚度。
1.5 免疫印迹检测蛋白的表达 将称重后的肺组织或消化后的细胞加入到细胞裂解液中充分匀浆后,于4℃裂解30 min,然后在4℃、12 000 r/min条件下离心15 min,获得澄清的组织匀浆或细胞裂解物。通过蛋白质定量(BCA)法测定蛋白质浓度。用SDS-PAGE凝胶对蛋白质(20 μg)进行分离后转移到硝酸纤维素膜上,用5%脱脂牛奶将膜封闭2 h。然后,在4℃下用一抗孵育过夜:VE-Cadherin兔多克隆抗体(1∶1 000,Abcam公司),α-SMA小鼠单克隆抗体(1∶1 000,Abcam公司),Snail兔单克隆抗体(1∶1 000,CST公司),β-actin兔多克隆抗体(1∶1 000,Abcam公司)。次日,回收一抗后将膜在TBST中充分洗涤,用抗兔IgG(1∶10 000,CST公司)和抗小鼠IgG(1∶10 000,CST公司)避光孵育1 h。回收二抗后用TBST充分洗涤,在Odyssey双色红外激光成像系统中显影,对条带灰度值进行统计分析。
1.6 免疫荧光检测蛋白的表达 将肺组织石蜡切片放入60℃烘箱内烘烤20 min,二甲苯脱蜡后用柠檬酸钠抗原修复液(pH 6.0)修复抗原。将切片放置于湿盒中,用5%山羊血清于37℃封闭1 h,去除封闭液,滴加VE- cadherin兔多克隆抗体(1∶100)和α-SMA小鼠单克隆抗体(1∶100)在4℃下孵育过夜。次日,将复温的切片用PBS漂洗3次后,用抗兔IgG(1∶1 000,CST公司)和抗小鼠IgG(1∶1 000,CST公司)在37℃下避光孵育1 h。用Hoechst染细胞核3 min,滴加抗荧光淬灭剂封片。在光学显微镜(400倍)下观察,并通过Fluoview程序拍照。
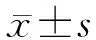
2 结 果
2.1 大鼠体质量、肺动脉压力、右心室肥厚情况 MCT注射21 d后,对照组大鼠无死亡,模型组死亡3只,NaHS组死亡1只,PAG组死亡4只。结果(表1)显示:与对照组相比,模型组大鼠体质量减小,mPAP、PASP升高,RVHI增加(P<0.05),证明PAH模型构建成功。与模型组相比,NaHS组大鼠体质量增加,mPAP、PASP降低,RVHI减小(P<0.05);PAG组体质量进一步减小,mPAP、PASP进一步升高、RVHI进一步增加(P<0.05)。
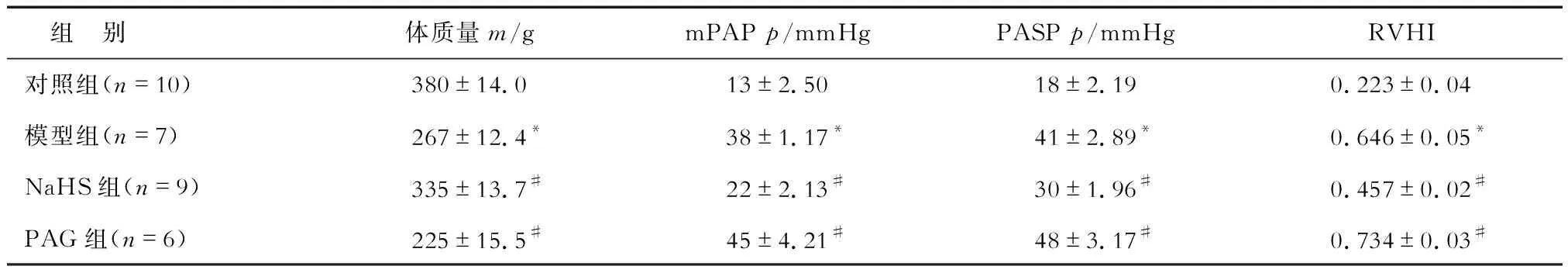
表1 各组PAH大鼠体质量、mPAP、PASP、RVHI比较
PAH:肺动脉高压;NaHS:硫氢化钠;PAG:炔丙基甘氨;mPAP:平均肺动脉压;PASP:肺动脉收缩压;RVHI:右心室肥厚指数.*P<0.05与对照组比较;#P<0.05与模型组比较
2.2 大鼠肺小血管形态学变化 大鼠肺组织H-E染色结果(图1)显示:对照组肺小动脉管壁较薄,血管结构清晰,内皮细胞分布均匀,外膜无明显血管外基质沉积;模型组肺小动脉管壁增厚明显(P<0.05),管腔狭窄,血管中膜增生明显,周围组织炎性浸润;NaHS组肺小动脉管壁增厚明显减轻(P<0.05),炎症细胞浸润减少;PAG组肺小动脉管腔接近闭塞(P<0.05),血管壁失去正常结构。
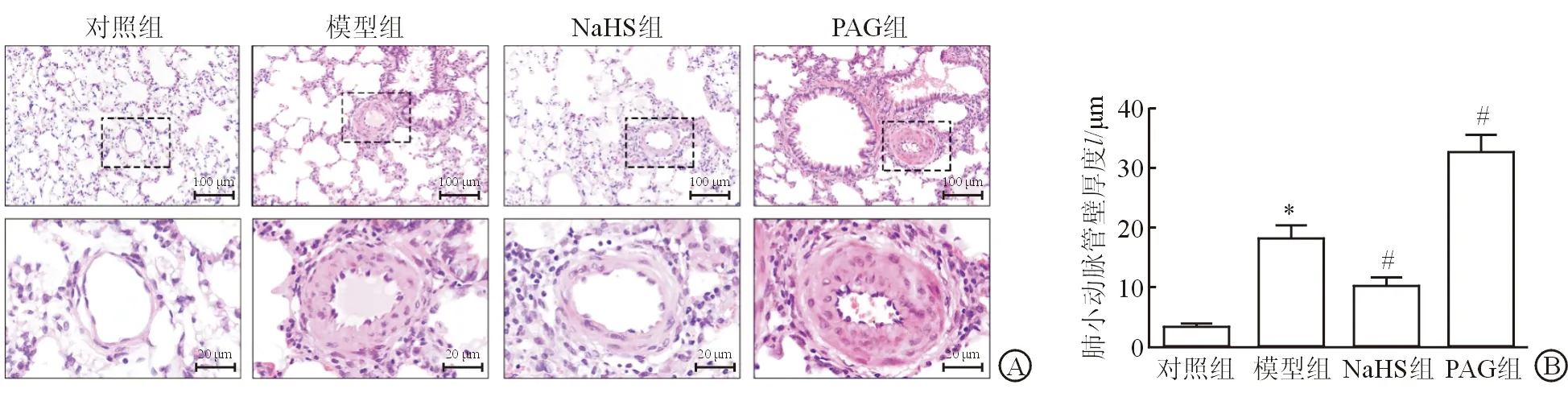
图1 硫化氢对MCT诱导的PAH大鼠肺组织的影响
2.3 大鼠EndMT情况 免疫印迹结果(图2)显示:与对照组相比,模型组Snail和α-SMA表达增加,VE-cadherin表达减少(P<0.05)。与模型组相比,NaHS组Snail和α-SMA表达减少,VE-cadherin表达增加(P<0.05);PAG组Snail和α-SMA表达进一步增加,VE-cadherin表达进一步减少(P<0.05)。
免疫荧光结果(图3)显示:与对照组相比,模型组VE-cadherin表达减少,α-SMA表达增加。与模型组相比,NaHS组VE-cadherin表达增加,α-SMA表达减少;PAG组VE-cadherin表达进一步减少,α-SMA表达进一步增加。
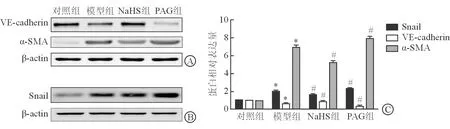
图2 免疫印迹检测硫化氢对MCT诱导的PAH大鼠EndMT的影响
A:VE-cadherin和α-SMA;B:Snail;C:相对表达量比较.*P<0.05与对照组比较;#P<0.05与模型组比较

图3 免疫荧光检测硫化氢对MCT诱导的PAH大鼠肺小血管EndMT的影响
2.4 HPAECs形态学变化 对HPAECs予以TGF-β1刺激10 d后,于倒置显微镜100倍视野下观察细胞形态,结果(图4)显示:对照组细胞排列规则,相互融合,细胞核呈卵圆形,以典型的“鹅卵石”样生长;TGF-β1组细胞呈梭形生长,细胞间分界明显,呈现出平滑肌样细胞特征;NaHS预处理后,梭形细胞明显减少(P<0.05),细胞形态介于前2组之间。
2.5 HPAECs的EndMT情况 结果(图5)显示:TGF-β1诱导后,HPAECs中Snail、α-SMA表达增加,VE-cadherin表达减少(P<0.05)。NaSH预处理可剂量依赖性地逆转这一变化,即Snail、α-SMA表达减少,VE-cadherin表达增加(P<0.05)。
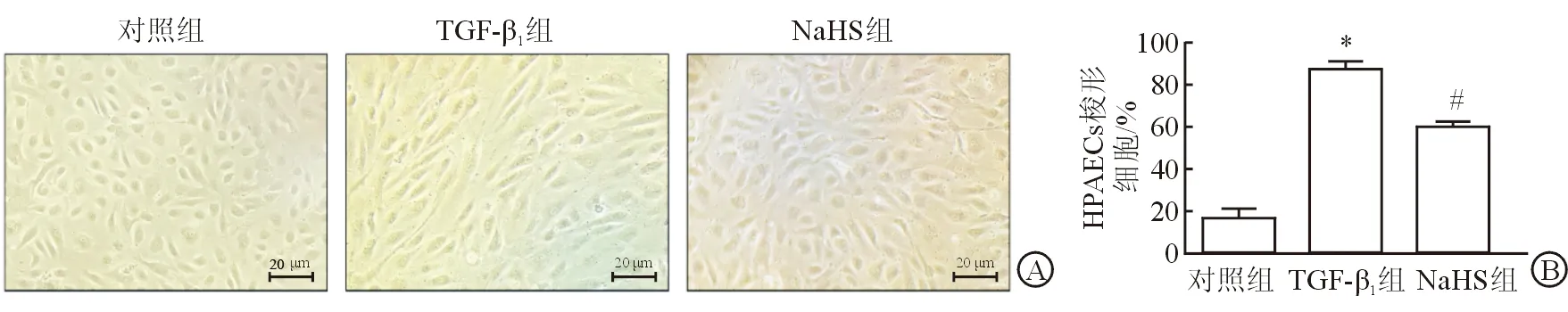
图4 硫化氢对TGF- β1诱导的HPAECs形态学变化
A:TGF- β1诱导10 d后形态学变化;B:TGF- β1诱导10 d后,梭形细胞比例比较.*P<0.05与对照组比较;#P<0.05与TGF- β1组比较
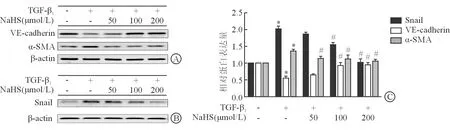
图5 免疫印迹检测硫化氢对TGF- β1诱导的HPAECs EndMT的影响
A:TGF- β1诱导3 d后VE-cadherin和α-SMA相对表达量;B:TGF- β1诱导1 d后Snail相对表达量;C:蛋白相对表达量统计学比较.*P<0.05与对照组比较;#P<0.05与模型组比较
3 讨 论
内皮细胞发生EndMT的特征性变化主要表现为α-SMA增加、波形蛋白磷酸化及VE-cadherin的减少。EndMT已被证实存在于PAH患者,也可见于MCT诱导、MCT联合缺氧和血管内皮生长因子受体阻滞诱导的PAH动物模型中。EndMT主要表现为内皮细胞迁移至内皮下间质,Twist-1表达增加,由p120连环蛋白和VE-cadherin介导的细胞黏附丧失[2-3, 6]。本研究进一步验证了这些表型变化。
在心血管系统中,H2S主要由胱硫醚-γ-裂解酶(cystathionine-γ-lyase, CSE)产生,能通过扩张血管维持心血管稳态,在抑制血管平滑肌细胞增殖和预防胶原重塑方面具有重要作用[15-16]。本课题组研究[17]已证明,给予NaHS (1 mg·kg-1·d-1)可以促进小鼠内皮细胞血管紧张素转换酶2(ACE2)的表达和血管紧张素1-7(Ang 1-7)的产生,进而减轻小鼠动脉粥样硬化。H2S的异常产生和功能障碍是几种重要心血管疾病发展的关键因素,例如原发性高血压、PAH、动脉粥样硬化、血管钙化和心脏肥大。
既往研究[18-20]已证实,H2S可以通过舒张平滑肌、抑制内皮素诱导的平滑肌细胞增殖或降低肺动脉内皮细胞炎症水平来减轻大鼠PAH。但是,H2S是否通过调节EndMT来调控肺血管重构及PAH的进程,目前尚不清楚。本研究表明,外源性给予H2S供体(NaHS)显著逆转了EndMT过程,即NaHS部分改善了内皮细胞VE-cadherin的缺失和α-SMA的增加。由于手术时间不长,本研究在水合氯醛麻醉下[14],短时间内经右心导管检测肺动脉压力,发现NaHS减轻了PAH程度;采用PAG抑制内源性H2S的合成后,则进一步促进了EndMT的发生,加剧了肺血管重构及PAH进程。本研究结果表明,H2S可能通过抑制EndMT,在MCT诱导的PAH中对肺组织发挥一定的保护作用。
TGF-β1是具有多种功能的细胞因子。有研究[21-22]表明,其参与血管内皮细胞EndMT过程。本研究应用TGF-β1刺激HPAECs 后3 d获得明显的EndMT,予以NaHS预处理后,内皮细胞的表型转变被逆转,与在MCT诱导的大鼠模型中的发现一致。
Snail是一个转录因子家族,通过抑制钙黏蛋白的表达来促进EndMT[23]。因此,本研究还检测了Snail表达水平的变化。动物模型的研究结果表明,模型组Snail表达增加,而NaHS干预后,Snail表达减少;与之相反,用PAG抑制内源性H2S后,则进一步刺激了Snail的表达。体外实验结果与此结果一致。本研究结果进一步表明,H2S可通过抑制Snail的激活,影响PAH肺组织中EndMT现象。
此外,H2S还可能通过其他机制影响EndMT或上皮间质转化(EMT)。有研究[24]表明,在肾小管上皮细胞中,H2S可通过抑制TGF-β1诱导的细胞外信号调节激酶(ERK)和Wnt/β-连环蛋白(β- catenin)通路的转导,减轻TGF-β1诱导的EMT。Ying等发现,H2S可以通过Src途径预防内质网应激诱导的EndMT[25]。此外,也有研究[26-28]发现,H2S可能通过Smad、Scr和p38途径抑制EndMT。
综上所述,本研究证实,H2S能减轻MCT诱导的大鼠PAH,此作用可能与其改善肺组织EndMT的作用有关。体外实验进一步证实,H2S作为一种新型气体信号分子,在EndMT中发挥重要的调控作用。H2S在PAH、纤维化、伤口修复、炎症和恶性肿瘤中可能具有潜在的应用前景,值得进一步研究。
