风信子鹿角珊瑚对环境因子的响应研究
2019-10-26马鸿梅王云祥秦传新段丁毓朱文涛陈丕茂
马鸿梅,王云祥,秦传新,段丁毓,朱文涛,陈丕茂
(1.中国水产科学研究院南海水产研究所,国家农业科学渔业资源环境大鹏观测实验站,中国水产科学研究院海洋牧场技术重点实验室,广东省渔业生态环境重点实验室,广州 510300;2.江苏海洋大学海洋生命与水产学院,江苏连云港 222005)
我国珊瑚礁主要分布在南沙、西沙、东沙群岛,及海南省、广东省和台湾省附近海域,约占世界总量的18.48%[1]。珊瑚礁通常分布在水流交换优良、透明度高、风浪缓和的低浓度溶解无机盐海区,在海洋生物多样性保护、渔业资源保护、减轻温室效应等方面起到了积极的生态作用[2]。近年来,随着海洋开发活动不断发展,近海生态环境却在不断恶化,如污水的排放、违规采集、炸鱼、挖掘再沉积[3],以及风暴[4]、厄尔尼诺现象[5]、寒潮[6]等因素的影响,使得我国近岸珊瑚礁生态系统退化严重。邹仁林等[7]在广东大亚湾和广西北部湾调查发现21属45种珊瑚,由于经济生产活动和自然环境变化等原因,珊瑚礁资源退化严重。2015年7月王云祥等[8]对大亚湾海域造礁石珊瑚进行普查发现,该海域整体珊瑚覆盖度为41.15%,最高覆盖率为55%,最低覆盖率仅为13%,覆盖度差异较大,近3年内珊瑚死亡率较高。
影响珊瑚礁生态系统的因子较多,水温是造成珊瑚白化的一个重要因子[9-10]。相关研究表明,在夏季雨量充沛时,随着CO2值的不断升高,经地表径流的淡水会使珊瑚发生白化[11];HOEGH等[12]于1999年发文认为,再过80年将会有70%的珊瑚礁生活在酸化海域。过强的紫外线辐射也会迫使虫黄藻脱离珊瑚,而泥沙或者大型藻类的覆盖也会造成珊瑚的窒息性死亡[13]。因此,本研究以大亚湾海域土著珊瑚风信子鹿角珊瑚(Acropora hyacinthus)为研究对象,通过正交试验探讨温度、盐度、光强、pH对珊瑚生长以及虫黄藻(Zooxanthella)数量的影响,探讨风信子鹿角珊瑚对环境因子变化的响应模式,筛选其最适生长环境条件,以期为大亚湾珊瑚资源保护提供理论依据。
1 材料与方法
1.1 实验珊瑚的采集与暂养条件
风信子鹿角珊瑚采自深圳南澳岛及周边水域(22°33′50.78″~22°40′38.18″N、114°30′35.62″~114°33′26.90″E),实验用海水取自七星湾天然海水,将现场采集到的活体珊瑚迅速放入暂养桶,氧气泵供氧,运输期间暂养桶避光。1 h后到达暂养车间,将珊瑚样品放入暂养池(4 m×3 m×1.5 m),同时用氧气泵供氧,保持水流循环,暂养车间棚顶为透明玻璃板。阴雨天期间,暂养池上方距离水面1 m安装有5盏120 W蓝色光源的金属卤化灯,当车间内的光照强度不足1 500 lx时,开启金属卤化灯,日落后关闭光源,光照时间同野外环境保持一致。暂养5~7 d后,珊瑚触手完整伸展时即可开始实验。1组珊瑚实验完毕后,将珊瑚放回到暂养池中,与未进行过实验的珊瑚分开摆放。
1.2 实验方法
将实验用珊瑚放入20 cm×30 cm×20 cm的有机玻璃箱中,待珊瑚状态稳定不释放粘液后,放入光照培养箱中进行实验。实验按照L25(56)正交表进行,设计了4个环境因子(温度、pH、光强、盐度),每个环境因子5个梯度,共计25组实验(表1),每组实验设置3个重复,每个梯度持续观测5 d,每天上午9∶00拍照观测珊瑚的形态,在第5天用剪刀截取珊瑚一个分枝(30~40 cm2),于显微镜下通过血球计数板统计虫黄藻数量。实验期间分别在0、4、12、24、72、120 h采集水样,依据《海洋监测规范》(GB12763.4—2007)中的实验方法,用靛酚蓝法测定水中氨态氮浓度(NH+4-N),用抗坏血酸还原钼蓝法测定活性磷浓度(PO3-4-P)。
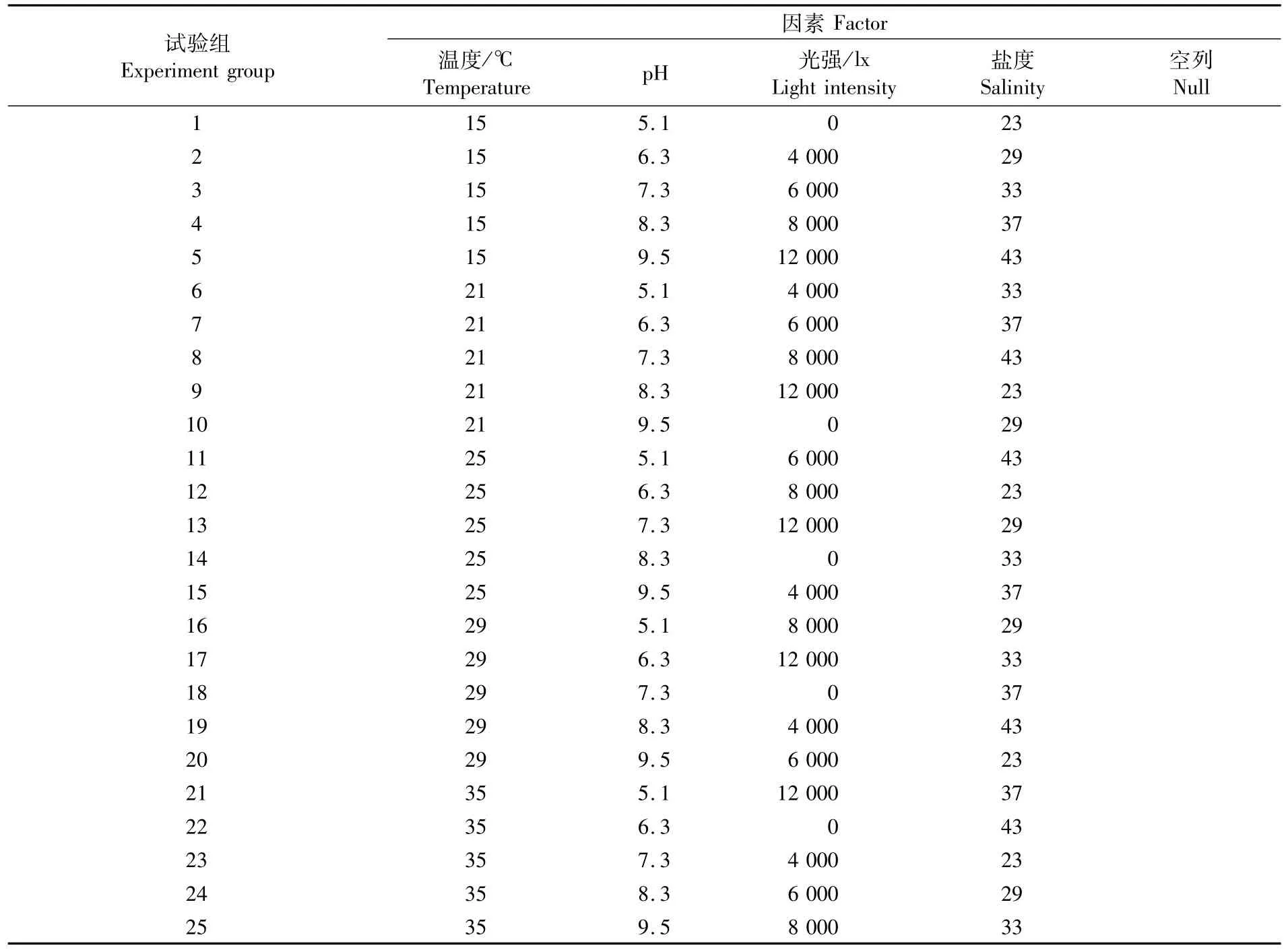
表1 L 25(56)正交表实验方案表Tab.1 L 25(56)orthogonal experiment table
1.3 样品处理
实验进行至第5天时,用剪刀直接在水中取样,尽量减少珊瑚裸露在空气中的时间,迅速放入预先准备好的采样瓶中,并编号记录,将剩余珊瑚放回原暂养池。采集好的珊瑚样品逐一取出并用铝箔纸包裹,放入4℃冰箱保存30 min,去除表面粘液。然后将铝箔纸冲洗干净,烘干准备称重,取珊瑚池中的清洁海水经0.45μm滤膜过滤,置于洗牙器中,冲洗珊瑚至水螅体分离骨骼,准确量取冲洗液体积。摇匀冲洗液,再取9 mL冲洗液加入1 mL甲醛溶液(10%)放入10 mL离心管中,1 h内将其他珊瑚样品全部处理完后,再把全部盛有冲洗液的离心管放入离心机中离心10~15 min,速度设为4 000 r·min-1。离心后取上清液,置于血球计数板中统计虫黄藻的单位面积个数。
1.4 数据处理
珊瑚表面积共生虫黄藻密度采用以下公式计算:
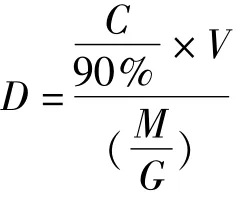
式中,D:共生虫黄藻密度;C:共生藻浓度;V:冲洗液体积;M:包裹在珊瑚样品外的铝箔重量;90%:固定液中原液比例;G:铝箔单位面积质量。通过6个相等面积的方格计算铝箔平均单位面积质量,用包裹珊瑚表面的铝箔间接估算珊瑚的表面积。
2 结果与分析
2.1 不同环境因子对风信子鹿角珊瑚虫黄藻密度的影响
实验结果表明(图1,表2),当水温超过30℃后,珊瑚在短时间内出现白化;水温在15℃时,珊瑚体内共生虫黄藻平均密度为2.698×106个·cm-2(图1-a)。pH为5.1时,珊瑚在4 h即出现虫黄藻脱落现象,在24 h后水体呈现淡黄色,至120 h珊瑚已濒临死亡,出现大面积的白化(图1-b);随pH值上升,珊瑚状态逐渐转好,pH为8.3时,虫黄藻密度最高达到2.576×106个·cm-2;但当水体中pH超过9.0时,4 h后珊瑚表面覆盖有一层白色薄膜,虫黄藻脱离表面,12~24 h即发生白化死亡。风信子鹿角珊瑚对低盐环境有一定耐受性,对高盐环境则反应较为激烈。当盐度为33时,虫黄藻密度最高为2.418×106个·cm-2(图 1-c);当盐度继续升高,虫黄藻数量随之减少,在盐度为37时,虫黄藻密度下降60%,至盐度升高到43时,珊瑚48 h内白化死亡。在低盐度环境,虫黄藻密度随盐度降低呈缓慢下降状态;盐度为23时,珊瑚在4 h时开始分泌粘液,24 h时虫黄藻已开始脱离水螅体,至实验结束,水体呈现淡黄色,但珊瑚并未完全白化死亡。光强因子对虫黄藻密度的影响差异不显著,为次要因素。当光强在6 000 lx时,虫黄藻密度最高为2.050×106个·cm-2;当光强为最低(0 lx)和最高(12 000 lx)时,5 d实验未对珊瑚造成明显影响:光强为0 lx时,珊瑚48 h后触手不再伸展,至实验结束后,珊瑚与水体均无显著变化;当光强最高为12 000 lx时,至实验结束珊瑚触手正常伸展,但有部分虫黄藻逐渐脱离宿主,珊瑚颜色变浅,水体中可见轻微的淡黄色,虫黄藻密度为 1.736×106个·cm-2,显著低于6 000 lx时虫黄藻密度,可见珊瑚在强光照射下通过降低虫黄藻密度以维持正常的光合作用水平。
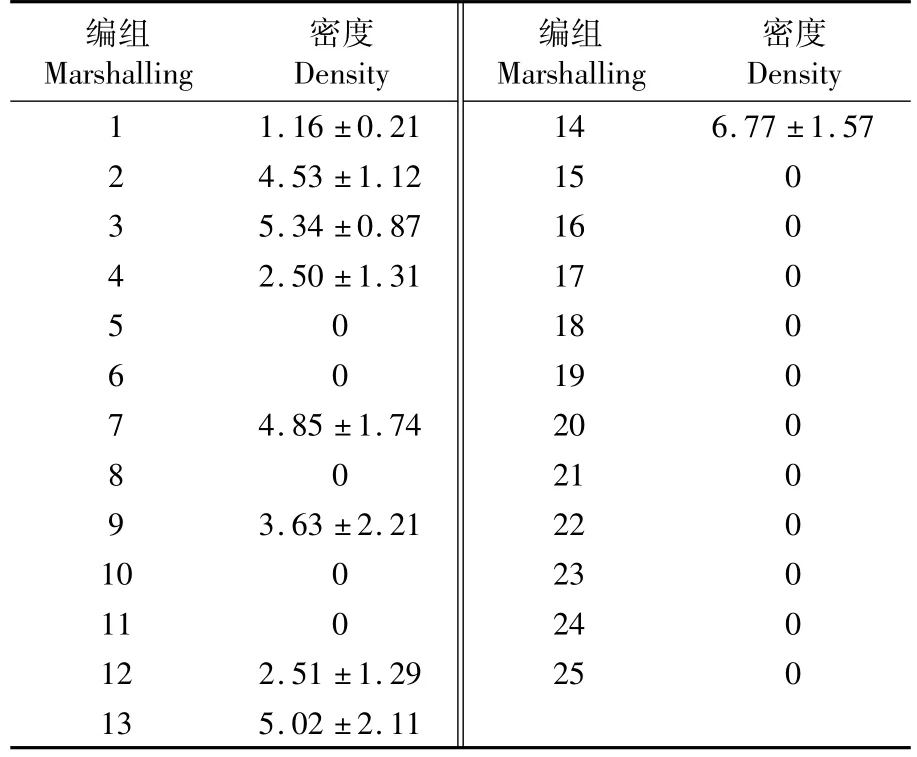
表2 各试验组虫黄藻密度Tab.2 Coral Zooxanthella density(×106个·cm-2)
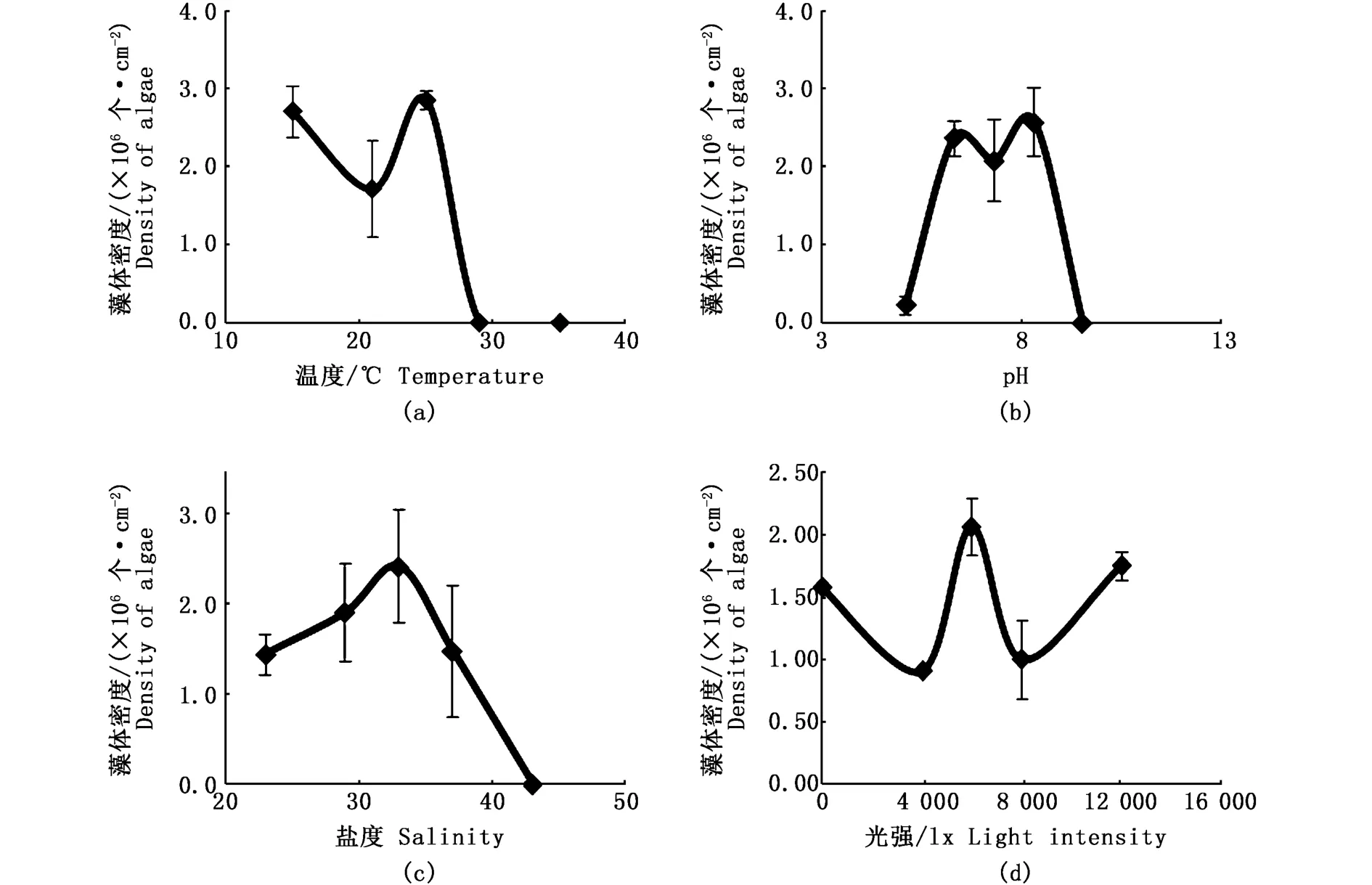
图1 环境因子变化对虫黄藻数量的影响Fig.1 Effects of different environmental factors on the number of Zooxanthella
2.2 环境因子变化对NH+4-N浓度的影响
根据以上不同环境因子对虫黄藻数量的影响可以得出,在水温25℃、盐度33、pH 8.3、光照6 000 lx环境下虫黄藻的数量达到最高值,因此筛选这4个环境指标,观察珊瑚代谢对NH+4-N浓度的影响。结果表明:温度为25℃时,随着盐度、pH、光强的变化,第11组与第15组差异显著(P<0.05)。第11组限制性因素为盐度43、pH 5.1,光强6 000 lx,24 h时NH+4-N开始显著增长,72 h后珊瑚濒临死亡,水体表现为水质恶化伴有腥臭味出现,至实验结束NH+4-N浓度显著升高(P<0.01);第15组限制性因子为盐度37、pH 9.5、光强4 000 lx,在72 h时NH+4-N开始出现放量式增长,可见高pH水环境对珊瑚造成严重的危害(图2-a)。盐度为33时,随着温度、pH、光强的变化,第6、17组变化差异明显(P<0.05),第6组限制因子为温度21℃、pH 5.1、光强4 000 lx,在酸性水体中珊瑚表现出一定范围内的耐受力,本组中水体的NH+4-N浓度在120 h时达到最高,珊瑚白化;第17组限制因子为温度29℃、pH 6.3、光强12 000 lx,在12 h时NH+4-N浓度开始升高,72 h时出现峰值,珊瑚死亡(图2-b)。pH 8.3时,随着温度、盐度、光强的变化,第19、24组NH+4-N浓度变化差异显著(P<0.05),第19组限制因子为温度29℃、盐度43、光强4 000 lx,至72 h NH+4-N浓度上升至峰值,即发生白化;第24组限制因素为温度35℃、盐度29、光强6 000 lx,珊瑚在12 h时白化,72 h时水体中NH+4-N浓度最高,珊瑚出现死亡(图2-c)。光强为6 000 lx时,随着温度、盐度、pH的变化,第 11、20组NH+4-N浓度变化差异显著(P<0.05),第11组限制因素为pH 5.1,120 h时水体中NH+4-N达到最高,珊瑚死亡;第20组限制性因子为pH 9.5,珊瑚在48 h内出现白化,72 h时水体NH+4-N浓度升高,珊瑚死亡(图2-d)。
2.3 环境因子变化对PO3-4-P浓度的影响
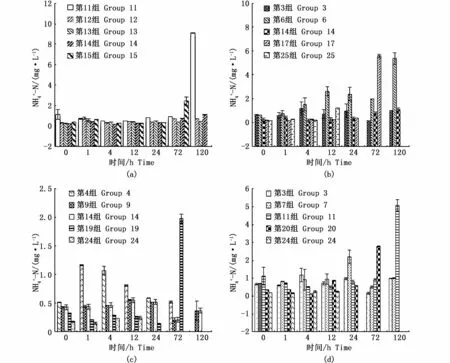
图2 环境因子变化对NH+4-N浓度的影响Fig.2 Effects of coral metabolism on the concentration of NH+4-N under different environmental factors
通过观察珊瑚代谢对PO3-4-P浓度的影响发现,水温25℃下,第11、15组差异显著(P<0.05),第11组在24 h时,PO3-4-P开始显著性增长,且PO3-4-P出现快速增长的时间早于NH+4-N,72 h后珊瑚白化,出现死亡(P<0.01);第15组在72 h时PO34--P开始出现放量式增长(图3-a)。盐度33条件下,第 6、17、25组 PO34--P浓度的变化差异显著(P<0.05),第6组在120 h时浓度明显升高,珊瑚出现白化;第17组72 h时PO34--P浓度显著升高;第25组的主要限制因子为高温,pH为9.5,在12 h时珊瑚即发生白化,水体中PO34--P浓度显著上升(图3-b)。pH 8.3条件下,第4、19、24组水体中PO34--P浓度变化差异显著(P<0.05),第4组的PO34--P在低温、高盐下释放较快,24 h时升至峰值,之后开始下降;第19组在4 h后-P开始释放,至72 h上升至峰值,即发生白化,本组PO34--P浓度变化趋势与NH4+-N浓度变化趋势相同;第24组珊瑚在高温状态下反应剧烈,短时间内水体中PO34--P未见显著性增长(图3-c)。光强为6 000 lx的各组中,第11组珊瑚72 h出现死亡,120 h水体PO34--P浓度显著升高;第20组珊瑚在48 h内白化,72 h时水体PO34--P浓度达到峰值,珊瑚出现白化;第24组珊瑚在72 h时白化,水体中PO34--P浓度达到峰值(图3-d)。
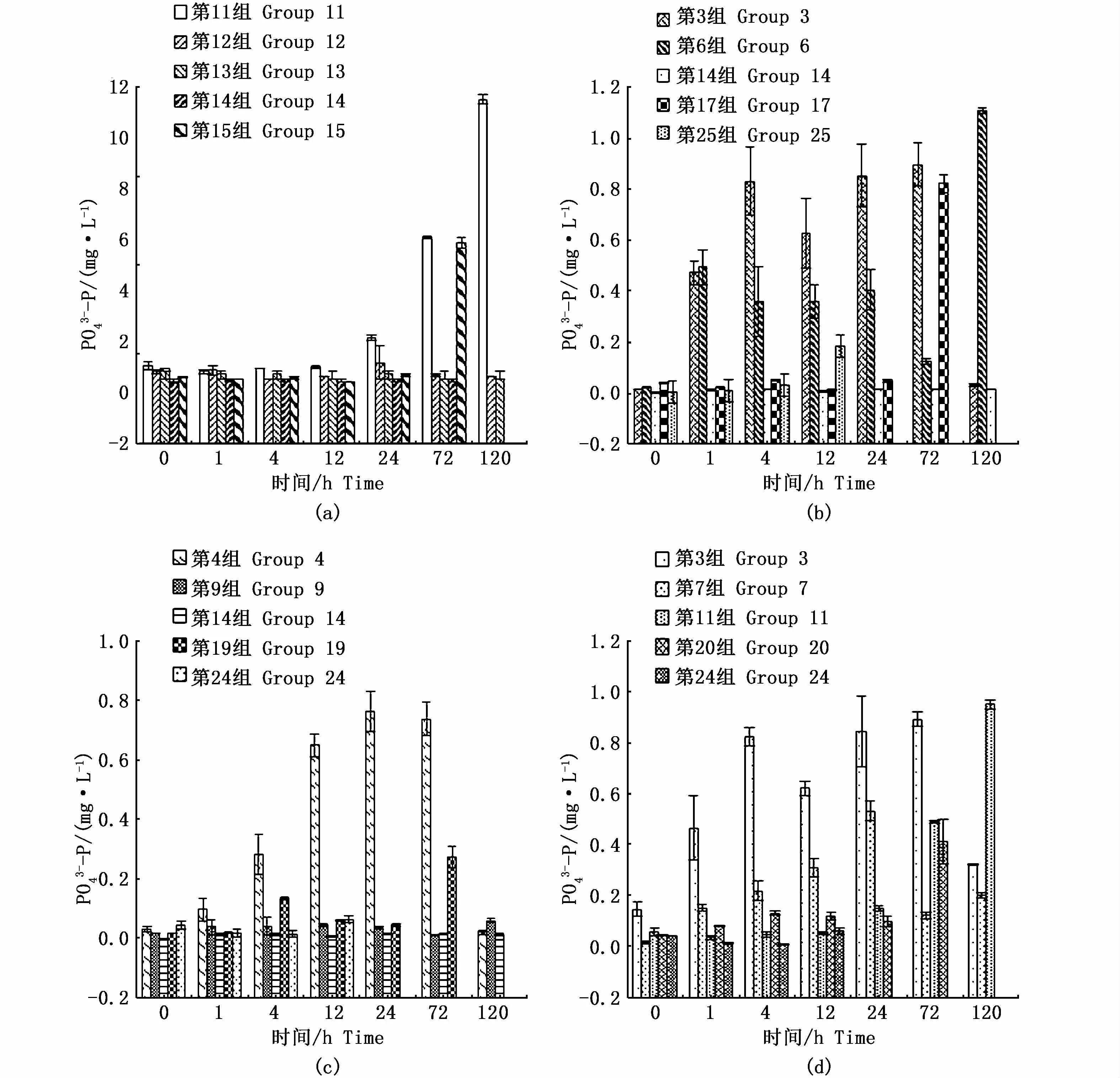
图3 环境因子变化对PO3-4-P浓度的影响Fig.3 Effects of coral metabolism on the concentration of PO3-4-P under different environmental factors
3 讨论
造礁石珊瑚对外界环境的改变较为敏感,其自适应过程主要体现为氮磷水平及其虫黄藻含量的变化,适宜的生长温度一般为23~28℃[14],大亚湾海域年均最低温14~15℃[15]。实验中25℃时珊瑚单位面积虫黄藻密度最高,水体中营养盐浓度呈现出先下降后升高趋势,15℃时珊瑚的虫黄藻密度和营养盐浓度变化均不显著。在日本海生活的石珊瑚中22.5%的种类能够忍受10.5℃低温,超过48%的种类可以忍受14.1℃的低温[16]。雷新明等[9]研究富营养化与共生藻关系中指出,NH+4-N浓度增高的水体会影响珊瑚的光合效率,从而降低珊瑚的虫黄藻密度与叶绿素含量。本研究中,珊瑚在29℃的水体中经过96 h培养后开始分泌粘液,此时水体中NH+4-N浓度显著高于72 h时的NH+4-N浓度(P<0.01),120 h后珊瑚基本白化。珊瑚白化程度主要是由外界干扰所引起的虫黄藻流失造成[17],相关研究指出,当温度超过34℃时,珊瑚体内的细胞功能完全紊乱,共生藻的分解速度加快,随着珊瑚粘液的分泌流入海水中,珊瑚光合作用完全停止[18]。
盐度是影响造礁石珊瑚存活的重要因子,适宜珊瑚生长的盐度范围是27~40,低盐环境可能会对珊瑚造成严重影响[19]。本研究中风信子鹿角珊瑚最适盐度是33,当珊瑚处在盐度29的环境中,单位面积共生藻密度为 1.907×106个·cm-2,显著低于盐度33时的水平。已有研究指出,盐度在小范围内的波动并不会短时间内致珊瑚白化死亡,但是珊瑚不具备调节渗透压的能力[20],因而如果珊瑚长时间置于此环境会抑制珊瑚的光合作用效率,进而影响珊瑚的钙化速率,最终发生白化死亡。珊瑚生存环境一般为偏碱性,pH在8.0~8.5之间为正常水平[21]。珊瑚可以通过调节自身的酸碱度来适应环境,在pH偏低情况下珊瑚依然可以存活[22]。但是当pH下降至6.3以下时,珊瑚单位面积虫黄藻数量迅速下降,说明当水质一旦超过珊瑚的耐受范围,无论伤害到宿主还是虫黄藻都会引起共生藻脱离宿主。SUZUKI等[23]于日本野外的实验证实,珊瑚礁在夜晚会发生净溶解。大洋区珊瑚发生溶解现象较为少见,海岸带附近溶解现象较为普遍[24]。而当海洋酸化问题与温度升高协同作用时,珊瑚将会在更低的温度下发生白化[25]。海水温度的升高将使珊瑚发生更多的不可逆疾病与白化问题,未来的珊瑚礁区多样性将会受到不可忽视的影响[26]。FINE等[27]研究指出,有骨骼的珊瑚在酸化的实验条件下能够以海葵状的形式维持基本的生命功能,包括生殖能力,并且当它们重新进入正常的海洋环境时,能够恢复骨骼的建造。因此在一定的强度范围内,并非所有珊瑚都受到海洋酸化的胁迫。
光强是影响珊瑚钙化效率的重要因子,在适当的光照强度下,虫黄藻可将光合作用所吸收的95%的碳转移至水螅体中,为宿主的不断钙化提供必不可少的能源[28]。正是由于虫黄藻的多样性对光照强度有着不同需求,造成了珊瑚垂直分布的多样性[29]。在本实验中,珊瑚在6 000 lx光强时单位面积虫黄藻密度最高,而珊瑚处在无光照环境中时,虫黄藻密度相对大于低光强(4 000 lx)时。在沉积物较多、透明度低的海区,珊瑚会通过增加共生藻密度以增加叶绿素-a含量的方式来维持其在恶劣环境中的生存[30]。DUBINSKY等[31]的研究证实,当珊瑚面对高强度光照时,珊瑚体内的共生藻浓度和叶绿素-a浓度都会出现较为明显的下降,以降低光合效率,保护光合器官。当光强超过珊瑚承受的正常水平时,珊瑚可调整体内的荧光蛋白含量,将吸收的多余光能以荧光方式转移出体表,可以起到保护光合系统的目的。
综上所述,温度为25℃、盐度为33、pH为8.3、光强为6 000 lx时,是风信子鹿角珊瑚最适宜存活条件。近年来由于经济生产活动和气候变化,珊瑚礁资源正面临着前所未有的生存挑战,大亚湾经济快速发展的同时,水环境污染应该引起高度重视。本研究确定了风信子鹿角珊瑚的最适环境因子,可以为将来室内培育珊瑚以及野外珊瑚移植提供参考依据。
